Bài 13. Luyện tập chương 1: Các loại hợp chất vô cơ
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (486.02 KB, 15 trang )
TIẾT 18
LUYỆN TẬP CHƯƠNG 1:
CÁC LOẠI HỢP CHẤT VÔ CƠ
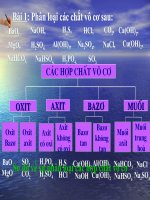
Bài 1: Phân loại các chất vô cơ sau:
BaO,
NaOH,
H2S,
HCl,
H2SO4, Al(OH)3, Na2SO4,
MgO,
NaHCO3,
NaHSO4,
H3PO4,
SO3.
CO2, Ca(OH)2,
NaCl, Cu(OH)2,
C¸c hîp chÊt v« c¬
oxit
Axit
Baz¬
Muèi
Muèi
Axit
Baz¬
Oxit Oxit
Muèi
Baz¬
Axit
trung
kh«ng
kh«ng
Baz¬ axit cã oxi
axit
tan
hoµ
cã oxi
tan
H3PO4 H2S Ca(OH)2 Al(OH)3 NaHCO NaCl
SO3
BaO
3
Sơ
đồ
về
sự
phân
loại
các
hợp
chất
vô
cơ
MgO
H2SO4 HCl NaOH Cu(OH)2 NaHSO Na2SO4
CO2
4
Tính chất hoá học của các loại hợp
chất vô cơ:
OXIT AXIT
OXIT BAZƠ
?
+ Axit
+ Oxit axit
Nhiệt
+ H2O phân
huỷ
?
+ Bazơ
+ Oxit bazơ
?
?
MUốI
?
+ H2O
+ Bazơ
?
?
BAZƠ
?
+ Axit
+
Kim
loại
+ Axit
+ Bazơ
+ Oxit axit
+ Oxit bazơ
+ Muối
+ Muối
?
AXIT
Chú thích:
Muối + Muối
Muối + kim loại
Hai muối mới.
Kim loại mới + Muối mới.
Muối nhiệt phân huỷ sinh ra nhiều chất
khác.
Bài tập 2:
Căn cứ vào sơ đồ biểu thị những tính chất hóa học của chất vô cơ,
hãy chọn các chất thích hợp để viết các phương trình hóa học cho
mỗi loại hợp chất
Làm việc theo nhóm trong 5 phút
Nhóm 1: làm phần 1.Oxit
Nhóm 2: làm phần 2. Bazơ
Nhóm 3: làm phần 3.Axit
Nhóm 4: làm phần 4.Muối
1. Oxit
nước
a) Oxit bazơ + ……….. → bazơ
Na2 O + H2O → 2NaOH
b) Oxit bazơ + ............. → muối + nước
axit
Na2O + H2SO4 → Na2SO4 + H2O
c) Oxit axit + ………… → axit
SO3 + H2O → H2SO4
nước
d) Oxit axit + ………. → muối + nước
CO2 + 2NaOH → Na2CO3 + H2O
bazơ
e) Oxit axit + Oxit bazơ → ……….
CaO + CO2 → CaCO3
muối
2. Bazơ
axit
a) Bazơ + ……….. → muối + nước
NaOH + HCl → NaCl + H2O
b) Bazơ + ……….
→ muối + nước
oxit axit
2NaOH + SO2 → Na2SO3 + H2O
c) Bazơ + ……….
→ muối + bazơ
FeCl2 + 2NaOH → Fe(OH)2 + 2NaCl
d) Bazơ
→
muối
oxit bazơ + nước
Cu(OH)2 → CuO + H2O
t0
t0
3. Axit
a) Axit + ………..
→ muối
kim
loại+ hiđro
H2SO4 + Zn → ZnSO4 + H2
b) Axit + ………. → muối + nước
bazơ
2NaOH + H2SO4 → Na2SO4 + 2H2O
c) Axit + ……….
→ muối + nước
H2SO4 + CaO → CaSO4 + H2O
Oxit bazơ
d) Axit + ………. → muối + axit
Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
muối
4. Muối
a) Muối +
→axit
muối + axit
……..
H2SO4 + BaCl2 → BaSO4 + 2HCl
b) Muối + ………. → muối + bazơ
bazơ
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2
c) Muối +
…….
→ muối + muối
AgNO3 + NaCl → AgCl + NaNO3ư\
d) Muối + ……….
muối
→ muối + kim loại
Fe + CuSO4 → FeSO4 + Cu
e) Muối
→
………..
+
kim loại
…
2KClO3 → 2KCl + 3O2
muối
khí
BẢN ĐỒ TƯ DUY
HÓA HỌC
II-Bài tập :
Bài 3: Em hãy chọn phơng án đúng để nhận biết các dung
dịch sau: H2SO4,
HCl, Na2SO4, NaOH.
A. Quỳ tím và dd Ba(OH)2
Ba(OH)2.
C. Chỉ cần dùng dd
B. Dung dịch phenolphtalein và dd Ba(OH)2
Đáp BaCl
án: A..
dùng dd
2
D. Chỉ cần
H2SO4, HCl, Na2SO4, NaOH
+ Quỳ tím
Màu
đỏ
Màu xanh
H2SO4, HCl
+ dd Ba(OH)2
Có kết tủa
H2SO4
Không kết
tủa
HCl
NaOH
Không
màu
Na2SO4
Bài tập 4: Để 1 mẩu NaOH ngoài không
khí, sau vài ngày thấy có chất rắn màu
trắng phủ ngoài. Nếu nhỏ vài giọt dd HCl
vào chất rắn thấy có khí thoát ra, khí này
làm đục nước vôi trong. Chất rắn màu trắng là
sản phẩm phản ứng của NaOH với:
a) O2 trong không khí
b) Hơi H2O trong không khí
c) CO2 và O2 trong không khí
d) CO2 và hơi H2O trong không khí
e) CO2 trong không khí
Giải thích và viết PTHH
NaOH
CO2
+CO2
Narắn
Chất
trắng
2COmàu
3
dd HCl
CO2
Bµi 5 : Trung hoµ 300 ml dung dÞch
Ca(OH)2
1M b»ng 200ml dung dÞch HCl 0,2M.
a) TÝnh khèi lîng muèi t¹o thµnh.
b) TÝnh nång ®é mol cña dung dÞch
t¹o thµnh sau
ph¶n øng (coi thÓ tÝch dung dÞch
kh«ng thay ®æi).
=> Các bớc tiến hành để giải bài toán theo
PTHH khi có thể tính đợc số mol của hai
chất tham gia phản ứng:
B1: Đổi tất cả các dữ kiện đề bài ra số
mol.Viết PTHH.
B2:
So sánh tỉ lệ số mol
=> Chất nào d, chất nào hết.
B3: Tính tất cả các yêu cầu đề bài
theo số mol chất hết.
Đề bài 3 (sgk) : Trộn một dung dịch có hoà
tan 0,2 mol CuCl2 với một dung dịch có hoà
tan 20g NaOH. Lọc hỗn hợp các chất sau
phản ứng thu đợc kết tủa và nớc lọc. Nung
kết tủa đến khi khối lợng không đổi.
a. Viết các phơng trình hoá học.
b. Tính khối lợng chất rắn thu đợc sau khi
nung.
c. Tính khối lợng các chất tan có trong nớc lọc.
Híng dÉn :
- §æi mNaOH ra nNaOH
- ViÕt PTHH : CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl
(1)
Cu(OH)2 → CuO + H2O
( 2)
t0
- So s¸nh tØ lÖ sè mol suy ra chÊt hÕt, chÊt
d. TÝnh to¸n yªu cÇu theo chÊt hÕt.
-Theo PTHH suy ra: ChÊt r¾n sau khi nung
chất nào?
ChÊt r¾n sau khi nung
là CuO
- Níc läc gåm nh÷ng chÊt g× ?
- Níc läc gåm: NaCl, chÊt cßn d trong ph
¬ng tr×nh sè (1)