PHÚC TRÌNH THỰC HÀNH PHƯƠNG PHÁP PHÂN TÍCH VI SINH VẬT
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (258.92 KB, 22 trang )
BỘ GIÁO DỤC VÀ ĐÀO
TẠO TRƯỜNG ĐẠI
HỌC CẦN THƠ
VIỆN NGHIÊN CỨU VÀ PHÁT TRIỂN CÔNG NGHỆ
SINH HỌC
PHÚC TRÌNH
THỰC HÀNH
PHƯƠNG PHÁP PHÂN TÍCH VI SINH VẬT
(MSHP: CS119)
Bài 1
XÁC ĐỊNH VI SINH VẬT
BẰNG PHƯƠNG PHÁP ĐẾM TRỰC TIẾP
1. Giới thiệu
Phương pháp xác định mật số vi sinh vật sử dụng buồng đếm hồng
cầu có ưu điểm là xác định được mật số vi sinh vật một cách nhanh
chóng với quy trình thực hiện đơn giản. Nhược điểm của phương pháp
này là đễ nhầm lẫn, độ chính xác không cao, không thích hợp cho dung
dịch có mật số vi sinh vật thấp và không phân biệt được tế bào sống và
chết. Trong một số trường hợp cần phải xác định mật số tế bào vi sinh
vật sống một cách nhanh chóng ở mức độ tương đối, tế bào vi sinh vật
sẽ được nhuộm với chất chỉ thị màu để phân biệt tế bào sống và chết
trước khi đếm dưới buồng đếm hồng cầu. Phương pháp này cho phép
xác định được tỷ lệ tế bào vi sinh vật sống rất nhanh chóng (từ vài phút
đến vài giờ) so với phương pháp đếm mật số khuẩn lạc trên môi trường
dinh dưỡng (thường khoảng 3-4 ngày).
Phương pháp nhuộm methylene blue để xác định mật số tế
bào vi sinh vật sống dựa trên khả năng làm mất màu xanh của
methylene blue nhờ hoạt động của hệ enzyme trong tế bào vi sinh vật
sống. Khi nhuộm với methylene blue, chất chỉ thị màu này sẽ xâm
nhập vào tất cả tế bào vi sinh vật, chất chỉ thị màu sẽ bị khử màu bởi
hoạt động của enzyme 2 của tế bào sống và tế bào chết sẽ bị nhuộm
màu xanh khi quan sát dưới kính hiển vi (Painting và Kirsop, 1989).
Phương pháp đánh dấu chỉ thị huỳnh quang để xác định khả
năng sống của vi sinh vật đã được sử dụng bởi nhiều tác giả (Thanh và
Nout, 2002; Breeuwer và Abee, 2000; Davey and Kell, 1996). Phương
pháp này dựa trên cơ sở sử dụng chất chỉ thị huỳnh quang cFDA thể
hiện cho hoạt động của enzyem nội bào (esterase) nằm ở màng tế bào
chất (ở tế bào nguyên vẹn), enzyme này chỉ có được khi tế bào còn
sống. Khi được hấp thu vào, cFDA (bản thân chất này không màu) sẽ bị
phân cắt cho ra cF (có màu xanh) tích luỹ tại màng tế bào chất và
chính cF làm bào tử phát quang màu xanh. Tuy nhiên, cFDA cũng có
khả năng đi vào những tế bào có màng tế bào chất bị tổn thương
nhưng ở các tế bào này không có sự hiện diện của enzyme nội bào nên
không phát quang xanh. Còn chất chỉ thị huỳnh quang PI có thể đi vào
những tế bào có màng tế bào chất bị tổn thương và đi vào nhân tế bào,
ở đây chúng gắn kết xen kẻ vào chuỗi ADN của tế bào làm cho các tế
bào này phát quang đỏ. Ngoài ra, những tế bào ở trạng thái miên trạng
không phát màu huỳnh quang là do chúng có màng tế bào chất
nguyên vẹn nhưng thiếu đi sự hoạt động của enzyme nội bào (Thanh
và Nout, 2004). Ưu điểm của phương pháp huỳnh quang là xác định tế
bào sống nhanh (30-40 phút) tiết kiệm được nhiều thời gian so với
phương pháp đếm sống cổ điển (2-4 ngày), nhưng đảm bảo tính chính
xác khi so sánh giữa hai phương pháp (Thanh và Nout, 2002).
2. Mục đích
Xác định tổng số vi sinh vật ( bào tử nấm mốc và tế bào nấm men) bằng phương
pháp đếm trực tiếp bằng buồng đếm hồng cầu. Dựa vào phương pháp nhộm metylene
blue xác định số tế bào sống và chết trong tổng số tế bào đếm được.
3. Vật liệu và phương tiện
3.1. Mẫu vật: Nấm men và nấm mốc
3.2. Hoá chất
- Nước cất
- Dung dịch Methylene blue (C16H18ClN3S): Hòa tan 0,01 g methylene blue vào
10 mL nước cất. Thêm vào 2 g sodium citrate dihydrate và khuấy đều đến khi hoà tan
hoàn toàn. Dịch hòa tan sau đó được lọc qua giấy lọc và thêm nước cất đến 100 mL.
Dung dịch được trữ trong chai màu nâu để tránh sáng.
3.3. Thiết bị và Dụng cụ
- Kính hiển vi điện tử
- Bếp đun cách thuỷ (water-bath) Julabo TW20
- Máy ly tâm Eppendorf HERMLE Z233M-2
- Pipet, micro-pipet Biohit-6047831
- Buồng đếm hồng cầu Bürk – Türk
- Ống nghiệm, ống/tuýp Eppendorf
Và các thiết bị, dụng cụ thường dùng trong phòng thí nghiệm.
4. Phương pháp
Chuẩn bị dịch trích vi sinh vật: Bào tử nấm mốc hay tế bào nấm men tổng số
được xác định bằng phương pháp đếm trực tiếp trên buồng đếm hồng cầu Bürk-Türk.
Chuẩn bị huyền phù bào tử nấm mốc hoặc tế bào nấm: cân 1 g mẫu bột vào ống nghiệm
vô trùng, cho vào 9 mL nước cất vô trùng, sau đó dùng máy vortex làm đều dịch huyền
phù.
Cách thực hiện được tóm tắt theo quy trình sau:
1g mẫu + 9ml nước cất nồng độ 101
Pha loãng mẫu (1ml mẫu + 9ml nước cất) thêm 2 nồng độ 102, 103
Lấy 0.5 ml mẫu ở nồng độ 103 + 0.5 ml dung dịch methylene blue
Đếm mật số bào tử / tế bào trên buồng đếm Bürk-Türk dưới KHV điện tử
Trong đó: tế bào/ bào tử bị nhuộm màu là tế bào/bào tử chết và tế
bào không bị nhuộm màu là tế bào sống/bào tử.
Sau khi đếm tổng số vi sinh vật trên buồng đếm (tính cả sống và
chết), tính bào tử tổng số/ gam cơ chất theo công thức:
N= [a/0,016] 103 10n (tế bào/ g)
Trong đó:
a: tổng số tế bào trong 4 ô lớn
0,016: thể tích của 4 ô lớn ()
n: độ pha loãng
103: số chuyển mm3 thành mL (1000 mm3 = 1mL)
5. Kết quả và thảo luận
- Nấm men: ở nồng độ pha loãng 2 x 10 3 tổng số tế bào trong 4 ô lớn đếm
được là 94, trong đó có 91 tế bào sống (không bắt màu) và 3 tế bào chết (bắt màu)
Kết quả: N = [94/0,016] 103 2 103= 1,175 1010 (tế bào/ g)
- Nấm mốc: ở nồng độ pha loãng 2 x 10 3 tổng số tế bào trong 4 ô lớn đếm
được là 36, trong đó có 35 tế bào sống (không bắt màu) và 1 tế bào chết (bắt màu)
Kết quả: N= [36/0,016] 103 2 103= 4,5 109 (tế bào/ g)
6. Kết luận:
- Tế bào sống không bắt màu methylene blue và tế bào chết thì bắt màu xanh của
methylene blue.
- Biết được cách đếm vi sinh vật tổng số bằng phương pháp đếm trực tiếp.
Tài liệu tham khảo
Breeuwer, P., and Abee, T., 2000. Assessment of viability of microorganisms employing
fluorescence techniques. International Journal of Food Microbiology 55, pp.193-200.
Thanh, N. V., and Nout, M. J. R., 2002. Rhizopus oligosporus biomass, sporangiospore yield
and viability as influenced by harvesting age and processing conditions. Food Microbiology
19, pp.91-96.
Thanh, N. V., and Nout, M. J. R., 2004. Dormancy, activation and viability of Rhizopus
oligosporus sporangiospores. International Journal of Food Microbiology 92, pp.171-179.
Painting, K and Kirsop, B., 1989. A quick method for estimating the percentage of viable cells in
a yeast population, using methylene blue staining. World for Culture Collections, Technical
information Federation sheet No 2. UNESCO/WFCC - Education Committee.
BÀI 2
XÁC ĐỊNH TỔNG SỐ NẤM MEN VÀ NẤM MỐC BẰNG
PHƯƠNG PHÁP CẤY TRẢI
1. Giới thiệu
Nấm mốc là vi nấm dạng sợi, sinh sản bằng bào tử hoặc khuẩn ty. Nấm men là
những tế bào đơn tính phát triển theo kiểu nảy chồi, thỉnh thoảng có thể tồn tại ở dạng
khuẩn ty giả trong đó các tế bào kết nhau thành chuỗi. Đơn vị hình thành khuẩn lạc của
nấm mốc và nấm men là mầm để tạo nên một khuẩn lạc khi nuôi cấy trong môi trường.
Mầm có thể là một bào tử, một tế bào hay một đoạn của khuẩn ty (Lê Thùy Linh, 2010).
Tổng số nấm men và nấm mốc có thể được xác định bằng phương pháp đổ đĩa trong môi
trường thạch hoặc xác định bằng phương pháp cấy gạt trên bề mặt thạch. Trong thí
nghiệm nhóm sử dụng phưng pháp cấy gạc:
Phương pháp cấy gạt (kỹ thuật hộp trải)
- Dùng pipet đã vô khuẩn lấy 0,1 ml dịch huyền phù cho vào mỗi đĩa thạch (tương đương
với 2 giọt dịch). Số tế bào cấy trên bề mặt thạch phải được dàn đều và không nên vượt
quá vài trăm (có thể dùng thể tích mẫu cấy từ 0,05 - 0,5ml; tuy nhiên, thể tích mẫu cấy
càng nhỏ thì sai số có thể xảy ra càng lớn).
- Khi tất cả các thể tích 0,1 ml tế bào ở các độ pha loãng khác nhau đều đã được chuyển
lên bề mặt thạch của đĩa pêtri, sử dụng que cấy gạt bằng thuỷ tinh hoặc kim loại để dàn
đều các tế bào trên bề mặt thạch. Lưu ý rằng que cấy gạt thuỷ tinh phải được vô khuẩn
trước khi được đưa vào đĩa petri tiếp theo.
Phương pháp này có một số ưu nhược điểm sau:
- Ưu điểm:
+ Nhận dạng được các dạng khuẩn lạc đặc trưng
+ Dễ dàng làm thuần dòng vi sinh vật
+ Xác định được các vi sinh vật nhạy nhiệt
- Nhược điểm:
+ Chỉ cấy được thể tích mẫu nhỏ
+ Chỉ cho phép đếm được số lượng khuẩn lạc thấp
2. Mục đích
Trong thực phẩm, xác định lượng nấm mốc và nấm men hiện diện
để đánh giá chất lượng, tình trạng vệ sinh và các điều kiện bảo quản
sản phẩm và dự đoán khả năng hư hỏng của sản phẩm vì nấm men và
mốc tăng trưởng làm thay đổi màu của thực phẩm, làm phát sinh mùi
hay vị lạ, làm hư hỏng hay thay đổi cơ cấu của thực phẩm (Lê Thanh
Mai et al., 2004). Ngoài ra, nhiều nấm mốc có thể sản xuất ra các sản
phẩm phụ, các sản phẩm phụ này có thể là chất độc đối với con người.
Một số nấm mốc có thể sản xuất độc tố (mycotoxin).
3. Vật liệu, phương tiện
3.1. Mẫu vật: chả lụa.
3.2. Hóa chất môi trường
Môi trường OGYA
Yeast extract .............................................................. 5g
Glucose .................................................................. 20g
Oxytetracyline ....................................................... 0,1g
Agar ....................................................................... 15g
Nước cất .......................................................... 1000ml
Pha chế: Đun sôi để hòa tan thành phần trên trong nước cất, để
nguội khoảng 45oC trong nồi cách thủy, điều chỉnh để pH là 6,6 ± 0,1 ở
25ºC, chứa từng lượng 250ml vào bình có dung tích phù hợp, hấp
thanh trùng 121ºC trong 15 phút. Trong trường hợp không có
oxytetracyline có thể thay bằng cloramphenicol (C 11H12C12N2O5) và được
chuẩn bị như sau: Từ các lọ đã chứa 100ml môi trường không có
oxytetracyline, làm chảy môi trường và duy trì ở 45ºC trong nồi chưng
cách thủy. Chuẩn bị dung dịch 0,1% oxytetracyline bằng cách hòa tan
0,1g oxytetracyline trong 100ml nước cất, lọc thanh trùng. Cho 25ml
dung dịch 0,1% oxytetracyline vào 250ml môi trường đã nóng chảy, lắc
để trộn đều.
3.3. Dụng cụ, thiết bị:
- Đĩa pêtri.
- Pipet, micro-pipet Biohit-6047831
- Các thiết bị, dụng cụ thường dùng trong phòng thí nghiệm.
4. Phương pháp
Trong môi trường OGYA có oxytetracyline là chất kháng sinh ức chế vi khuẩn
khác.
Cách thực hiện được tóm tắt theo quy trình sau:
Mẫu cắt nhỏ (đồng thời đổ môi trường OGYA vào 8 đĩa petri,
để nguội)
Lấy 5 g mẫu cho vào 45 ml dung dịch đã chuẩn bị trước Nồng
độ 101
Pha loãng mẫu (5 ml dịch ở nồng độ 101 + 45 ml nước peptone
đã chuẩn bị trước) thành 3 nồng độ: 102, 103, 104
Dùng pipet lấy 0,1 ml mẫu ở mỗi nồng độ cho vào 2 đĩa môi
trường OGYA
( dùng que trải trải đều mẫu lên bề mặt đĩa môi trường )
Ủ 300C trong 24-72 giờ
Đếm khuẩn lạc (chỉ ở đĩa có khuẩn lạc <300)
Tính kết quả (đơn vị CFU/g)
Kết quả và cách tính số khuẩn lạc trên đĩa petri dựa trên công thức:
N= xd
Trong đó:
N: Số khuẩn lạc trong 1g mẫu (CFU/g)
C: Số khuẩn lạc đếm được trên các đĩa petri
d: Nồng độ pha loãng mẫu, đĩa petri đầu tiên được chọn để
đếm có số khuẩn lạc thỏa điều kiện <300
n1: Số đĩa chọn đếm khuẩn lạc ở nồng độ đầu tiên
n2: Số đĩa chọn đếm khuẩn lạc ở nồng độ kế tiếp
5. Kết quả và thảo luận
Bảng kết quả của 3 nhóm:
Nấm men
10
102
103
104
10
0
0
2
I
Chả lụa
4
0
1
1
5
1
0
0
II
Cá
OGYA
5
4
1
0
16
2
0
0
III
Thịt heo
17
1
0
0
1
Nhóm chọn tính kết quả ở nồng độ 10 . Do trong bài chỉ dùng 0,1
Nhó
m
Mẫu
Môi
trường
1
ml mẫu ở các nồng độ chuyển vào môi trường đã chuẩn bị sẵn nên
phải x10 để đổi thành 1 ml.
- Nhóm 1: mẫu chả lụa
N = x 10 x 10 = 7 x 102 (CFU/g)
- Nhóm 2: mẫu cá
N = x 10 x 10 = 5 x 102 (CFU/g)
- Nhóm 3: mẫu thịt heo
N = x 10 x 10 = 16,5 x 102 (CFU/g)
So sánh với quy định an toàn vệ sinh thực phẩm thì các mẫu này
nằm trong giới hạn cho phép theo tiêu chuẩn an toàn vệ sinh thực
phẩm.
6. Kết luận
- Xác định đựơc tổng số nấm men và nấm mốc bằng phương pháp cấy
trải.
- Biết cách thực hiện thao tác cấy trải.
- Biết được ý nghĩa của các kết quả đối với quy định an toàn vệ sinh
thực phẩm.
Tài liệu tham khảo
Lê Thanh Mai. 2008. Phân tích vi sinh thực phẩm. Trường Đại học Bách khoa Hà
Nội.
Lê Thanh Mai, Nguyễn Thị Hiền, Phạm Thu Thủy, Nguyễn Thanh Hằng và Lê Thị Lan
Chi. 2004. Các phương pháp phân tích ngành công nghệ lên men, Trường Đại học
Bách khoa Hà Nội.
Lê Thùy Linh. 2010. Thực hành phân tích vi sinh thực phẩm. Trường Đại học Công
nghiệp thực phẩm TP. HCM.
TCVN 5750:1993. 1993. Phương pháp xác định nấm men và nấm mốc. Hà Nội.
Trần Linh Thước. 1998. Phương pháp phân tích vi sinh vật trong nước, thực phẩm, mỹ
phẩm. NXB Giáo dục.
BÀI 3
PHƯƠNG PHÁP ĐẾM TỔNG SỐ VI SINH VẬT HIẾU
KHÍ
1. Giới thiệu
Vi khuẩn hiếu khí là những vi khuẩn tăng trưởng và hình thành khuẩn lạc trong điều
kiện có sự hiện diện của oxi phân tử, là vi sinh vật phát triển được ở nhiệt độ 30-37oC
trong điều kiện hiếu khí trên môi trường dinh dưỡng không chọn lọc. Tổng số vi khuẩn
hiếu khí hiện diện trong mẫu chỉ thị mức độ vệ sinh của thực phẩm.
Chỉ số này được xác định bằng phương pháp đếm khuẩn lạc mọc trên môi trường
thạch dinh dưỡng từ một lượng mẫu xác định trên cơ sở xem khuẩn lạc là một sinh khối
phát triển từ một tế bào hiện diện trong mẫu và được biểu diễn dưới dạng số đơn vị hình
thành khuẩn lạc (colony forming unit, CFU) trong một đơn vị khối lượng thực phẩm. Chỉ
số này có một số tên gọi khác nhau như sau: số vi sinh vật hiếu khí (Aerobic Plate Count,
APC), tổng số đếm trên đĩa (Total Plate Count, TPC), tổng số vi sinh vật sống ( Total
Viable Count, TVC), số đếm đĩa chuẩn (Standard Plate Count, SPC)
2. Mục đích
Xác định được tổng số Vi sinh vật trong môi trường hiếu khí bằng phương pháp đếm.
3. Vật liệu, phương tiện
3.1. Mẫu vật: Chả lụa
3.2. Môi trường nuôi cấy
Môi trường PCA (Plate Count Agar)
Tryptone
0,5%
Yeast extract
0,25%
Glucose
0,1%
Agar
1,5-2,0%
Nước
Vừa đủ
100%
Hòa tan 26,5 g bột khan môi trường PCA trong 1 lít nước, đun và
khuấy nhẹ cho đến khi tan hoàn toàn, chỉnh pH = 7,0±0,2. Phân vào
chai 100 mL môi trường. Khử trùng nhiệt ướt ở 121 oC trong 20 phút.
3.3. Dụng cụ
- Đĩa pêtri. Pipet và các thiết bị thường dùng trong phòng thí nghiệm
khác
4. Phương pháp thực hiện
Cách thực hiện được tóm tắt theo quy trình sau:
Mẫu cắt nhỏ
Lấy 5 g mẫu cho vào 45 ml dung dịch đã chuẩn bị trước Nồng
độ 101
Pha loãng mẫu (5 ml dịch ở nồng độ 101 + 45 ml dung dịch đã
chuẩn bị trước)
1
Độ pha loãng từ 10 đến 107 nhưng chỉ dùng 4 nồng độ: 104, 105,
106, 107
Dùng pipet lấy 1 ml mẫu ở mỗi nồng độ cho vào 2 đĩa (tổng 8
đĩa)
Lấy môi trường PCA đã để nguội bớt (khoảng 45oC) rót vào mỗi
đĩa (15 -20 ml PCA) rồi lắc trộn đều theo hình số 8
Để nguội
Ủ 370C trong 24-72 giờ
Đếm khuẩn lạc (chỉ ở đĩa có khuẩn lạc <300)
Tính kết quả (đơn vị CFU/g)
Kết quả và cách tính số khuẩn lạc trên đĩa petri dựa trên công thức:
N= xd
Trong đó:
:
Số khuẩn lạc đếm được trên các đĩa petri.
d: Nồng độ pha loãng mẫu, mà ở đó đĩa petri đầu tiên được
chọn để đếm có số khuẩn lạc thỏa điều kiện 30 < x < 300.
n1: Số đĩa chọn đếm các khuẩn lạc ở nồng độ đầu tiên
(n1= 1 hoặc n1= 2).
n2: Số đĩa chọn đếm các khuẩn lạc ở nồng độ kế tiếp (n 2
= 1 hoặc n2 = 2).
5. Kết quả và thảo luận
Nhóm
Mẫu
I
Chả lụa
II
Cá
III
Thịt heo
Môi
trường
PCA
Nồng độ pha loãng
104
105
106
>300
4
47
X
1
56
3
1
1
2
1
0
15
0
0
39
0
1
Kết quả cách tính số khuẩn lạc trong dĩa Petri của các mẫu:
- Mẫu chả lụa: N = [(47 + 56)/2] x 106 = 5,77
- Mẫu thịt cá: N= [(3+2)/2] x 104 = 2,5
- Mẫu thịt heo: N= [(15+39)/2] x 104 = 2,7
107 CFU/g
104 CFU/g
105 CFU/g
107
7
17
1
0
1
3
So sánh với quy định an toàn vệ sinh thực phẩm thì các mẫu này
nằm trong giới hạn cho phép theo tiêu chuẩn an toàn vệ sinh thực
phẩm.
Mẫu ở nhóm I ở nồng độ 105 có sự bất thường khi số khuẩn lạc
thấp hơn so với các nồng độ pha loãng sau. Kết quả bất thường này có
thể là do trong quá trình thao tác có sai sót như: trộn mẫu không đều
khiến các vi sinh vật hiếu khí nằm ở dưới đáy, trong lúc lấy dung dịch
mẫu chưa lắc đều chỉ lấy ở bề mặt
TÀI LIỆU THAM KHẢO:
Dénombrement des micro-organismes par comptage des
colonies obtenus à 30oC. Méthode de routine. Microbiologie
alimentaire 8e édition, Tome 2-AFNOR 2002, page 11 NF V08-051.
BÀI 4
PHƯƠNG PHÁP ĐẾM COLIFORMS TỔNG SỐ,
COLIFORMS CHỊU NHIỆT VÀ E. COLI
(Phương pháp MPN)
Phương pháp MPN NF ISO 4831, NF V08-016
I.
1.
Giới Thiệu
Định nghĩa
Coliforms tổng số là những sinh vật hình que, Gram âm, hiếu khí,
kị khí tuỳ nghi, có khả năng phát triển trong môi trường có muối mật,
lên men đường lactose và sinh gas ở nhiệt độ 35-37 0C trong vòng 2448 giờ, oxydase âm tính.
Coliforms chịu nhiệt là những Coliforms có khả năng sinh trưởng và
phát triển ở 44,5oC
E.coli là Coliforms chịu nhiệt nhưng có khả năng sinh Indol từ
Tryptophane.
2.
Nguyên tắc
-
Cấy một lượng mẫu thử vào 3 ống môi trường chọn lọc, nồng độ
đậm đặc.
-
Cấy lượng mẫu thử vào 3 ống môi trường lỏng chọn lọc, nồng độ
pha loãng.
-
Thực hiện tương tự với lượng mẫu thử pha loãng 10-1, 10-2,…
-
Ủ ở 35-370C/24-48 giờ.
-
Từ những ống nghiệm dương tính (sinh gas) và dựa vào bảng MPN
tính Coliforms tổng số và E. coli có trong 1 g hay 1 mL mẫu.
Ưu điểm: Cho kết quả mật số vi sinh vật nhanh có độ chính xác cao, nhanh chóng đơn
giản.
Nhược điểm:
- Phương pháp phải trải qua nhiều giai đoạn.
- Dễ xảy ra sai số trong quá trình thao tác.
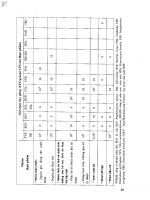
Bảng MPN dùng cho 3 ống nghiệm
II.
Mục đích
Xác định mật số Coliforms, Coliforms chịu nhiệt và E.coli trong
mẫu
III.
Vật liệu và Phương pháp
1. Mẫu vật: Chả lụa
2. Hoá chất – môi trường
Dung dịch pha loãng
-
NaCl
-
KCl
-
CaCl2
-
Hydrogénocarbonate natri
0,2 g
-
Nước cất
1.000 mL
Canh thang Tryptose et Lauryl sulfate natri
9,0 g
0,42 g
0,48 g
-
Tryptone
20,0 g
-
Lactose
5,0 g
-
K2HPO4
2,75 g
-
KH2PO4
2,75 g
-
NaCl
-
Natri lauryl sulfat CH3(CH2)11OSO3Na
-
Nước cất
5,0 g
0,1 g
1.000 mL
Hòa tan 40 g bột khan (môi trường nồng độ đơn) và 80 g bột khan (môi trường nồng độ
kép) trong 1 lít nước, đun và khuấy nhẹ cho đến khi tan hoàn toàn. Chỉnh pH = 6,7 0,1.
Phân 10 mL môi trường nồng độ đơn vào các ống nghiệm 16 x 160 mm và 10 mL môi
trường nồng độ kép vào các ống nghiệm 12 x 120 mm (trong các ống nghiệm có ống
Durham). Khử trùng nhiệt ướt ở 121oC/20 phút.
Môi trường xanh lục sáng (Brilliant Green Bile Broth – BGBL)
- Peptone bactériologique
10 g
- Bile de boeuf (muối mật)
10 g
- Lactose
10 g
- Vert brillant
0,0133 g
- nước cất
1.000 mL
Hòa tan 40 g bột khan (môi trường nồng độ đơn) và 80 g bột khan (môi trường nồng độ
kép) trong 1 lít nước, đun và khuấy nhẹ cho đến khi tan hoàn toàn. Chỉnh pH = 7,2 0,1.
Phân 10 mL môi trường nồng độ đơn vào các ống nghiệm 16 x 160 mm và 10 mL môi
trường nồng độ kép vào các ống nghiệm 12 x 120 mm (trong các ống nghiệm có ống
Durham). Khử trùng nhiệt ướt ở 121oC/20 phút.
Môi trường Peptone d’indol
- Tryptone
10 g
- NaCl
5,0 g
- Nước cất
1.000 mL
Hòa tan 15 g bột khan trong 1 lít nước, đun và khuấy nhẹ cho đến khi tan hoàn toàn. Chỉnh
pH = 7,3. Phân 5-10 mL môi trường vào các ống nghiệm 16 x 160 mm. Khử trùng nhiệt ướt
ở 121oC/20 phút.
Thuốc thử Kovac’s
- P.méthyl amino bezandéhyde
- Alcool amylique
5g
75 mL
- HCl
25 mL
Hòa tan P. méthyl amino bezandéhyde trong Alcool amylique, đun cách thủy nhẹ ở
50- 55oC cho đến khi tan hoàn toàn. Thêm HCl vào, vừa cho vào vừa làm lạnh với nước
đá. Bảo quản ở 4oC trong chai màu nâu.
3. Dụng cụ - thiết bị
Tủ ủ 370C, 44,50C
Ống hút khắc vạch 1 mL, 2 mL, 5 mL, 10 mL. Và các dụng cụ thông
dụng trong phòng thí nghiệm.
IV.
Phương Pháp
Xác định Coliforms tổng số:
Cân 5g mẫu + 45ml dung dịch pha loãng
Đồng nhất mẫu (101)
Pha loãng mẫu
Hút 1ml mỗi mẫu pha
Ống nghiệm có chuông Durham
Durham
Môi trường
TLS
102
103
104
101A /101B /101C
102A /102B / 102C
103A /103B / 103C
104A /104B /104C
Ủ 370C trong 24-48h
Có bọt
khí
Quan sát xem những ống dương
tính
Ống nghiệm có chuông Durham
Durham
Môi trường
Hút 1ml
BGBL
Ủ 370C trong 24-48h
Quan sát những ống có bọt khí và vẫn đục
Tra bảng MPN và tính kết quả
Xác định Coliforms chịu nhiệt và E. Coli :
Cân 5g mẫu + 45ml dung dịch
Đồng nhất mẫu (101
102
103
104
)
Pha loãng mẫu
101A /101B /101C
102A /102B / 102C
103A /103B / 103C
104A /104B /104C
Hút 1ml mỗi mẫu pha
Môi trường TLS trong ống nghiệm có chuông
Durham
Ủ 44.50C trong 2448h
Quan sát và ghi nhận những ống dương
Có bọt
khí
Vẫn đục
Hút 1ml
tính
Môi trường BGBL trong ống
Môi trường
nghiệm có chuông Durham
Peptone d’indol
Ủ 44.50C trong 24-
Ủ 44.50C trong 24-48h
48h
Quan sát những ống có bọt khí và vẫn
Quan sát những ống có bọt khí và vẫn
đục
đục
Tra bảng MPN và tính kết
Thuốc thử Kovac’s
quả
Kết luận coliforms chịu
nhiệt
Ghi nhận những ống chuyển sang mào đỏ
gạch
Tra bảng và tính kết quả
V.
Kết quả - Thảo luận
1. Coliforms tổng số:
Nhóm
Mẫu
Nhiệt độ
I1
Chả lụa
I2
Cá
I3
Thịt
370C
Môi
Nồng độ pha loãng
trường
101
102
103
104
TLS
3
3
2
0
BGBL
3
3
2
0
TLS
3
3
1
0
BGBL
3
3
0
0
TLS
3
3
3
0
BGBL
3
3
3
0
Kết quả xét nghiệm Coliforms tổng số
Kết quả của mẫu chả lụa
-
Ta lấy kết quả ở nồng độ 101→103 là: 332
-
Tra vào bảng MPN là 110
Vì nồng độ đầu là 101 nên ta sẽ có kết quả là 1,1 x 103 MPN/g
* Kết quả: Coliforms tổng số là 1.1 x103 MPN/g
Kết quả của mẫu cá
-
Ta lấy kết quả ở nồng độ 101→103 là: 330
-
Tra vào bảng MPN là 24
-
Vì nồng độ đầu là 101 nên ta sẽ có kết quả là 2,4 x 102MPN/g
* Kết quả: Coliforms tổng số là 2.4 x 102MPN/g
Kết quả của mẫu thịt
-
Ta lấy kết quả ở nồng độ 101→103 là: 333
-
Tra vào bảng MPN là >110
Vì nồng độ đầu là 101 nên ta sẽ có kết quả là >1.1 x 103 MPN/g
* Kết quả: Coliforms tổng số là >1.1 x 103 MPN/g
►Nhận xét: Dựa vào kết quả khi tra bảng MPN ta thấy coliforms tổng số của mẫu thịt
heo là cao nhất sao đó là chả lụa và thấp nhất là cá nhưng nhìn chung 3 loại mẫu nầy đều
có coliforms nên sẽ không an toàn cho sức khỏe
2. Coliforms chịu nhiệt và e.coli:
Nhóm
Mẫu
Nhiệt độ
Môi
Nồng độ pha loãng
101
102
103
104
I1
Chả lụa
I2
Cá
I3
44.540C
Thịt
trường
TLS
2
1
1
0
BGBL
2
1
1
0
Pepton
1
1
1
0
TLS
2
1
0
0
BGBL
2
1
0
0
Pepton
2
1
0
0
TLS
3
3
3
1
BGBL
3
3
3
1
Pepton
3
3
3
1
Kết quả xét nghiệm Coliforms chịu nhiệt và E.coli
* Coliforms
Kết quả của mẫu chả lụa
-
Ta lấy kết quả ở nồng độ 101→103 là: 211
-
Tra vào bảng MPN là 2
-
Vì nồng độ đầu là 101 nên ta sẽ có kết quả là 2 x 101 MPN/g
*Kết quả: Coliforms chiệu nhiệt là 2 x 101 MPN/g
Kết quả của mẫu cá
-
Ta lấy kết quả ở nồng độ 101→103 là: 210
-
Tra vào bảng MPN là 1,5
-
Vì nồng độ đầu là 101 nên ta sẽ có kết quả là 1,5 x 101 MPN/g
*Kết quả: Coliforms chiệu nhiệt là 1,5 x101 MPN/g
Kết quả của mẫu thịt
-
Ta lấy kết quả ở nồng độ 101→103 là: 333
-
Tra vào bảng MPN là >110
Vì nồng độ đầu là 101 nên ta sẽ có kết quả là >1.1 x 103 MPN/g
*Kết quả: Coliforms chiệu nhiệt là >1.5 x 103 MPN/g
* E.coli
Kết quả của mẫu chả lụa
-
Ta lấy kết quả ở nồng độ 101→103 là: 111
-
Tra vào bảng MPN là 1,1
-
Vì nồng độ đầu là 101 nên ta sẽ có kết quả là 1.1 x 101 MPN/g
*Kết quả: Tổng số E.coli là 1,1 x 101MPN/g
Kết quả của mẫu cá
-
Ta lấy kết quả ở nồng độ 101→103 là: 210
-
Tra vào bảng MPN là 1.5
-
Vì nồng độ đầu là 101 nên ta sẽ có kết quả là 1,5 x 101 MPN/g
-
*Kết quả: Tổng số E.coli là 1,5 x 101 MPN/g
Kết quả của mẫu thịt
-
Ta lấy kết quả ở nồng độ 101→103 là: 333
-
Tra vào bảng MPN là >110
-
Vì nồng độ đầu là 101 nên ta sẽ có kết quả là > 1,1 x 103 MPN/g
*Kết quả: Tổng số E.coli là >1.1 x 103 MPN/g
►Nhận xét: những ống nghiệm có bọt khí trong chuông Duham ở giá ống nghiệm ủ
44,5oC ( dương tính ) thì khoảng 99% đều dương tính với thuốc thử Kovac’s( có e.coli)
Các yếu tố ảnh hưởng đến kết quả:
- Trong quá trình nghiền mẫu chưa nát làm các vi sinh vật tách ra khỏi mẫu không
nhiều.
- Do mẫu phải được pha loãng nhiều lần vì vậy trong quá trình pha loãng chưa thực
hiện thao tác trộn đều mẫu ở nồng độ đậm đặc, vi sinh vật vẫn còn tụ lại chưa tách
đều ra, nên khi ta pha loãng từ mẫu đậm đặc sang mẫu loãng có sự phân bố không
đều giữa các mẫu được pha loãng.Từ đó dẫn đến không có không có vi sinh vật phát
triển.
- Hiện tượng sủi bột khí và đục môi trường: Nguyên nhân dẫn đến không có hiện
tượng sủi bọt khí: Chưa trộn đều mẫu ở nồng độ đậm đặc kĩ trước khi pha loãng
mẫu.
- Các ống nghiệm khi được pha loãng xong chưa được lắc đều và kĩ.
Từ những nguyên nhân trên chúng ta cần lưu ý, trong quá trình thực hiện các thí
nghiệm đặc biệt các thí nghiệm liên quan đến vi sinh vật cần có sự chính xác, cẩn thận và
tĩ mĩ trong từng thao tác thực hiện.
VI.
Kết luận
Kinh nghiệm khi thực hiện thao tác thí nghiệm:
-
Trước khi pha loãng mẫu ở nồng độ đậm đặc sang mẫu ở nồng độ loãng phải trộn
đều mẫu để vi sinh vật phân bố đều, nên khi pha loãng mẫu thì mật số vi sinh vật
-
được phân bố đồng đều ở các mẫu pha loãng.
Trong thí ngiệm yêu cầu trước khi đưa vào tủ ủ cần lắc đều các ống nghiệm cho
đến khi nào không còn bọt khí ở ống Durham, vì nếu không làm như vậy thì sẽ
nhằm lẫn với hiện tượng sủi bọt khí ở ống Durham và dẫn đến kết luận sai đối với
các ống nghiệm không có vi sinh vật phát triển.
Tài liệu tham khảo
Directives générales pour le dénombrement des Coliformes. Technique
du nombre le plus probable”. Microbiologie alimentaire 8e édition,
Tome 1 – AFNOR 2002, page 239 NF ISO 4831, NF V08-016.
Directives générales pour le dénombrement des Escherichia coli.
Technique du nombre le plus probable”. Microbiologie alimentaire
8e édition, Tome 1 – AFNOR 2002, page 265 NF ISO 7251, NF V08020.