BÁO CÁO THỰC HÀNH CÔNG NGHỆ VI SINH
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (222.81 KB, 26 trang )
ĐẠI HỌC Y DỢC THÀNH PHỐ HỒ CHÍ MINH
KHOA DƯỢC
BỘ MÔN VI SINH – KÝ SINH
________________________________
BÁO CÁO THỰC HÀNH
CÔNG NGHỆ
VI SINH
Nhóm thực tập: IV
Buổi thực tập: Chiều thứ tƣ
Bàn số 2
Tiểu nhóm: 4
Lớp: DCQ2010
STT Họ và tên sinh viên Tổ
GHI CHÚ
(Nhóm IV – Chiều thứ 4 – Bàn số 2 – Tiểu nhóm 4
1
Lê )Thanh Chi
12
2
Đặng Hữu Thanh Hà
12
3
Nguyễn Thành Long
12
4
Trần Khánh Ngọc
12
5
6
Hoàng Võ Nghĩa Nhân 12
Đào Tiến Trung
12
Báo cáo thực hành : CÔNG NGHỆ VI SINH
DANH SÁCH SINH VIÊN THỰC TẬP
MỤC LỤC
1. CHỌN LỌC GIỐNG VI SINH VẬT - SINH KHỐI VI SINH VẬT ..................................................
..........................
1
2. ĐÁNH GIÁ MỘT SỐ ĐẶC ĐIỂM CÓ LỢI CỦA VI KHUẨN PROBIOTIC...................................
............................
4
3. TINH CHẾ ENZYME AMYLASE BẰNG ALGINAT .........................................................................
...........................
6
4. CỐ ĐỊNH CGTase LÊN ALGINAT .....................................................................................................
.......................
8
5. CẢM ỨNG BIỂU HIỆN PROTEIN TÁI TỔ HỢP - ĐIỆN DI TRÊN GEL POLYACRYLAMIDE
(PAGE)...............
12
6. TINH CHẾ PROTEIN BẰNG SẮC KÝ ÁI LỰC & SẮC KÝ TRAO ĐỔI ION................................
..........................
14
Nhóm thực tập IV – Chiều thứ 4 − Bàn số 2 – Tiểu nhóm 4
Trang ii
Báo cáo thực hành : CÔNG
NGHỆ VI SINH
TUẦN 01
CHỌN LỌC GIỐNG VI SINH VẬT
SINH KHỐI VI SINH VẬT
(Ngày 04/12/2013)
---oOo---
1. TÓM TẮT LÝ THUYẾT
1.1.Chọn lọc giống vi sinh vật.
− Quá trình chọn lọc giống vi sinh vật bao gồm:
Phân lập từ tự nhiên
Gây đột biến
Phát hiện dòng vi sinh vật có đặc tính mong muốn
Bảo quản giống
− Một số phương pháp phát hiện giống vi sinh vật có đặc tính mong muốn có thể
dựa vào các yếu tố sau:
Chất chuyển hóa tạo ra: kháng sinh, sắc tố,…
Enzym ngoại bào tác động lên các cơ chất trong môi trường
Sự thay đổi đặc tính sinh trưởng của các vi sinh vật
Sự thay đổi hình thái.
− Một số phương pháp bảo quản giống (thường mang tính kinh nghiệm).
Giữ giống trên thạch
Giữ giống dưới lớp dầu khoáng
Giữ giống trong cát
Đông lạnh
Đông khô
1.2.Sinh khối vi sinh vật.
− Sinh khối là toàn bộ số vi sinh vật thu được sau khi lên men. Trong công nghệ
vi sinh, người ta sản
xuất sinh khối để thu sản phẩm nội bào hoặc probiotic.
0
− Trong thực nghiệm tiến hành thu sinh khối vi sinh vật bằng nuôi cấy ở 30 C và
0
37 C trên môi trường
TSB có bổ sung khoáng và không bổ sung khoáng, trong điều kiện có lắc và
không lắc để xác
định điều kiện nuôi cấy tối ưu theo 2 phương pháp: đo độ đục trên máy đo qua
ng và đếm sống.
Phương pháp đo độ đục: Chọn bước sóng thích hợp. Ví dụ: Đo OD600 với
Bacillus indicus.
Phương pháp đếm sống: Pha loãng dịch nuôi cấy thành nhiều cấp độ và chọn
nồng độ thích hợp có
thể đếm sống được (từ 15 đến 300 khóm trên một hộp thạch).
Bảng 1.1. So sánh 2 phương pháp đếm số lượng tế bào.
Đo độ đục
Đếm sống
− Thao tác nhanh, gọn.
− Đếm chính xác số khóm
Ƣu điểm
→ Số lượng
vi khuẩn sống tương ứn
g.
Nhƣợc điểm
−
Gây sai số thừa do:
Xác vi khuẩn chết.
Tạp chất trong dịch
nuôi cấy.
−
−
Dễ bị ngoại nhiễm.
Khi cấy phải pha loãng huyền tr
ọc vi
khuẩn ra nhiều cấp độ.
2. KẾT QUẢ THỰC HÀNH.
2.1.Chọn lọc giống vi sinh vật.
2.1.1. Phân lập chủng có khả năng tiết amylase ngoại bào.
Nhóm thực tập IV – Chiều thứ 4 − Bàn số 2 – Tiểu nhóm 4
Trang 1
Báo cáo thực hành : CÔNG
NGHỆ VI SINH
Màu
− Loại
Phƣơng
pháp: Cấy dịch nuôi cấy lên địa thạch tinh bột và ủ qua đêm tại 3
Số lƣợng
0
7 C. Dùng dung dịch
Lugol để nhận biết các khuẩn lạc có khả năng thủy phân tinh bột do tiết ra amyl
ase ngoại bào.
Bên ngoài trong
2
9
− Kết quả: Có 20 khuẩn lạc chia thành 3 loại. Kết quả chi tiết được trình bày trong
bảng 1.2
Màu trắng
8 mm
Bảng 1.2. KếtBên
quảngoài
phânđục
lập các chủng có khả năng tiết amylase ngoại bào
.
Đƣờng kính vò
ng
Trƣớc khi nhỏ Lugol Sau khi nhỏ Lugol phân giải tinh
bột
1
3
−
5
6
Đục
Bên trong đục
Bên trong trắng
Màu nâu đen
-
Màu trắng
5 mm
Có kết tủa đục
Bìa răng cưa
Kêt luận: Chủng tạo khuẩn lạc 2 và 3 có khả năng tiết ra amylase ngoại bào.
Nên sử dụng chủng số 3
để có hiệu suất thu hoạch amylase cao nhất.
2.1.2. Phân lập chủng có khả năng tiết protease ngoại bào.
0
− Phƣơng pháp: Cấy dịch nuôi cấy lên địa thạch gelatin và ủ qua đêm tại 37 C.
Dùng dung dịch TCA
50% để nhận biết các khuẩn lạc có khả năng phân giải protein do tiết ra prolase
ngoại bào.
− Kết quả: Có 15 khuẩn lạc chia thành 4 loại. Kết quả chi tiết được trình bày trong
bảng 1.3
Bảng 1.3. Kết quả phân l ập các chủng có khả năng tiết protease ngoại bà
o.
Loại Số lƣợng
nhỏ TCA
−
Màu
Đƣờng kính vòng
Sau khi phân giải protein
Trƣớc khi nhỏ TCA
Viền trắng, trong đục
1
3
2
3
Đục, bìa răng cưa
3
5
Đục, bìa dợn sóng Không có kết tủa đục
4
4
Đốm trắng nhỏ
Có kết tủa đục
Không có kết tủa đục
5 mm
9 mm
Kêt luận: Chủng tạo khuẩn lạc 3 và 4 có khả năng tiết ra protease ngoại bào.
Nên sử dụng chủng số 4
để có hiệu suất thu hoạch protease cao nhất.
2.1.3. Phân lập chủng có khả năng kháng kháng sinh.
− Chủng thử nghiệm: Staphylococcus aureus.
− Phương pháp vạch thẳng vuông góc :
Tiến hành : Cấy chủng thử nghiệm trên hộp thạch đã cấy sẵn chủng khảo
sát (Đã ủ qua đêm ở
0
37 C), đường cấy chủng thử nghiệm vuông góc với đường cấy chủng khảo sá
0
t. Ủ qua đêm ở 37 C.
Kết quả : Khảo sát hai chùng. Chỉ có chủng (1) có khả năng tiết ra kháng
sinh với khoảng cách ức
chế là 12 mm → Nên sử dụng chủng (1) để nghiên cứu sản xuất kháng sinh.
− Phương pháp khuếch tán.
Tiến hành : Trải chủng khảo sát lên hộp thạch. Đục lỗ đường kinh 6mm bằn
g dụng cụ tiệt trùng.
Nạp vào các lỗ dịch nuôi
Sốcấy
tế bào/mL
các chủng kiểm tra đã lọc qua giấy lọc 0,45µm
Nhiệt độ Môi trƣờng TSB
để loại bỏ tế bào. Tiến
hành songOD
song
với mẫu trắng.
= 2,142
OD = 2,366
Lắc
Lắc
Kết quả :
Bảng 1.4. Kết quả phân l ập các chủng có khả năng tiết kháng si
OD = 1,163
OD = 1,938
nh
Tĩnh
Tĩnh
Lắc
Chủng
OD = 2,224
Đường kính vòng ức chế (mm)
Lắc
1
2 3
4
OD = 2,867
19 5 0 10
Chứng
0
OD = 0,408
OD = 1,140
Nhóm
thực tập IV – Chiều thứ 4 − Bàn số Tĩnh
2 – Tiểu nhóm 4
Tĩnh
Trang 2
Báo cáo thực hành : CÔNG
NGHỆ VI SINH
Kết luận : Có 3 chúng tiết ra kháng sinh với mức độ tăng dần là (2) < (4) <
(1) → Nên sử dụng
chủng (1) để nghiên cứu sản xuất kháng sinh. Có sự ngoại nhiễm xảy ra
ở ô chứa chủng (2),
nguyên nhân cói thể do dịch nuôi cấy chưa được lọc sạch tế bào sinh dưỡng.
2.2.Sinh khối vi sinh vật
2.2.1. Kết quả
− Chủng khảo sát: Bacillus indicus (vi khuẩn hiếu khí)
− Công thức :
9
Đo độ đục: Số tế bào/mL = OD600 × 0,8 × 10
số thứ tự hộp + 1
Đếm sống: Số tế bào/mL = Số khóm × 10
.
− Kết quả xử lý số liệu.
Bảng 1.3. Ảnh hưở ng c ủa điều kiện nuôi cấy đến sinh khối vi sinh vật
Môi trƣờng TSB Số tế bào/mL
9
(.10 ) (Bổ sung khoán
(.10 )
g)
9
0
30 C
0
37 C
1, Không đạt
7136 1,8928
-
162 khóm (5X)
0,16
64 khóm (5X)
0,0
2
63 khóm (5X)
1,7792 2,2936
0,063
34 khóm (6X)
88 khóm (5X)
0,34
64
0,088
0,3264 0,912
0,
9304 1,5504
Không đạt
-
15 khóm (6X)
0,1
5
2.2.2. Nhận xét – Kết luận.
− Theo phƣơng pháp đo OD600
0
Nhiều nhất: 37 C, lắc, môi trường TSB có bổ sung khoáng.
0
Ít nhất: 37 C, tĩnh, môi trường TSB.
− Theo phƣơng pháp đếm sống:
0
Nhiều nhất: 37 C, lắc, môi trường TSB.
0
Ít nhất: 30 C, lắc, môi trường TSB.
− Nhận xét: Có sự không tương đồng giữa các kết quả, nguyên nhân có thể do
Thao tác đo quang chưa chính xác
Thao tác cấy gây nhiễm tạp, sai số do đếm.
− Kết luận: Dựa trên phương pháp đếm sống, B.indicus tăng trưởng mạnh trong
môi trường có nhiều
oxy (lắc), nhiệt độ và việc bổ sung khoáng vào môi trường nuôi cấy ảnh hưởng k
hông rõ.
Nhóm thực tập IV – Chiều thứ 4 − Bàn số 2 – Tiểu nhóm 4
Trang 3
Báo cáo thực hành : CÔNG
NGHỆ VI SINH
TUẦN 02
ĐÁNH GIÁ MỘT SỐ ĐẶC ĐIỂM CÓ LỢI
CỦA VI KHUẨN PROBIOTIC
(Ngày 11/12/2013)
---oOo---
1. TÓM TẮT LÝ THUYẾT
− Probiotic là một hoặc các vi sinh vật sống khi được đưa vào cơ thể với số lƣợ
ng đủ dưới dạng sản
phẩm lên men hay tế bào khô sẽ tạo ảnh hưởng có lợi đến cân bằng vi sinh v
ật đường tiêu hóa và
do đó có ảnh hưởng tích cực đến sức khỏe.
− Các vi sinh vật dùng làm probiotic phải đạt tiêu chuẩn GRAS. Ngoài ra, do s
ử dụng chủ yếu bằng
đường uống nên các chủng này phải đáp ứng được một số đặc điểm sinh họ
c như khả năng chịu
đựng acid dịch vị và dịch mật.
− Bài thực tâp sẽ khảo sát tỉ lệ sống sót của vi sinh vật probiotic khi tiếp xúc với
các môi trường dịch vị
nhân tạo và dịch mật nhân tạo sau từng khoảng thời gian quy định bằng phƣơn
g pháp đếm sống.
2. KẾT QUẢ THỰC HÀNH
2.1.Vật liệu thực nghiệm.
− Chủng vi sịnh vật khảo sát
Tế bào sinh dưỡng vi khuẩn Bacillus subtilis PY79 nuôi qua đêm trên TSB đ
ã điều chỉnh với dung
9
dịch NaCl 0,85% đạt khoảng 0,4.10 tế bào/mL (OD600 = 0,5).
Bào tử Bacillus subtilis PY79 nuôi 48h trên thạch DSM đã điều chỉnh với
dung dịch NaCl 0,85% đạt
9
khoảng 0,4.10 tế bào/mL (OD600 = 0,5)
− Môi trường dịch vị nhân tạo: Dùng HCl đặc điều chỉnh pH 1,5 ; 2 và 3.
− Môi trường dịch mật nhân tạo (pH 6,8): Điều chỉnh đạt nồng độ muối mật là 0,15
; 0,3 và 0,5%.
2.2.Kết quả thí nghiệm
2.2.1. Đánh giá khả năng chịu đựng dịch vị nhân tạo
− Tế bào sinh dưỡng
Bảng 2.1. Khảo sát khả năng chịu đựng dịch vị nhân tạo của dạng sinh
dưỡng
Số tế bào/mL (.10 )
Đối chứng
ắc
50rpm (ph
út)
pH 1,5
0
−
8
Thời gian l
0,134
pH 2
0,46
pH 3
-
60
-
-
6.5.10
90
-
84
-
0,048
−4
0,49
4,9
Bào tử (độ pha loãng)
Bảng 2.2. Khảo sát khả năng chịu đựng dịch vị nhân tạo của dạng bào
tử
8
Số tế bào/mL (.10 )
Thời gian l
Đối chứng
ắc
50rpm (ph
út)
pH 1
pH 2
pH 3
0
12,10
0,85
-
8,10
60
-
-
1,85
9,50
90
1,62
0,75
2,00
16,80
Nhóm thực tập IV – Chiều thứ 4 − Bàn số 2 – Tiểu nhóm 4
Trang 4
Báo cáo thực hành : CÔNG
NGHỆ VI SINH
− Nhận xét: v
− Kết luận: v
2.2.2. Đánh giá khả năng chịu đựng muối mật.
− Tế bào sinh dưỡng (độ pha loãng)
Bảng 2.3. Khảo sát kh ả năng chịu đự ng d ịch mật nhân t ạo của d ạng s
inh dưỡ ng
Số tế bào/mL (.108)
Thời gian lắc
50rpm (phút) Đối chứng Muối mật 0,15% Muối mật 0,30% Muối mật
0,50%
−
0
0,286
0,0153
0,12
4,1.10
60
-
-
2,3.10
120
0,928
-
0,008
−3
3,5.10
−3
−3
-
Bào tử (độ pha loãng)
Bảng 2.4. Khảo sát khả năng chịu đựng dịch mật nhân tạo của dạng b
ào tử
Số tế bào/mL (.108)
Thời gian lắc
50rpm (phút) Đối chứng Muối mật 0,15% Muối mật 0,30% Muối mật
0,50%
−
−
Nhận xét: v
Kết luận: v
0
4,30
7,30
0,096
1,03
60
2,30
0,104
-
-
120
2,00
0,084
-
-
Nhóm thực tập IV – Chiều thứ 4 − Bàn số 2 – Tiểu nhóm 4
Trang 5
Báo cáo thực hành : CÔNG
NGHỆ VI SINH
Tuần 03
TINH CHẾ ENZYME AMYLASE BẰNG ALGI
NAT
(Ngày 18/12/2013)
---oOo---
1. TÓM TẮT LÝ THUYẾT
− Emzyme amylase có ái lực mạnh trên liên kết glycoside nên có nhiều ứng dụng.
Amylase thô có thể thu
nhận từ nhiều nguồn và được tinh chế để có thể ứng dụng trong y dược.
− Bài thực tập sử dụng amylase thu được từ khoai lang, hấp phụ trên natri algi
nate 2% (đệm AcONa
0,2M ; pH 4,8), kết tủa lại bằng dung dịch CaCl2 0,7M và giải hấp bằng glucose
∆OD
2%. Enzyme tinh chế
được xác định hàm lượng và hoạt tính. So sánh với thí nghiệm tương tự tiến hàn
h trên enzyme thô.
2. KẾT QUẢ THỰC HÀNH
2.1.Xây dựng đƣờng chuẩn để xác định hoạt tính amylase
Bảng 3.1. Mối quan hệ giữa hàm lượng tinh bột (mg) và mật độ quang
(OD)
Ống
0
1
2
3
4
5
Tinh bột (mg)
0,0
0,20
0,40
0,60
0,80
1,00
0,154
0,287
0,404
0,444
0,668
∆OD = ODi – OD0 0,000
0.8
0.7
0.3
0.6
0.2
0.5
0.1
0.4
0
R² = 0.9749
y = 0.6181x + 0.0171
0
0.2
1.2
0.4
0.6
0.8
1
Hàm lƣợng tinh bột (mg)
Hình 3.1. Mối quan hệ giữa hàm lượng tinh bột (mg) và mật độ quang
(OD)
2.2.Các thông số quy trình tinh chế
2.2.1. Tổng số protein (A280nm)
− Enzyme thô (pha loãng 50 lần)
OD280-TH = 0,258
Tổng thể tích thô: 14mL
Tổng lượng protein thô: A280-TH = OD280 × Vthô × Độ pha loãng = 0,258 × 14 ×
50 = 180,6
− Enzyme tinh chế (pha loãng 10 lần)
Nhóm thực tập IV – Chiều thứ 4 − Bàn số 2 – Tiểu nhóm 4
Trang 6
=
≈ 12,85 .
Báo cáo thực hành : CÔNG
NGHỆ VI SINH
OD280-TC = 0,078
Tổng thể tích tinh chế: 35mL
Tổng lượng protein tinh chế: A280-TC = OD280 × Vtinh × Độ pha loãng = 0,078 ×
35 × 10 = 27,3
2.2.2. Tổng hoạt tính (U)
− Dựa vào phương trình hồi quy: y = 0,6181x + 0,0171 với y là ∆OD và x là
lƣợng tinh bột (mg)
bị thủy phân.
− Enzyme thô.
ODchứng : 0,312 và ODthử = 0,09 → ∆OD = 0,222.
Lượng tinh bột bị thủy phân : 0,3315 mg.
Hoạt tính tổng của amylase thô (UTH):
UTH = Lƣợng tinh bột bị thủy phân × 10 × Độ pha loãng × Vthô = 0,3315 × 10 × 50
× 14 = 2320,5
− Enzyme tinh chế.
ODchứng : 0,322 và ODthử = 0,262 → ∆OD = 0,06.
Lượng tinh bột bị thủy phân : 0,0694 mg.
Hoạt tính tổng của amylase tinh chế (UTC):
UTC = Lƣợng tinh bột bị thủy phân × 10 × Độ pha loãng × Vtinh = 0,0694 × 10 × 1
0 × 35 = 242,9
2.2.3. Hoạt tính chuyên biệt (U/A280nm)
UTH 2320,5
− Hoạt tính chuyên biệt của
A280−TH 180,6
enzyme thô:
−
Hoạt tính chuyên biệt của
enzyme tinh chế:
UTC 242, 27,3
=
A280−T 9
C
≈ 8,90 .
2.2.4. Hiệu suất tinh ch
ế (%) :
UTC 242,9
UTH 2320,5
HTCB-TC 8,90
HTCB-TH 12,85
Bảng 3.2. Các thông số quá trình tinh c
hế
tinh chế
Thô
180,6
12,85
2320,5
Tinh chế
27,3
242,9
10,47%
Mức
tinh chế
0,693
8,90
2.3.Nhận xét.
Bảng 3.3. Đánh giá các thông số quá trình tinh chế
Thông số
Kết quả Tiêu chuẩn Đánh giá
Hiệu suất tinh chế
10,47% Thấp
Ho ạt tính chuyên bi ệt thô 12,85
Ho ạt tính chuyên bi ệt tinh
8,90 Tốt
Mức tinh chế
0,693
Thấp
=
2.2.5. Mức tinh chế :
=
≈ 10, 47% .
≈ 0,693 .
Hiệu suất
Thông số
A280
U
U/A280
Nhóm thực tập IV – Chiều thứ 4 − Bàn số 2 – Tiểu nhóm 4
Trang 7
Báo cáo thực hành : CÔNG
NGHỆ VI SINH
∆OD
Tuần 04
CỐ ĐỊNH CGTase LÊN Tốt
ALGINAT
≥ 4: Tốt
(Ngày 25/12/2013)
---oOo---
1. TÓM TẮT LÝ THUYẾT
− Cyclodextrin glucanotransferase (CGTase) là enzyme duy nhất có khả năng
chuyển hóa tinh bột và các
chất tương tự (bài thực tập dùng maltodextrin) thành cyclodextrin.
− Việc cố định CGTase lên alginate sẽ tận dụng được khả năng tái sử dụng của
enzyme, giảm chi phí
trong nghiên cứu và sản xuất, tăng cường tính ổn định và hoạt tính của enzyme
. Bài thực tập sử dụng
gel Ca-alginate để cố định enzyme theo 2 phương pháp:
Bắt giữ: Cho dung dịch CaCl2 0,2M vào dung dịch chứa enzyme và alginate.
Hấp phụ: Cho dung dịch enzyme tiếp xúc với các hạt gel Ca-alginate trong
đệm Tris-HCl pH8.
− Các hạt gel sau khi cố định enzyme được rửa sạch bằng đệm Tris-Hcl pH8 rồi
đem xác định hoạt độ
của enzyme cố định. Dịch lọc và dịch rửa các hạt gel được xác định lượng pro
tein tự do để xác định
hàm lượng và hiệu suất của quá trình cố định enzyme lên alginate.
Xác định hàm lƣợng protein: Dựa vào độ chuyển dời λmax của thuốc nh
uộm Coomasie Brilliant
Blue từ 464 (màu mâu đỏ, dạng tự do) sang 595 (màu xanh, dạng kết hợp vớ
i protein).
Xác định hoạt độ của enzyme: Dựa vào khả năng hấp phụ các phân tử chất
vào lõi kỵ nước của
cyclodextrin. Bài thực tập sử dụng phenolphthalein (pH 10,5 có màu hồng đậ
m),
khi bị cyclodextrin
∆OD
hấp phụ sẽ bị giảm nồng độ và làm giảm cường độ màu.
2. KẾT QUẢ THỰC HÀNH
2.1. Xây dựng đƣờng chuẩn để xác định hàm lƣợng protein.
Bảng 4.1. Mối quan hệ giữa hàm lượng protein (mg) và mật độ quang (O
D)
Ống
Trắng
1
2
3
4
Nồng độ BSA (µg/mL)
0,0
10
20
30
40
∆OD595 = ODi – OD0
0,000
0,139
0,283
0,407
`0,489
0.6
y = 0.0125x + 0.0144
R² = 0.9904
0.5
0.4
0.3
0.2
0.1
0
0
5
45
10
15
20
25
30
35
40
Nồng độ BSA (µg/mL)
Hình 4.1. Mối quan hệ giữa hàm lượng protein (mg) và mật độ quang (OD) (phƣơn
g pháp Bradford)
Nhóm thực tập IV – Chiều thứ 4 − Bàn số 2 – Tiểu nhóm 4
Trang 8
Báo cáo thực hành : CÔNG
NGHỆ VI SINH
2.2.Xây dựng đƣờng chuẩn xác định hàm lƣợng β-cyclodextrin (β-CD).
Bảng 4.2. Mối quan hệ nồng độ β-CD và mật độ quang (OD)
Ống
Trắng
1
2
3
4
5
Hàm lượng β-CD (mg)
0,0
0,2
0,4
0,6
0,8
1,0
OD550
0,407
0,260
0,206
0,135
0,102
0,077
∆OD550 = OD0 – ODi
0
0,147
0,201
0,272
0,315
0,330
0.4
y = 0.3179x + 0.0519
R² = 0.9136
0.35
0.3
0.25
0.2
0.15
0.1
0.05
0
0
0.2
1.2
0.4
0.6
0.8
1
Hàm lƣợng β-CD (mg)
Hình 4.2. Mối quan hệ giữa hàm lượng β-CD (mg) và mật độ quang
(OD)
2.3.Kết quả xác định hàm lƣợng và hiệu suất protein cố định.
2.3.1. Xác định hàm lượng protein trong chế phẩm CGTase
− Độ pha loãng: n = 200 lần.
− OD595: 0,149. Thế vào phương trình hồi quy y = 0.0125x + 0.0144 → x =
10,768 µg/mL
−3
− Áp dụng công thức: Hàm lƣợng protein/mL enzyme = n × x × 10 → Hàm lư
ợng protein trong
−3
chế phẩm CGTase trong 1mL chế phẩm: 200 × 10,768 × 10 = 2,1536 mg.
2.3.2. Xác định hàm lượng protein cố định
Bảng 4.3. Kết quả xác định hàm lượ ng và hiệu suất cố định enzyme
Phƣơng pháp
BẮT GIỮ
HẤP PHỤ
Thể tích dịch lọc + dịch rửa (mL)
50mL
OD595
0,117
0,198
0,082
0,1469
protein
8,208
14,688
(Độ phaNồng
loãngđộ
: 10
lần) (µg/mL)
Hàm lượng protein không cố định (mg)
Hàm lượng protein cố định (mg)
Hiệu suất cố định
2,0716
96,19%
2.4.Kết quả xác định hoạt tính protein cố định.
2.4.1. Xác định hoạt tính enzyme trong chế phẩm CGTase
− Độ pha loãng: n = 50 lần.
2,0067
93,18%
Nhóm thực tập IV – Chiều thứ 4 − Bàn số 2 – Tiểu nhóm 4
Trang 9
Báo cáo thực hành : CÔNG
NGHỆ VI SINH
−
ODthử = 0,367 ; ODchứng = 0,447 → ∆OD = 0,08. Thế vào phương trình hồi q
uy y = 0,3179x +
0,0519, ta có x = 0,0884 mg β-CD = 88,4 µg β-CD.
− Hoạt tính chung của CGTase tự do (HTCTD):
≈ 8,1667 U.
0,3179
×1135
×15
Tính theo công thức : HTCTD (x ×10 × n
a × M× t
U / mL) =
(Trong đó: x(µg) là khối lượng β-CD tạo thành ; n là độ pha loãng ; a là hệ
số góc của phương
trình hồi quy, M = 1135 là khối lượng riêng của CD ; 10 = 1mL/0,1mL là tỉ l
ệ enzyme tham gia
≈ 3,7921 U/mg.
2,1536
phản ứng và t (phút) là thời gian phản ứng.)
88, 4 ×10 × 50
Kết quả :
HTCTD =
− Hoạt tính riêng của CGTase tự do
(HTRTD):
HTCTD
HL proteinTD
Tính theo công thức : HTR TD (U /
mg protein) =
(Trong đó: HL proteinTD là hàm lượng protein tự do trong chế phẩm CGTase (2
,1536 mg))
8,1667
Kết quả : HTRTD =
2.4.2. Xác định hoạt tính enzyme cố định.
− Hoạt tính chung của CGTase cố định (HTCCD) được tính theo công thức
HT x × 8,04
0,3 × M × t
CC
D
(
U)
=
(Trong đó: x(µg) là khối lượng β-CD tạo thành ; 8,04 g là tổng khối lượng các
hạt gel thu được ; 0,3
g là khối lượng của mẫu 10 hạt gel ; M = 1135 là khối lượng riêng của CD và
t (phút) là thời gian
phản ứng.)
− Hoạt tính riêng của CGTase cố định (HTRCD) được tính theo công thức
HTRCD (U / mg
protein) =
HTCCD
HL proteinCD
Chế phẩm cố định
(Trong
: HL protein
CD là tự
hàm
Tiêuđó
chí
Chế phẩm
dolượng protein cố định thu được)
− Tỷ lệ hoạt tính là tỷ lệ giữa HTRCD và HTRTD.
Bảng 4.4. Kết quả xác định hoạt tính enzyme cố định
Phƣơng pháp
BẮT GIỮ
HẤP PHỤ
OD550 chứng
0,364
0,318
OD550 thử
0,178
0,189
∆OD = ODchứng – ODthử
0,186
0,129
Lượng β-CD (µg) tạo thành
421,83
242,53
Hàm lượng protein cố định (mg)
2,0716
2,0067
Hoạt tính chung (U)
0,664
0,382
Hoạt tính riêng (U/mg protein)
0,3205
0,1904
Tỷ lệ hoạt tính (HTRTD = 3,7921)
8,452%
5,021%
2.5.Nhận xét
− Hiệu suất của cả hai phương pháp cố định đều rất cao (96,19% và 93,18%), ha
o hụt thấp. Phương
pháp hấp phụ cho hiệu suất thấp hơn phương pháp bắt giữ.
− So sánh hoạt tính của enzyme theo bảng 4.5, ta thấy kết quả hoạt tính của chế
phẩm cố định rất thấp
so với chế phẩm tự do.
Nhóm thực tập IV – Chiều thứ 4 − Bàn số 2 – Tiểu nhóm 4
Trang 10
Báo cáo thực hành : CÔNG
NGHỆ VI SINH
Bảng 4.5. So sánh kết quả xác định hoạt tính enzyme
Phương pháp bắt giữ
Phương pháp
hấp phụ
Hoạt tính chung
Hoạt tính riêng
Tỉ lệ hoạt tính
8,1667 U
3,7921 U/mg
100%
0,664 U
0,3205 U/mg
8,452%
0,382 U
0,1904 U/mg
5,021%
2.6.Qui trình cố định CGTase lên alginate
2.6.1. Phương pháp bắt giữ
15mL dung dịch alginate 2%
+ 1 mL enzym
Hỗn hợp enzym + alginate
- Nhỏ từ từ hỗn hợp vào 30mL CaCl2 0,2M
- Ủ 15 phút
- Lọc lấy hạt gel Ca-alginate-enzyme
- Rửa gel bằng đệm Tris-HCl pH8 (2 × 10mL)
Hạt gel
Dịch lọc + rửa
(Enzyme cố địn (Enzyme tự do)
h)
2.6.2. Phương pháp hấp phụ
30mL dung dịch CaCl2 0,2M
- Nhỏ vào từ từ từng giọt 15mL alginate
2%enzym
Hạt gel Ca-alginate
- Cho vào 20mL đệm Tris-HCl pH8
- 2mL anzyme CGTase và ủ 45 phút
- Lọc lấy hạt gel Ca-alginate-enzyme
- Rửa gel bằng đệm Tris-HCl pH8 (2 × 10mL)
Hạt gel
Dịch lọc + rửa
(Enzyme cố địn (Enzyme tự do)
h)
Nhóm thực tập IV – Chiều thứ 4 − Bàn số 2 – Tiểu nhóm 4
Trang 11
Báo cáo thực hành : CÔNG
NGHỆ VI SINH
Tuần 5
CẢM ỨNG BIỂU HIỆN PROTEIN TÁI TỔ H
ỢP
ĐIỆN DI TRÊN GEL POLYACRYLAMIDE (PA
GE)
Ngày 30/12/2013
---oOo---
1. TÓM TẮT LÝ THUYẾT
1.1.Cảm ứng biểu hiện protein tái tổ hợp.
− Dùng IPTG (Isopropyl β-D-1-thiogalactopyranoside) để cảm ứng tạo thành T7
RNA polymerase giúp
cảm ứng biểu hiện protein tái tổ hợp trong chủng E.coli BL21(DE3) mang đoạn
gen amyE (mã hóa cho
α-amylase) trên vector pET28b(+)
− Chủng sử dụng: Phân lập các vi khuẩn thuộc chủng B21(DE3) có chứa vector
pET28b(+) mang đoạn
gen amyE dựa trên tiêu chí đề kháng với kanamycin (do vector pET28b(+) m
ang gen Kan giúp vi
khuẩn mọc được trên môi trường chứa kanamycin 30µg/mL).
1.2.Điện di trên gel polyacrylamide.
− Phân tích các protein tái tổ hợp thu được sai khi cảm ứng biểu hiện bằng IPT
G để xem protein thu
được ở dạng tan hay không tan nhằm có biện pháp thu hồi và tinh chế thích hợp
.
− Nguyên nhân: Do protein được biểu hiện ở mức cao trong tế bào khác tế bào
nguyên thủy (khác quá
trình hâu dịch mã) sẽ làm cho protein gập lại không đúng và sẽ trở trên không
tan trong môi trường
nội bào và kết tập thành các thể vùi.
− Kỹ thuật phân tích : PAGE biến tính (SDS-PAGE) trong hệ đệm không liên tục
của Laemmli
− Đối tƣợng phân tích:
Môi trường nuôi cấy (có chứa IPTG) chủng E.coli BL21(DE3) có chứa gen
amyE.
Môi trường nuôi cấy (không chứa IPTG) chủng E.coli BL21(DE3) có chứa gen
amyE.
− Nội dung phân tích:
Phân tích tổng lượng protein thu được.
Phân tích tổng lượng protein tan và potein không tan.
Nhóm thực tập IV – Chiều thứ 4 − Bàn số 2 – Tiểu nhóm 4
Trang 12
2. QUY TRÌNH THỰC TẬP.
Báo cáo th
ực hành : CÔNG NGHỆ VI SINH
Chủng E.coli AmyE/380
0
- Phân lập trên thạch LBK30 (30 C, 24h)
- Lấy một khóm cấy vào 2mL LBK30
Dịch nuôi cấy E.coli
AmyE/380 (LBK30)
hông thêm IPTS -
- Pha loãng 1:100 với LBK30 trong 2 ống
ắc 200 rpm (2-3h) -
nghiệm (25mL/ống)
0
- Lắc 200 rpm (37 C) tới khi đạt OD600
= 0,6
- Thêm IPTS
- Lắc 200 rpm (2-3h)
- Ly tâ
Mẫu phân tích
m 12000 rpm – 3 phút
- Phân tán cắn trong 1/10 thể t
ích Tris-HCl pH8, 10mmol
- Thêm 40µl đệm
tải SDS 4X và vortex.
– 3 phút
0
- Đun nóng 95 C và nạp
10µL vào gel SDS-PAGE
Đệm phân tán tế bào
iêu âm 2 lần × 30s/lần
- Ly tâm 12000 rpm
- Phân tán cắn trong
- Ủ đá 10 phút, tán s
- Ly tâm 14000 rpm
– 5 phút
- Nƣớc + 1/3 thể tíc
h đệm tải SDS 4X.
0
Đun 95 C và nạp 1
0µL vào gel SDS-PAGE
- Phân tán cắn trong
100µL đệm tải SDS 1X.
0
Đun 95 C và nạp 1
0µL vào gel SDS-PAGE.
P
h
â
n
t
í
c
h
p
r
o
t
e
i
n tổn
g
Phân tích protein tan/không tan
Nhóm thực tập IV – Chiều thứ 4 − Bàn số 2 – Tiểu nhóm
4
Trang 13
Báo cáo thực hành : CÔNG
NGHỆ VI SINH
Buổi 6:
TINH CHẾ PROTEIN BẰNG SẮC KÝ ÁI L
ỰC
TINH CHẾ LYSOZYME BẰNG SẮC KÝ TRAO Đ
ỔI ION
Ngày 08/01/2014
---oOo---
1. TÓM TẮT LÝ THUYẾT
1.1.Nguyên tắc của sắc ký ái lực
2+
2+
− Sắc ký ái lực ion kim loại (IMAC) sử dụng các ion hóa trị II (Cu , Ni ,…) để gắn
kết đặc hiệu với các
peptid có nhiều (từ 6-8 phân tử) histidine (Protein-HisTag). Protein được giải
hấp phụ bằng dung
dịch chứa imidazole có nồng độ cao (~100mM). Protein thu được đem đi định
lượng bằng phương
pháp đo quang OD595 với thuốc thử Bradford (Sử dụng đường chuẩn đã được thi
ết lập trong tuần 4.)
O
N
H
OH
NH2
histidine
N
HN
N
imidazole
− Bài thực tập tinh chế protein thu được từ chủng E.coli AmyE/380 đã được t
ạo dòng (chứa vector
pET28b(+)) bằng IMAC sử dụng Ni-Sepharose.
− Vai trò của một số dung dịch đệm sử dụng.
Đệm chạy 1X (chứa imidazole 5mM): Rửa sạch và cân bằng cột bằng các
h đẩy sạch protein
tạp còn sót lại trên nhựa sắc ký ra ngoài.
Đệm rửa 1X (chứa imidazole 50mM): Rửa khỏi cột các protein tạp có đuô
i HisTag còn sót lại
trên nhựa sắc ký ra ngoài (do chúng gắn không đặc hiệu với nhựa).
Đệm thôi 1X (chứa imidazole 100mM): Đẩy protein đích trên nhựa sắc ký ra
ngoài.
Đệm xả 1X (chứa EDTA 100mM): Rửa sạch imidazole ra khỏi cột sau khi
dùng bằng cách tạo
2+
phức với ion Ni (có gắn với imidazole), phức hợp bị rửa khỏi cột nhằm thu h
ồi imidazole.
Đệm ion 1X (chứa NiSO4 100mM): Cân bằng cột trước khi dùng và sau khi r
ửa với đệm xả bằng
2+
cách bổ sung ion Ni còn thiếu trên nhựa do bị đệm xả rửa trôi.
1.2.Nguyên tắc của sắc ký trao đổi ion
− Dựa vào tính chất lưỡng tính của enzyme mà bản chất là phân tử protein. Sử
dụng vật liệu mang điện
tích trái dấu với điện tích của protein (trong môi trường thích hợp) sẽ giúp ph
ân lập các loại protein
mong muốn nhờ tạo liên kết tĩnh điện với các phân tử đó.
− Mỗi
∆ODloại protein có một giá trị pH đẳng điện (pHi) nhất định mà tại đó protein
trung hòa về điện. Tùy
vào pH môi trường mà protein có điện tích khác nhau.
pH < pHi : Tích điện dương. Nhựa trao đổi ion sử dụng là cationide.
pH > pHi : Tích điện âm. Nhựa trao đổi ion sử dụng là anionide.
− Bài thực tập phân lập lysozyme (pI = 10) trong môi trường pH 8 (đệm chạy
chứa 50mM Tris HCl) nên
sử dụng nhựa cationide SP-sepharose FF. Protein được giải hấp phụ khỏi nh
ựa bằng cách thêm
đệm thôi chứa các ion với nồng độ cao (chứa 2M NaCl, 50 mM Tris Hcl pH 8) cạ
nh tranh gắn kết với
lysozyme. Protein thu được đem đi định lượng bằng phương pháp đo quang
OD595 với thuốc thử
Bradford (Sử dụng đường chuẩn đã được thiết lập trong tuần 4.). Chỉ lấy những
kết quả có OD595 từ
0,139 trở lên (tương ứng ống số 1)
Nhóm thực tập IV – Chiều thứ 4 − Bàn số 2 – Tiểu nhóm 4
Trang 14
Báo cáo thực hành : CÔNG
NGHỆ VI SINH
2. KẾT QUẢ THỰC HÀNH (PHẦN Sắc ký trao đổi ion)
2.1. Xây dựng đƣờng chuẩn để xác định hàm lƣợng protein.
Bảng 6.1. Mối quan hệ giữa hàm lượng protein (mg) và mật độ quang (O
D)
Ống
Trắng
1
2
3
4
Nồng độ BSA (µg/mL)
0,0
10
20
30
40
∆OD595 = ODi – OD0
0,000
0,139
0,283
0,407
0,489
0.6
y = 0.0125x + 0.0144
0.5
0.4
R² = 0.9904
0.3
0.2
0.1
0
0
5
45
10
15
20
25
30
35
40
Nồng độ BSA (µg/mL)
Hình 6.1. Mối quan hệ giữa hàm lượng protein (mg) và mật độ quang (OD) (phƣơn
g pháp Bradford)
2.2. Kết quả thực tập.
Bảng 6.2. Kết quả quá trình tinh chế lysosyme
Mẫu
A
B
C
D1
D2
D3
Thể tích (mL)
1
1
3
1
1
OD595
0,359
0,378
0,410
0,091
0,024
29,088
31,648
6,128
0,768
20
20
10
10
61,28
7,68
1
0,054
Nồng độ protein (µg/mL) 27,568
3,168
Hệ số pha loãng
100
Hàm lượng protein (µg) 2756,8
581,76 1898,88
3,168
− Tổng khối lượng protein (ống A): 2756,8 µg.
− Tổng khối lượng protein thu được trong các ống D: 68,96 µg (Ống D3 bị loại do
nằm ngoài khoảng
tuyến tính của đường chuẩn Bradford)
D
68,96
A
2756,8
−
−
Nhận xét:
Hiệu suất tinh chế 2,5% là thấp.
Tổng khối lượng protein trong C là 1898,88 ≈ 68,88% tổng lượng protein
chứng tỏ dịch C chứa rất
nhiều protein tạp và mẫu tinh chế chứa rất ít protein đích.
Hiệu suất tinh chế: H =×100% =
×100% ≈ 2,5%.
Nhóm thực tập IV – Chiều thứ 4 − Bàn số 2 – Tiểu nhóm 4
Trang 15
3. SƠ ĐỒ QUÁ TRÌNH TINH CHẾ
3.1.Tinh chế bằng sắc ký ái lực
Cột rỗng
1
- Rửa sạch bằng nước cất vô trùng Báo cáo
- Phân tán đều nhựa sắc ký (úp ng SINH
ửa)
thực hành : CÔNG NGHỆ VI
Cột chứa nhựa sắc ký
- Thêm 2mL Ni-Sepharose, để
Dịch nuôi cấy E.coli
yên 1h
- Ly tâm 10.000 rpm, 5 phút
- Thu lấy cắn tế bào.
Cột chứa nhựa sắc ký
(gắn Ni-Sepharose)
Hoạt hóa cột :
- 0,5mL × 3 lần nước cất vô trùng
- 0,5mL × 5 lần đệm ion 1X.
- 0,5mL × 3 lần đệm chạy H 1X.
Cắn tế bào
- Phân tán trong đệm chạy H 1X
- Tán siêu âm (giữ lạnh)
- Ly tâm 10.000rpm, 5 phút
Dịch A (nƣớc nổi)
Cột đã hoạt hóa
Lấy 1,0mL nap vào cột
Dịch B
- 0,5mL × 5 đệm chạy H 1
X
- 0,5mL × 3 đệm rửa H 1X
OD595 ≥ 0,1
Dịch C
39
- Từng 1mL đệm thôi H 1X
OD595 ≥ 0,1
39
- 0,5mL × 5 đệm chạy H 1
X
Cột đã cân bằng
Dịch D
Nhóm thực tập IV – Chiều thứ 4 − Bàn số 2 – Tiểu nhóm 4
Trang 16
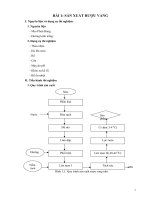
3.2.Tinh chế bằng sắc ký trao đổi ion.
Báo cáo thực hành : CÔNG NGHỆ VI
SINH
Cột rỗng
- Rửa sạch bằng nước cất vô tr
ùng
- Phân tán đều nhựa sắc ký (úp
ngửa)
Dịch lòng trắng trứng
Cột chứa nhựa sắc ký
- Ly tâm 10.000 rpm, 1 phút
- Thêm 2mL SP-Sepharose, để
yên 1h
Dịch A (nƣớc nổi)
Cột chứa nhựa sắc ký
(gắn SP-Sepharose)
Hoạt hóa cột :
- 0,5mL × 3 lần nước cất vô trù
ng
- 0,5mL × 5 lần đệm chạy L 1X.
Cột đã hoạt hóa
Lấy 1,0mL nap vào cột
Dịch B
- 0,5mL × 6 đệm chạy L 1
X
OD595 ≥ 0,
Dịch C
139
- Từng 1mL đệm thôi L 1X
OD595 ≥ 0,
139
- 0,5mL × 5 đệm chạy L 1
X
Cột đã cân bằng
0
(Bảo quản 4-8 C, EtOH
24%)
Dịch D