CHUYÊN đề 1 dẫn XUẤT của AXIT CACBOXYLIC
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (4.08 MB, 67 trang )
Chuyên đề
1.
DẪN XUẤT CỦA AXIT CACBOXYLIC
A. LÍ THUYẾT CƠ BẢN VÀ NÂNG CAO
I. CHẤT ĐIỆN LI, SỰ ĐIỆN LI
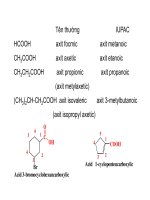
1. Định nghĩa
Dẫn xuất của axit cacboxylic là những sản phẩm tạo ra khi thay thế nhóm OH trong nhóm COOH bằng
các nguyên tử hay nhóm nguyên tử khác. R-C-OH
R – C – OH
R–C-Y
||
||
O
O
Axit caboxylic
Dẫn xuất của axit cacboxylic
2. Phân loại
- Tùy theo bản chất của Y mà ta phân biệt các loại dẫn xuất khác nhau:
Z
Công thức
Tên dẫn xuất
OR'
RCOOR'
este
Hal (CI, Br, I)
RCO-Hal
halogenua axit
NH2
RCO-NH2
amit
OCOR’
RCO-O-COR'
anhidrit axit
NHNH2
RCO-NH-NH2
hiđrazit
N3
RCO-N3
azit
II. ESTE
1. Cấu tạo phân tử
• Este đơn giản có công thức cấu tạo như sau:
R – C – OR’
R, R' là gốc hiđrocacbon no, không no hoặc thơm
||
(trừ trường hợp este của axit fomic có R là H)
O
• Este tạo bởi axit đa chức và ancol đa chức
Ví dụ
CH3COOCH3
CH3COCI
CH3CONH2
( CH3CO ) 2 O
CH3CONHNH2
CH3CON3
H2SO4ñaë
c
→ R (COO) R′ + nmH O
mR(COOH) n + nR ′ (OH) m ¬
m
nm n
2
t0
m mol
n mol
• Este tạo bởi axit đơn chức và ancol đa chức
1 mol
H2SO4ñaë
c
→ (RCOO) R′ + mH O
mRCOOH + R′ (OH)m ¬
m
2
0
t
m mol
1 mol
• Este tạo bởi axit đa chức và ancol đơn chức
1 mol
(
H2SO4ñaë
c
→ R COOR′
R(COOH) n + nR ′OH ¬
t0
1 mol
n mol
• Este tạo bởi axit đơn chức và ancol đơn chức
)
n
+ nH2O
1 mol
H2SO4ñaë
c
→ RCOOR ′ + H 2 O
RCOOH + R ′OH ¬
0
t
1 mol
1 mol
1 mol
2. Cách gọi tên este
Tên gốc hiđrocacbon R' + tên anion gốc axit (đuôi "at")
Trang 1
Ví dụ:
HCOOCH3: Metyl fomat
CH2=CHCOOC6H5: Phenyl acrylat
C6H5COOCH=CH2: Vinyl benzoat
CH3CH2CH2COOC2H5: Etylbutirat
C2H5OCO-CH2-COOCH3: Etylmetylmalonat
CH3OCO-COOCH3: Đimetyl oxalat
3. Tính chất vật lí
• Giữa các phân tử este không có liên kết hiđro vì thế este có nhiệt độ sôi thấp hơn so với các axit và
ancol có cùng số nguyên tử C.
• Các este thường là những chất lỏng, nhẹ hơn nước, rất ít tan trong nước, có khả năng hòa tan được
nhiều chất hữu cơ khác nhau. Những este có khối lượng phân tử rất lớn có thể ở trạng thái rắn (như mỡ
động vật, sáp ong, ...). Các este thường có mùi thơm dễ chịu, chẳng hạn:
- Isoamyl fomiat HCOOCH2CH2CH(CH3)2: Mùi chuối chín.
- Benzyl propionat CH3CH2COOCH3C6H5: Mùi hoa nhài.
- Etylbutirat CH3CH2CH2COOC2H5: Mùi dứa.
- Etyl isovalerat CH3CH(CH3)CH2COOC2H5: Mùi táo,
- Geranyl axetat CH3COOC10H17: Mùi hoa hồng.
4. Tính chất hóa học
a) Phản ứng ở nhóm chức
• Phản ứng thủy phân
Este bị thủy phân cả trong môi trường axit và bazơ. Phản ứng thủy phân trong môi trường axit là phản
ứng nghịch của phản ứng este hóa.
H 2 SO4
→ RCOOH + R ′OH
RCOOR ′ + H − OH ¬
Phản ứng thủy phân trong môi trường kiềm là phản ứng một chiều và còn được gọi là phản ứng xà
phòng hóa:
0
H 2 O ,t
RCOOR ′ + NaOH
→ RCOONa + R ′OH
Cơ chế: cộng HO( -) vào nhóm C=O.
δ+
R – C – OR’ +
−
OH( )
€
||
OH
OH
|
|
R – C – OR’
|
O( − )
Oδ −
€
−
O( )
|
R – C + R'O( -) → R – C
||
||
O
+
R’OH
O
Giai đoạn cuối cùng là bất thuận nghịch, nên toàn bộ phản ứng xà phòng hóa là
bất thuận nghịch.
• Tác dụng với hợp chất cơ-magie
δ+
R
C
||
Oδ −
R''MgHal
OR'
→R
R ''
|
C
|
O
H O/H+
2
OR' →
R
R ''
|
R''MgHal
→R
C
||
O
R ''
|
C
|
O
H O/H+
2
R '' →
R
Ví dụ:
Trang 2
R ''
|
C
|
OH
R''
• Phản ứng với NH3 hay R”NH2
RCOOR ′ + NH 3 → RCONH 2 + R ′OH
RCOOR ′ + R ′′ NH 2 → RCONHR '' + R ′OH
• Phản ứng khử
- Khử bởi LiAlH4:
1. LiAlH /ete
→ RCH 2 OH + R'OH
RCOOR'
2. H 2 O / H +
Cơ chế:
Este không bị khử bởi NaBH 4 / C2 H 5OH
Ví dụ:
1.LiAlH 4 /ete
→ CH 2 = CHCH 2 OH + CH 3OH
CH 2 = CHCOOCH 3
2.H 2 O/H +
- Khử bằng Na + C2H5OH (phản ứng Buvo- Blăng)
Na+C 2 H 5OH
RCOOR ′
→ RCH 2 OH+R'OH
Ví dụ:
Na+C 2 H5OH
CH 2 = CHCOOCH3
→ CH 2 =CHCH 2OH+CH 3OH
b) Phản ứng ở gốc hiđrocacbon
• Phản ứng cộng vào gốc không no: Gốc hidrocacbon không no ở este có phản ứng cộng H 2 , Br2 , HBr,…
giống như hidrocacbon chưa no. Ví dụ:
0
Ni ,t
CH 2 = CHCOOCH 3 + H 2
→ CH 3CH 2COOCH 3
• Phản ứng trùng hợp: Một số este có liên kết đôi C=C có thể tham gia phản ứng trùng hợp giống như
anken. Ví dụ:
Trang 3
• Phản ứng thế Hα : Este có Hα tham gia các phản ứng:
- Tổng hợp malonic:
C2 H5ONa
R − Hal
CH 2 ( COOC 2 H 5 ) 2
→ CH ( COOC 2 H 5 ) 2
→ RCH ( COOC 2 H 5 ) 2
− Hal
2H 2 O/H
t
RCH ( COOC2 H 5 ) 2
→ RCH(COOH) 2
→ RCH 2COOH
−2C2 H5 OH
-CO2
+
0
- Phản ứng ngưng tụ Claisen tạo ra β-xetoeste. Ví dụ:
C2 H 5ONa
CH 3CO − OC 2 H 5 + H − CH 2COOC 2 H 5
→ RCO − CH 2COOC 2 H 5
C2 H 5OH
Cơ chế:
• Phản ứng với dung dịch AgNO3/NH3
Este có dạng tổng quát HCOOR', RCOOCH=CHR’, HCOOCH=CHR' có thể phản ứng với dung dịch
AgNO3/NH3 đun nóng, sinh ra kết tủa bạc.
t
HCOOR ′ + 2 Ag ( NH 3 ) 2 OH
→ ( NH 4 ) 2 CO3 + R'OH + 2Ag ↓ +2NH 3
0
⇒ n HCOOR' =
1
n Ag
2
t
RCOOCH = CHR ′ + 2 Ag ( NH 3 ) 2 OH
→ RCOONH 4 + R'CH 2COONH 4 + 2Ag ↓ +2NH 3
0
⇒ n RCOOCH =CHR' =
1
n Ag
2
t
HCOOCH = CHR ′ + 4 Ag ( NH 3 ) 2 OH
→ ( NH 4 ) 2 CO3 + R ′CH 2 COONH 4 + 4Ag ↓ +5NH 3 + H 2 O
0
⇒ n HCOOCH =CHR ' =
1
n Ag
4
5. Điều chế
a) Phản ứng este hóa
H2SO4ñaë
c
→ RCOOR′ + H O
RCOOH + R′OH ¬
2
0
t
b) Phản ứng giữa anhiđrit axit và ancol
(RCO)2O + R'OH → RCOOR' + RCOOH
Ứng dụng của phản ứng này để điều chế este phenyl vì phenol không phản ứng trực tiếp với axit
cacboxylic.
(RCO)2O + C6H5OH → RCOOC6H5 + RCOOH
c) Phản ứng giữa axit và hiđrocacbon chưa no
• Điều chế este vinyl
HgSO4
→ RCOOCH=CH2
RCOOH + CH ≡ CH
H 2 SO4
• Điều chế este với gốc ankyl bậc ba:
H2SO4ñaë
c
→ CH3COOC(CH3)3
CH3COOH + CH3C(CH3)=CH2 ¬
0
t
d) Phản ứng giữa muối bạc hay cacboxylat của kim loại kiềm và ankyl halogenua
RCOONa + R ′ Br → RCOOR ′ + NaBr
RCOOAg + RT → RCOOR ′ + AgI
Trang 4
e) Phản ứng Canizaro
(−)
OH
2C6 H 5CHO
→ C6 H 5COOCH 2 C6 H 5
Benzandehit
benzylbenzoat
f) Phản ứng Tisenco
Al ( OC2 H 5 )3
2CH3CHO
→ CH 3COOC 2 H 5
etyl axetat
III. HALOGENUA AXIT, ANHIĐRIT AXIT, AMIT VÀ NITRIN
1. Phản ứng thủy phân
a) Thủy phân trong môi trường axit
RCOHal + H2O → RCOOH + H-Hal
(RCO)2O + H2O →2RCOOH
+
H
→
RCONH2 + H2O ¬
RCOOH + NH3
+
H
R-CN + 2H2O - H →
RCOOH + NH3
b) Thủy phân trong môi trường kiềm
RCOHal + 2OH- → RCOO- + Hal- + H2O
(RCO)2O + 2OH- → 2RCOO- + H2O
o
t
RCONH2 + OH-
→ RCOO + NH3
Khả năng phản ứng:
Vì clo có độ âm điện lớn nhất nên có –I mạnh nhất, mà hiệu ứng +C lại yếu nhất.
2. Tác dụng với ancol
RCOHal + R'OH → RCOOR' + H-Hal
(RCO)2O + R'OH → RCOOR' + RCOOH
3. Tác dụng với NH hay R’NH2
RCOHal + 2NH3 + RCONH2 + NH4Hal
(RCO)2O + 2NH3 → RCONH2 + RCOONH4
RCOHal + R'NH2 → RCONHR + H-Hal
(RCO)2O + R'NH2 → RCONHR' + RCOONH3R'
4. Tác dụng với hợp chất cơ – magiê
Ví dụ:
Trang 5
5. Phản ứng khử
a) Khử bằng LiAlH4
1.LiAlH 4
RCOCl
→ RCH 2OH
2.H O+
3
(RCO) 2 O
→ 2RCH 2OH
1.LiAlH 4
2.H3O +
LiAlH 4
RCONH 2
→ RCH 2 NH 2
1.LiAlH 4
RCN
→ RCH 2 NH 2
2.H O +
3
Ví dụ:
1.LiAlH 4
→ CH 2 = CHCH 2 OH
CH 2 = CHCOCl
2.H3O +
( CH3CO ) 2 O
1.LiAlH 4
→ 2CH3CH 2 OH
2.H3O +
LiAlH 4
C6 H 5CONH 2
→ C6 H 5CH 2 NH 2
1.LiAlH 4
→ C6 H 5CH 2 NH 2
C6 H 5CN
2.H3O +
b) Khử bằng H2
Pd − BaSO 4
RCOCl + H 2
→ RCHO + HCl
0
RCONH 2 + 2H 2 Ni,t
→ RCH 2 NH 2 + H 2O
0
Ni,t
RCN + 2H 2
→ RCH 2 NH 2
6. Phản ứng thế H�
a) Clorua axit có phản ứng halogen hóa
P
R − CH 2 − COCl + Cl 2
→ R − CHCl − COCl + HCl
b) Anhiđrit axit tham gia phản ứng Peckin
Đây là phản ứng ngưng tụ anđehit thơm với anhiđrit axit tạo thành axit α, β-không nO. Ví dụ:
3COONa
C6 H 5 − CH = O + ( CH3CO ) 2 O CH
→
C6 H 5 − CH = CH − COOH + CH 3COOH
t0
7. Phản ứng chuyển vị Hopman
Amit không có nhóm thế (RCONH2) tham gia phản ứng chuyển vị Hopman tạo thành amin bậc I.
RCONH 2 + Br2 + 4NaOH → RNH 2 + Na 2CO3 + 2NaBr + 2H 2O
Cơ chế:
Ngoài ra amit còn phản ứng với HNO2 (hoặc NaNO2 + HCl) cho axit cacboxylic.
RCONH2 + HNO2 → RCOOH + N2 + H2O
8. Điều chế
Trang 6
Clorua axit và anhiđrit axit có thể điều chế trực tiếp từ axit cacboxylic.
RCOOH + PCl5 → RCOCl + POCl3 + HCl
Hoặc:
RCOOH + SOCl2 → RCOCl + SO 2 + HCl
P2 O5
2RCOOH
→(RCO) 2 O + H 2O
Phương pháp chung để điều chế amit là cho NH3 tác dụng với clorua axit hoặc anhidrit axit.
RCOCl + 2NH 3 → RCONH 2 + NH 4Cl
(RCO) 2 O + 2NH 3 → RCONH 2 + RCOONH 4
Nitrin được điều chế từ amit nhờ tác dụng của chất xúc tác SOCl2 , PCl3 và P2O5
P2 O5
RCONH 2
→ RCN
− H 2O
Ngoài ra, có thể điều chế nitrin bằng cách cho dẫn xuất halogen phản ứng vớimuối CN-.
Ví dụ: CH 3CH 2 Br + KCN → CH 3CH 2CN + KBr
IV. LIPIT
1. Khái niệm, phân loại và trạng thái tự nhiên.
• Lipit là những hợp chất hữu cơ có trong tế bào sống không hòa tan trong nước nhưng tan trong các dung
môi không phân cực như ete, clorofom,ete dâu hỏa, ... Lipit bao gồm chất béo, sáp, sterit, photpholipit, ...
chúng đều là các estephức tạp. Dưới đây ta chỉ xét về chất béo.
• Chất béo là trieste của glixerol với các axit monocacboxylic có số chẵn nguyên tử cacbon (khoảng từ
12C đến 24C) không phân nhánh (axit béo), gọi chung là triglixerit hay triaxylglixerol. Công thức chung
của chất béo:
Khi thủy phân chất béo thì thu được glixerol và axit béo. Một số axit béo thường gặp là:
Axit béo no thường gặp là:
C15H31COOH: CH3-[CH2]14-COOH (axit panmitic)
CH3COOH: CH3-[CH2]16-COOH (axit stearic).
2. Tính chất của chất béo
a) Tính chất vật lí
- Các triglixerit chứa chủ yếu các gốc axit béo no thường là chất rắn (mỡ) ở nhiệt độ phòng. Các
triglixerit chứa chủ yếu các gốc axit béo không no thường là chất lỏng (dầu) ở nhiệt độ phòng.
Trang 7
Ví dụ: tristearin, tnc = 72°C (rắn); triolein, tnc = - 4°C (lỏng)
Chú ý: Các triglixerit không no có nhiệt độ nóng chảy thấp hơn là vì các gốc axit không no, đặc biệt là
dạng cis như axit oleic, không thể xếp chặt khút được trong mạng tinh thể rắn như trường hợp axit no.
- Chất béo nhẹ hơn nước và không tan trong nước, tan trong các dung môi hữu cơ như benzen, xăng, ete,
...
b) Tính chất hóa học
- Phản ứng thủy phân trong môi trường axit: Khi đun nóng chất béo có xúc tác axit, chất béo bị thuỷ phân
tạo ra glixerol và các axit béo.
- Phản ứng xà phòng hóa: Khi đun nóng chất béo với dung dịch kiềm (KOH hoặc NaOH) thì tạo ra
glixerol và hỗn hợp muối của các axit béo. Muối natri hoặc kali của các axit béo chính là xà phòng. Phản
ứng của chất béo với dung dịch kiềm gọi là phản ứng xà phòng hoá.
Chỉ số axit: Là số miligam KOH cần để trung hòa axit béo tự do có trong 1 gam chất béo.
Ví dụ: Tính chỉ số axit của một chất béo, biết rằng để trung hoà 14 gam chất béo đó cần 15ml dung dịch
NaOH 0,1M.
Giải
n KOH = n NaOH = 0, 0015mol
⇒ m KOH = 0, 0015.56 = 0, 084gam = 84mg
⇒ Chỉ số axit của chất béo:
84
=6
14
- Phản ứng hiđro hóa
Chất béo chứa các gốc axit béo không no tác dụng với hiđro ở nhiệt độ và áp suất cao có Ni xúc tác. Khi
đó hiđro cộng vào nối đôi C=C.
3. Chất giặt rửa
a) Khái niệm về chất giặt rửa
• Chất giặt rửa là những chất khi dùng cùng với nước thì có tác dụng làm sạch các chất bẩn bám trên các
vật rắn mà không gây ra phản ứng hóa học với các chất đó.
Trang 8
• Từ xưa, con người đã biết dùng các chất giặt rửa lấy trực tiếp từ thiên nhiên như bồ kết, bồ hòn, ...Trước
khi hóa học hữu cơ ra đời, người ta cũng đã biết nấu xà phòng từ dầu mỡ và các chất kiềm. Xà phòng
chính là muối hỗn hợp của natri (hoặc kali) của các axit béo. Ngày nay người ta còn tổng hợp ra nhiều
chất không phải muối natri (hoặc kali) của các axit béo, nhưng có tác dụng giặt rửa tương tự như xà
phòng. Chúng gọi là các chất giặt rửa tổng hợp và đượcđiều chế thành các loại bột giặt, kem giặt, ...
b) Tính chất giặt rửa
• Một số khái niệm liên quan
- Chất tẩy màu làm sạch các viết màu bẩn nhờ những phản ứng hóa học. Ví dụ: nước Gia-ven, nước clo
oxi hóa chất màu thành chất không màu; SO 2 khử chất màu thành không màu. Chất giặt rửa như xà phòng
làm sạch các vết bẩn không phải nhờ các phản ứng hóa học (xem mục c).
- Chất ưa nước là những chất tan tốt trong nước, chẳng hạn như metanol, etanol, axetic, muối axetat kim
loại kiềm, ...
- Chất kị nước là những chất hầu như không tan trong nước, chẳng hạn như hiđrocacbon, dẫn xuất
halogen, ... Chất kị nước thì lại ưa dầu mỡ, tức là tan tốt vào dầu mỡ. Chất ưa nước thường kị dầu mỡ, tức
là không tan trong dầu mỡ.
• Đặc điểm cấu trúc phân tử muối natri của các axit béo
Phân tử muối natri của axit béo gồm một "đầu" ưa nước là nhóm −COO− Na + nối với một "đuôi" kị nước,
ưa dầu mỡ là nhóm −C x H y (thường x ≥ 15). Cấu trúc hóa học gồm đầu ưa nước và đuôi ưa dầu mỡ là hình
mẫu chung cho "phân tử chất giặt rửa".
• Cơ chế hoạt động của chất giặt rửa
Lấy trường hợp stearat làm ví dụ, nhóm CH3[CH2]16 -, "đuôi" ưa dầu mỡ của phân tử stearat thâm nhập
vào vết bẩn, còn nhóm −COO− Na + ưa nước lại có xu hướng kéo ra phía các phân tử nước. Kết quả vết
bẩn bị phân chia thành các ( hạt rất nhỏ được giữ chặt bởi các phân tử natri stearat không bám vào vật rắn
nữa mà phân tán vào nước rồi bị rửa trôi.
c) Xà phòng
• Sản xuất xà phòng
- Phương pháp thông thường để sản xuất xà phòng là đun dầu thực vật hoặc mỡ động vật (thường là loại
không dùng để ăn) với xút hoặc KOH ở nhiệt độ và áp suất cao. Sau khi phản ứng xà phòng hóa kết thúc,
người ta cho thêm NaCl vào và làm lạnh. Xà phòng tách ra khỏi dung dịch được cho thêm phụ gia và
thành bánh. Dung dịch còn lại được loại tạp chất, cô đặc rồi li tâm tách muối NaCl để thu lấy glixerol.
- Người ta còn sản xuất xà phòng bằng cách oxi hóa parafin của dầu mỏ nhờ oxi không khí, ở nhiệt độ
cao, có muối mangan xúc tác, rồi trung hòa axit sinh ra bằng NaOH.
2+
0
Mn ,t
R − CH 2 − CH 2 − R ′ + O 2 →
R − COOH + R ′COOH
R − COOH + NaOH → RCOONa + H 2O
R 'COOH + NaOH → R'COONa + H 2O
- Muối natri của các axit có phân tử khối nhỏ tan nhiều, còn muối natri của các phân tử axit phân tử khối
lớn không tan trong dung dịch NaCl. Chúng được tách ra dùng làm xà phòng tổng hợp. Xà phòng tổng
hợp có tính chất giặt rửa tương tự xà phòng thường.
•Thành phần của xà phòng và sử dụng xà phòng
- Thành phần chính của xà phòng là các muối natri (hoặc kali) của axit béo, thường là natri stearat
(C17H35COONa), natripanmitat (C15H31COONa), natrioleat (C17H33COONa), ... các phụ gia thường có là
chất màu, chất thơm.
Trang 9
- Xà phòng dùng trong tắm gội, giặt giũ, ... có ưu điểm là không gây hại cho da, cho môi trường (vì dễ bị
phân hủy bởi vi sinh vật có trong thiên nhiên). Xà phòng có nhược điểm là khi dùng với nước cứng (nước
chứa nhiều ion Ca2+ và Mg2+) thì các muối canxi stearat, canxi panmitat ... sẽ kết tủa làm giảm chất lượng
giặt rửa và ảnh hưởng đến vải sợi.
d) Chất tẩy rửa tổng hợp
• Sản xuất chất tẩy rửa tổng hợp
- Để đáp ứng nhu cầu to lớn và đa đạng về chất giặt rửa, người ta đã tổng hợp nhiều chất theo hình mẫu
"phân tử xà phòng" (từ là gồm đầu phân cực gắn với đuôi dài không phân cực), chúng đều có tính chất
giặt rửa tương tự như xà phòng và được gọi là chất giặt rửa tổng hợp. Ví dụ:
CH 3 ( CH 2 ) 10 − CH 2 − OSO3− Na +
CH 3 ( CH 2 ) 10 − CH 2 − C 6 H 4 − OSO 3− Na +
natri lauryl sunfat
natri đodecylbenzen sunfonat
- Chất giặt rửa tổng hợp được điều chế từ các sản phẩm của dầu mỏ. Chẳng hạn, oxi hóa parafin được axit
cacboxylic, khử axit thu được ancol, cho ancol phản ứng với H 2SO4 rồi trung hòa thì được chất giặt rửa
loại ankyl sunfat.
H 2SO 4
NaOH
R − COOH khu
→ R − CH 2OH
→ R − CH 2OSO3H
→ R − CH 2 − OSO 3− Na +
• Thành phần và sử dụng các chế phẩm từ chất giặt rửa tổng hợp
- Các chế phẩm như bột giặt, kem giặt ngoài chất rửa tổng hợp, chất thơm, chất màu ra, còn có thể có chất
tẩy trắng như natri hipoclorit, ... Natri hipoclorit có hại cho da khi giặt bằng tay..
- Ưu điểm của chất giặt rửa tổng hợp là dùng được với nước cứng, vì chúng ít bị kết tủa bởi ion canxi.
Những chất giặt rửa tổng hợp có chứa gốc hiđrocacbon phân nhánh gây ô nhiễm môi trường, vì chúng
không bị các vị sinh vật phân hủy.
B. PHƯƠNG PHÁP GIẢI NHANH CÁC DẠNG BÀI TẬP
DẠNG 1: HOÀN THÀNH SƠ ĐỒ CHUYỂN HÓA VÀ ĐIỀU CHẾ
Phương pháp: Nắm vững tính chất hóa học và phương pháp điều chế các dẫn xuất của axit cacboxylic.
Ví dụ 1: Hoàn thành các sơ đồ chuyển hóa sau:
Trang 10
Giải
c) (1) CH 3COOH + NH 3 → CH 3CONH 2 + H 2O
(2)
2 O5
CH 3CONH 2 P
→ CH 3CN + H 2O
1.LiAlH 4
→ CH 3CH 2OH
(3) CH 3COOH
2H 2 O/H +
men giaá
m
→ CH3COOH + H2O
(4) CH3CH2OH + O2
LiAH 4
→ CH 3CH 2 NH 2
(5) CH 3CONH 2
+
H
(6) CH 3CN + 2H 2O
→ CH 3COOH + NH 3
(7) CH 3COOH + PCl5 → CH 3COCl + POCl3 + HCl
(8) CH 3COCl + H 2 O → CH 3COOH + HCl
(9) CH 3COCl + NH 3 → CH 3CONH 2 + HCl
Pd − BasO4
→ CH 3CHO + HCl
(10) CH 3COCl + H 2
Trang 11
0
Ni,t
(11) CH 3CHO + H 2
→ CH 3CH 2OH
PCC,CH Cl2
→ CH 3CHO + H 2O
(12) CH 3CH 2OH 2
(13) CH 3CH 2OH + CH 3COCl → CH 3COOC 2 H 5 + HCl
1.LiAlH 4
→ 2CH 3CH 2OH
(14) CH 3COOC 2 H 5
2H 2 O/H +
H2SO4loaõ
ng
→
CH3COOH + C2H5OH
(15) CH3COOC2H5 + H2O ¬
0
t
d)
(X1)
Ví dụ 2: Từ CH4, các vô cơ và điều kiện cần thiết khác, hãy viết sơ đồ phản ứng tổng hợp các chất sau:
Trang 12
Giải
Điều chế etilen oxit:
0
,t
Điều chế metyl amin: CH 4 + HNO3 xt→
N 2 NO 2 + H 2O
CH 3 NO 2 + 3Fe + 7HCl → CH 3 NH 3Cl + 3FeCl 2 + 2H 2O
CH 3 NH 3Cl + NaOH → CH 3 NH 2 + NaCl + H 2O
Ví dụ 3: Từ axit propionic, các hóa chất và điều kiện cần thiết khác, hãy viết sơ đồ tổng hợp:
a) CH3CH 2 NH 2
b) CH 3COOC 2 H 5
c) CH3CH 2 CH 2COOC 2 H 3
d) CH 3COOC6 H5
e) HOOC − ( CH 2 ) 2 − COOC2 H 5
f) C2 H 5COCH ( CH 3 ) COC 2 H 5
Trang 13
Giải
PCl5
NH3
B2 + NaOH
→ CH 3CH 2COCl
→ CH 3CH 2 CONH 2
→ CH 3CH 2 NH 2
a) CH 3CH 2COOH
O
Ag 2 O
Br2
NaOH
2
→ CH3CH 2 COOAg
→ CH 3CH 2 Br
→ CH3CH2OH
→
b) CH 3CH 2 COOH
men giaá
m
PCl5
C2 H5OH
CH 3COOH
→ CH 3COCl
→ CH3COOC2 H5
c)
1. LiAlH 4
PBr5
CH 3CH 2 COOH
→ CH 3CH 2 CH 2 OH
→
2KCN
2.H O/H +
2
+
CH3CH 2 CH 2CN
+ H 2 O/H
→
+ C2 H2
→ CH3CH 2 CH 2COOCH = CH 2
CH 3CH 2CH 2COOH
xt,t 0
P2 O5
C6 H5OH
→ ( CH 3CO ) 2 O
→ CH 3COOC6 H5
d) 2CH3COOH
t0
+ C H OH
+ Cl2
KOH /C2 H5 OH
2 5
→ CH3CHClCOOC2H5
→ CH 3CHClCOOH
→
e) C 2 H 5COOH
PCl3
H2SO4 ñaë
c, t0
t0
+ HBr
CH 2 = CHCOOC2 H 5
→ CH 2 BrCH 2 COOC2 H 5
1.C 2 H 5 ONa
PCl5
C2 H5OH
→
→ C 2H 5COCl
→ C2 H5COOC 2 H 5
f) C 2 H 5COOH
2H 2 O/H +
C 2 H 5COCH ( CH 3 ) COOC2 H 5
DẠNG 2: VIẾT CƠ CHẾ PHẢN ỨNG
Phương pháp: Yêu cầu học sinh nắm vững:
- Cơ chế phản ứng tạo thành liên kết bội cacbon-cacbon.
- Cơ chế phản ứng cộng vào liên kết bội cacbon-cacbon.
- Cơ chế phản ứng cộng và thế ở hợp chất cacbonyl.
- Sự chuyển vị.
Trang 14
Ví dụ 1: Dùng mũi tên cong để giải thích sự tạo thành sản phẩm:
Giải
a)
b)
Ví dụ 2: Cho sơ đồ chuyển hóa:
1.LiAlH
H SO ñaë
c
K 2 Cr2O7 + H 2SO 4
4
2
4
→ X1
→ X 2
→ X3
Xiclopentanon
2.H2O/H+
t0
NBS
NaOH
P2 O5
NH 3
→ X 6
→ H 2 N − C 2 H 4 − COONa ( X 7 )
X 3
→ X 4
→ X5
hγ
t0
a) Xác định X1 , X 2 , X 3 , X 4 , X 5 , X 6 .
b) Viết cơ chế phản ứng từ X 6 → X 7
Giải
a)
Trang 15
b)
Ví dụ 3: Viết công thức cấu tạo của các hợp chất hữu cơ B, C, D, E và cơ chế phản ứng tạo thành B theo
sơ đồ sau:
Giải
Trang 16
Ví dụ 4: Viết các tác nhân phản ứng, điều kiện phản ứng (nếu có) thay cho dấu chấm hỏi (?) và vẽ cấu
trúc của các hợp chất hữu cơ A, B để hoàn thành sơ đồ chuyển hóa sau:
Giải
Ví dụ 5: Este (H) được tổng hợp theo sơ đồ dưới đây:
Trình bày chi tiết quá trình hình thành (H), biết rằng ban đầu đã xảy ra quá trình ngưng tụ kiểu andol giữa
etylaxetoaxetat và fomanđehit tạo thành một xeton α,β không no.
Giải
Trang 17
DẠNG 3: VIẾT CÔNG THỨC CẤU TẠO CÁC ĐỒNG PHÂN LÀ ESTE
• Số đồng phân cấu tạo là este no, đơn chức, mạch hở ứng với công thức CnH2nO2 là
2n − 2 (1 < n < 5)
• Công thức tính số trieste tạo bởi gixerol và các axit cacboxylic đơn chức
n 2 (n + 1)
2
Ví dụ 1: Tính số đồng phân cấu tạo là este ứng với các công thức phân tử sau: C 2H4O2, C3H6O2, C4H8O2.
Viết công thức cấu tạo của các đồng phân đó và gọi tên.
Giải
Các đồng phân este:
2−2
• C2 H 4O 2 : 2 = 1
Số trieste =
HCOOCH3: Metyl fomat
3− 2
• C3 H 6 O 2 : 2 = 2
HCOOCH2CH3: Etyl fomat
CH3COOCH3: Metyl axetat
4−2
• C 4 H 8O 2 : 2 = 4
HCOOCH2CH2CH3: Propyl fomat
CH3COOCH2CH3: Etyl axetat
HCOOCH(CH3)CH3: Isopropyl fomat
CH3CH2COOCH3: Metyl propionat
Trang 18
Ví dụ 2: Đun nóng hỗn hợp gồm glixerol cùng axit axetic và axit propionic (xúc tác H 2SO4 đặc) thì số
trieste tối đa thu được là
A. 4
B. 6
C. 8
D. 2
Giải
n 2 (n + 1) 22 (2 + 1)
=
=6
2
2
⇒ Đáp án B
Cần lưu ý rằng: Nếu đề yêu cầu tính số trieste biết khi thuỷ phân trong môi trường axit nóng thu được
dung dịch chứa glixerol và n axit béo khác nhau thì ta không sử dụng công thức trên.
Ví dụ 3: Khi thuỷ phân một triglixerit thu được dung dịch chứa glixerol, axit panmitic và axit stearic. Số
triglixerit thoả mãn điều kiện trên là
A. 4
B. 6
C. 8
D. 2
Giải
Số trieste =
Số triglixerit =
22 (2 + 1)
−2 = 4
2
⇒ Đáp án A
Ví dụ 4: Trung hoà 39,8 gam hỗn hợp X gồm hai axit cacboxylic no, đơn chức, mạch hở không nhánh
X1 , X 2 (phân tử X2 nhiều hơn phân tử X1 hai nguyên tử cacbon) bằng lượng vừa đủ dung dịch NaOH, thu
được 43,1 gam muối.
a) Xác định công thức phân tử và gọi tên X1 , X 2 .
b) Tính số trieste tối đa thu được khi đun nóng hỗn hợp gồm glixerol, X1 và X2 (xúc tác H2SO4 đặc).
Giải
a) Đặt công thức chung của hai axit là C n H 2 n+1COOH
C n H 2 n +1COOH + NaOH → Cn H 2 n +1COONa + H 2O
x
→
x
⇒ ∆m ↑= 22x = 43,1 − 39,8 ⇒ x = 0,15mol
⇒ 14n + 46 =
39,8
⇒ n = 15, 66
0,15
⇒ n1 = 14 hoặc 15 < n = 15,66 < n2 = 16 hoặc 17
Công thức của hai axit là:
X1 : CH 3 − [ CH 2 ] 13 − COOH : Axit pentadecanoic
X 2 : CH 3 − [ CH 2 ] 15 − COOH : Axit heptadecanoic
Hoặc:
X1 : CH 3 − [ CH 2 ] 14 − COOH : Axit panmitic
X 2 : CH 3 − [ CH 2 ] 16 − COOH : Axit stearic
b) Từ công thức tính số triglixerit tạo bởi glixerol với n axit béo khác nhau:
n 2 (n + 1)
2
⇒ Số trieste tối đa thu được khi đun nóng hỗn hợp gồm glixerol, C 15H31COOH và C17H35COOH hoặc
C14H29COOH và C16H33COOH (xúc tác H2SO4 đặc) là
22 (2 + 1)
=6
2
Trang 19
Ví dụ 5: Cho 10,2 gam một este đơn chức X tác dụng vừa đủ với 40 gam dung dịch NaOH 15%. Số đồng
phân cấu tạo thỏa mãn điều kiện trên của X là
A. 4.
B.3.
C. 5.
D. 6.
Giải
40.15
n NaOH =
= 0,15mol .Xét hai trường hợp sau:
100.40
• Trường hợp 1: n NaOH : n X = 1:1 ⇒ n X = 0,15mol
10, 2
= 68
0,15
⇒ R + R ' = 24 (loại vì không có R, R' phù hợp)
• Trường hợp 2: n NaOH : n X = 2 :1 ⇒ n X = 0, 075mol
⇒ M X = R + R '+ 44 =
10, 2
= 136 ( C8 H8O2 )
0, 075
Công thức cấu tạo có thể có:
⇒ MX =
⇒ Đáp án A
Ví dụ 6: Hợp chất hữu cơ X (mạch hở, không phân nhánh) có công thức phân tử C 4H8O2. Chất X tham gia
phản ứng tráng bạc. Số đồng phân cấu tạo phù hợp với điều kiện trên của X là
A. 5.
B. 10.
C. 7.
D. 6.
Giải
CH3-O-CH2-CH2-CHO; CH3-CH2-O-CH2-CHO; CH2OH-CH2-CH2-CHO; CH3-CHOH-CH2-CHO; CH3CH2-CHOH-CHO; HCOOCH2-CH2-CH3
⇒ Đáp án D
Ví dụ 6: Ancol X (C15H26O) có trong tinh dầu patchoulis, có thể được tổng hợp như sau:
a) Hợp chất đimetylxiclohexađien tác dụng với metylvinylxeton sinh ra hợp chất A là sản phẩm chính.
Viết tên đầy đủ của đimetylxiclohexađien đã dùng và s đồ phản ứng tạo thành A. Viết công thức cấu trúc
của 3 sản phẩm phụ là đồng phân của A.
b) Cho A tác dụng với hợp chất cơ kẽm (sinh ra từ etylbromoetanoạt và kẽm trong ete), sau đó thủy phân
sản phẩm trong dung dịch axit loãng thì thu được monoeste B (C 16H26O3). B tác dụng với (CH3CO)2O sinh
ra đieste C. Chất C bị tách CH 3COOH tạo thành monoeste không no liên hợp D (C 6H4O2). Viết công thức
cấu trúc của B, C, D và các sản phẩm đồng phân của D có thể sinh ra cùng với D.
c) Hiđro hóa chọn lọc nối đôi ngoài vòng của D, thu được este E (C 16H26O2). Khử E bằng LiAIH4 cho
ancol F. Cho F tác dụng với (C6H5)3CCl trong piriđin, tạo thành G (C33H38O). Hiđro-bo hóa G (dùng B2H6
tiếp đến H2O2/NaOH), sau đó oxi hóa (CrO3/piriđin), sinh ra xeton P. Cho P tác dụng với NaH (để sinh ra
Trang 20
cacbanion) sau đó với CH3I thì được sản phẩm Q (C34H40O2). Viết công thức cấu trúc của E, F, G, P và Q
cùng với sơ đồ các phản ứng.
d) Trong môi trường axit, Q chuyển thành R đồng thời giải phóng (C 6H5)3COH. R tác dụng với TsCL sinh
ra sản phẩm S. Chất S phản ứng với KI/axeton tạo thành T (C 15H25IO). T tham gia phản ứng đóng vòng
(nhờ Na THF) cho ancol X. Dùng công thức cấu trúc, viết sơ đồ các phản ứng và cho biết X chứa bao
nhiều nguyên tử cacbon bất đối.
Giải
a) Ancol X (C15H26O) có trong tinh dầu patchoulis, có thể được tổng hợp như sau:
1,3-đimetylxiclohexa-1,3-đien
metylvinylxeton
Công thức cấu trúc của 3 trong số các sản phẩm phụ là đồng phân của A:
Zn
→ BrZnCH 2 COOEt
b) BrCH 2COOEt
ete
Các sản phẩm đồng phân của D có thể sinh ra cùng với D là
Trang 21
c)
d)
Ancol X chứa 5 nguyên tử C*.
DẠNG 4: BÀI TẬP VỀ NHẬN BIẾT
Phương pháp: Nắm vững phương pháp nhận biết và điều chế este.
• Nhận biết: Tuỳ theo đặc điểm cấu tạo của este mà có thể dùng cách
- Đun nóng: Các este thường có mùi thơm dễ chịu như isoamyl axetat có mùi chuối chín, etyl butirat có
mùi dứa, etyl isovalerat có mùi táo, ...
Trang 22
- Dùng dung dịch NaOH đun nóng, sau đó nhận biết sản phẩm. Chẳng hạn như CH 3COOC2H5 và
CH3COOCH=CH2 sau khi tham gia phản ứng xà phòng hoá thì chỉ có CH 3COOCH=CH2 mới cho sản
phẩm tham gia phản ứng tráng bạc.
0
t
CH3COOC2 H5 + NaOH
→ CH 3COONa + C 2 H5OH
0
t
CH3COOCH = CH 2 + NaOH
→ CH 3COONa + CH 3CHO
CH3CHO + 2 Ag ( NH 3 ) 2 OH → CH 3COONH 4 + 2Ag ↓ +3NH 3 + H 2O
- Dung dịch AgNO3/NH3 đun nóng: Các este có dạng HCOOR', RCOOCH=CHR, HCOOCH=CHR’,
R1COOCHR'OCOR2, ...khi tác dụng với dung dịch AgNO3/NH3 đun nóng, đều sinh ra kết tủa Ag.
Ví dụ 1: Có các lọ mất nhãn, mỗi lọ đựng một trong các chất lỏng sau: Ancol etylic, anđehit axetic, axit
axetic, etylic axetat. Trình bày phương pháp hoá học để nhận ra các dung dịch trên. Viết phương trình hoá
học của phản ứng đã xảy ra.
Giải
Dùng quỳ tím ẩm nhận ra axit axetic vì có hiện tượng quỳ tím hoá đỏ.
Các chất còn lại cho phản ứng lần lượt với dung dịch AgNO 3/NH3 đun nóng, chất nào có kết tủa bạc xuất
hiện thì đó là anđehit axetic.
CH3CHO + 2 Ag ( NH 3 ) 2 OH → CH 3COONH 4 + 2Ag ↓ +3NH 3 + H 2O
Dùng Na làm thuốc thử đối với ancol etylic và etyl axetat. Nhận ra ancol etylic vì có sủi bọt khí thoát ra.
1
C 2 H 5OH + Na → C2 H 5ONa + H 2 ↑
2
(sủi bọt)
Chất còn lại là etyl axetat không hiện tượng gì.
Ví dụ 2: Viết công thức cấu tạo các đồng phân mạch hở có công thức C 2H4O2 và trình bày phương pháp
hoá học để nhận biết từng đồng phân trên đựng riêng biệt trong các lọ mất nhãn.
Giải
• Công thức cấu tạo:
CH3-COOH: Axit axetic
HCOOCH3: Metyl fomat
CH2OH-CHO: 2-hiđroxietanal
• Nhận biết:
- Dùng quỳ tím ẩm làm thuốc thử nhận ra axit axetic vì có hiện tượng quỳ tím hoá đỏ.
- Hai chất còn lại cho tác dụng lần lượt với Na, nếu có sủi bọt khí thoát ra là 2-hiđroxietanal.
1
CH 2OH − CHO + Na → CH 2ONa − CHO + H 2 ↑
2
(sủi bọt)
Chất còn lại là metyl fomat.
Lưu ý: Không dùng dung dịch AgNO 3/NH3 đun nóng để nhận biết metyl fomat và 2-hiđroxietanal vì đều
có kết tủa bạc xuất hiện.
HCOOCH 3 + 2 Ag ( NH3 ) 2 OH → ( NH 4 ) 2 CO3 + CH 3OH + 2NH 3 + 2Ag ↓ + H 2 O
CH 2OHCHO + 2 Ag ( NH 3 ) 2 OH → CH 2OHCOONH 4 + 3NH 3 + 2Ag ↓ + H 2O
Ví dụ 3: Chỉ dùng nước brom làm thuốc thử hãy trình bày phương pháp hoá học để phân biệt các dung
dịch riêng biệt sau đựng trong các lọ mất nhãn: Axit fomic, anđehit axetic, etyl axetat.
Giải
Dùng nước brom làm thuốc thử. Nhận ra:
- Axit fomic: Có sủi bọt khí thoát ra
Trang 23
HCOOH + Br2 → CO 2 ↑ +2HBr
- Anđehit axetic: Làm mất màu nước brom
CH 3CHO + Br2 + H 2 O → CH 3COOH + 2HBr
- Chất còn lại là etyl axetat không hiện tượng gì.
DẠNG 5: BÀI TẬP VỀ PHẢN ỨNG XÀ PHÒNG HOÁ
• Khi bài toán cho thủy phân hoàn toàn một este thu được
+) Muối của axit đơn chức và ancol đơn chức
⇒ Đó là este đơn chức (RCOOR’)
0
t
RCOOR' + NaOH
→ RCOONa + R'OH
⇒ n NaOH = n este
+) Muối của axit đơn chức và ancol đa chức ⇒ Đó là este đa chức (RCOO)nR'
0
t
(RCOO) n R' + nNaOH
→ nRCOONa + R'(OH) n
⇒ n NaOH = n.n este
+) Muối của axit đa chức và ancol đơn chức ⇒ Đó là este đa chức R ( COOR' ) m
t
R ( COOR' ) m + mNaOH
→ R(COONa) m + mR'OH
0
⇒ n NaOH = m.n este
'
+) Muối của axit đa chức và ancol đa chức ⇒ Đó là este đa chức R n (COO) nm R m
0
t
R n (COO) nm R ′m + nmNaOH
→ nR(COONa) m + mR ′ (OH) n
⇒ n NaOH = mn.n este
+) Hai muối của axit đơn chức ⇒ Đó là este đơn chức RCOOAr
0
t
RCOOAr + 2NaOH
→ RCOONa + ArONa + H 2O
⇒ n NaOH = 2.n este
+) Muối của axit đơn chức và anđehit đơn chức
⇒ Đó là este đơn chức RCOOCH=CHR'
0
t
RCOOCH = CHR ′ + NaOH
→ RCOONa + RCH 2CHO
⇒ n NaOH = n este
+) Muối của axit đơn chức và xeton đơn chức
⇒ Đó là este đơn chức RCOOCR2=CHR1
0
t
RCOOCR 2 = CHR 1 + NaOH
→ RCOONa + R 1CH 2COR 2
⇒ n NaOH = n este
• Este 2 chức tác dụng với dung dịch NaOH cho
+) 1 muối + 1 ancol + 1 anđehit thì este đó có công thức tổng quát: ROCOC x H y COOCH = CHR'
0
t
ROCOC x H y COOCH = CHR ′ + 2NaOH
→ ROH + C x H y (COONa) 2 + R ′ CH 2 CHO
′′
′
+) 1 muối + 1 ancol + 1 xeton thì este đó có công thức tổng quát: ROCOC x H y COOCR = CH − R
0
t
ROCOC x H y COOCR ′′ = CHR ′ + 2NaOH
→ ROH + C x H y (COONa) 2 + R ′ CH 2 COR ''
′
+) 2 muối + 1 ancol : công thức tổng quát: RCOOC x H y OCOR
t
RCOOC x H y OCOR ′ + 2NaOH
→ RCOONa + R ′COONa +C x H y (OH) 2
0
+) 1 muối + 2 ancol: công thức tổng quát: ROCOC x H y COOR'
Trang 24
0
t
ROCOC x H y COOR ′ + NaOH
→ ROH + NaOCOC x H y COONa + R ′ OH
+) 1 muối + 1 ancol : công thức tổng quát: R − OCO − C x H y − COO − R
0
t
ROCOC x H 4 COOR + NaOH
→ 2ROH + C x H y (COONa) 2
• Khi đầu bài cho 2 chất hữu cơ đơn chức mạch hở tác dụng với NaOH cho
+) 2 muối và 1 ancol, có khả năng hai chất đó là:
R1COOR ′
R1COOH
hoặc
2
2
′
′
R COOR
R COOR
+) 1 muối và 1 ancol có khả năng hai chất đó là
RCOOR ′
RCOOR ′
RCOOH
hoặc ′
hoặc ′
′
R OH
R OH
R OH
+) 1 muối và 2 ancol có khả năng hai chất đó là
RCOOR ′
RCOOR ′
′′ hoặc ′′
RCOOR
R OH
Chú ý:
• Nếu bài toán cho dung dịch thu được sau phản ứng với dung dịch MOH (M là kim loại kiềm), đem cô
cạn còn lại m gam chất rắn khan thì trong chất rắn khan ngoài muối kim loại kiềm của axit cacboxylic
còn có thể có MOH nếu MOH dư.
• Hai este đồng phân (chẳng hạn CH3COOCH3 và HCOOC2H5) sẽ có cùng công thức phân tử nhưng gốc
axit và gốc ancol khác nhau nên trong phản ứng xà phòng hóa ta vẫn phải sử dụng công thức trung bình
để thay cho công thức của hai este.
• Este HCOOR', RCOOCH=CHR', HCOOCH=CHR' có phản ứng với dung dịch AgNO 3/NH3 đun nóng,
sinh ra kết tủa Ag.
HCOOR ′ + 2 Ag ( NH 3 ) 2 OH → ( NH 4 ) 2 CO3 + R ′OH + 2Ag ↓ +2NH 3
RCOOCH = CHR ′ + 2 Ag ( NH 3 ) 2 OH → RCOONH 4 + R ′CH 2COONH 4 + 2Ag ↓ +2NH3
HCOOCH = CHR ′ + 4 Ag ( NH 3 ) 2 OH → ( NH 4 ) 2 CO3 + R ′CH 2COONH 4 + 4Ag ↓ +5NH3 + H 2 O
• Khi xà phòng hoá hoàn toàn một este đơn chức mà thu được mmuối = mMOH +meste thì đó là este vòng.
Ví dụ 1: Hợp chất hữu cơ X chứa C, H, O. Lấy 0,1 mol X tác dụng vừa đủ với 200ml dung dịch NaOH
1M chỉ thu được 19,6 gam chất hữu cơ Y và 6,2 gam ancol Z. Đem Y tác dụng với dung dịch HCl loãng,
dư thu được hợp chất hữu cơ Y 1. Khi Y1 tác dụng với Na thì số mol H 2 thoát ra bằng số mol Y 1 tham gia
phản ứng. Kết luận không đúng về X là
A. X có 2 chức este.
B. Trong X có 2 nhóm hiđroxyl.
C. X có công thức phân tử C6H10O6.
D. X có khả năng tham gia phản ứng tráng bạc.
Giải
Theo định luật bảo toàn khối lượng:
mX = 19,6 +6,2 - 0,2.40 = 17,8 gam ⇒ MX = 178 (C6H10O6)
6.2 + 2 − 10
∆=
= 2 = số vòng + số liên kết π
2
n x : n NaOH = 1: 2 ⇒ X có chứa 2 nhóm este hoặc 1 este + 1 axit, khi đó số mol ancol Z có thể bằng số
mol X hoặc bằng 2 lần số mol X.
Nếu nZ = 2nX = 0, 2mol ⇒ M Z = 31 gam / mol (loại)
Trang 25


![Nghiên cứu chiết tách và chuyển hóa một số dẫn xuất của axit asiatic từ cây rau má [centella asiatica (l ) urban]](https://media.store123doc.com/images/document/13/ce/rv/medium_rvv1387790565.jpg)
![Nghiên cứu tổng hợp một số dẫn xuất của axit asiatic phân lập từ cây rau má [centella asiatica (l ) urban] và thăm dò hoạt tính sinh học của chúng](https://media.store123doc.com/images/document/13/ce/pq/medium_pqy1387792106.jpg)