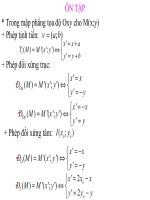- Trang chủ >>
- Đề thi >>
- THPT Quốc Gia
on tap chuong 1 hoa hoc 10
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (107.01 KB, 1 trang )
<span class='text_page_counter'>(1)</span><div class='page_container' data-page=1>
<b>CẤU TẠO NGUYÊN TỬ</b>
<b>Thành phần nguyên tử.</b>
Lưu ý : 1u = 1,6605.10<b>-27 <sub>kg</sub></b>
<b>Nguyên tử có cấu tạo rỗng.</b>
Đường kính của nguyên tử gấp 10000 đường kính hạt nhân.
<b>Khối lượng nguyên tử tập trung ở hạt nhân.</b>
Khối lương proton hoặc nơtron gấp 1840 lần khối lượng electron.
<b>Kí hiệu nguyên tử: </b>
A
Z
X
A là số khối, bằng tổng số proton và electron.
Z là số hiệu nguyên tử, bằng số thứ tự nguyên tố trong BTH.
X là kí hiệu nguyên tố
<b>Đồng vị. </b>
1
2
A
Z 1 2
A
Z
X
x%
<sub>A x A (100 x)</sub>
M
100
X
(100 x)%
x là % về số lượng hay số mol.
<b>Cấu trúc vỏ nguyê tử</b>
Lớp thứ n có tổng số obitan là n2<sub>.</sub>
Obitan s có dạng hình cầu.
Obitan p (px, py, pz) có hình số 8 nổi.
<b>Sự phân bố electron trong nguyên tử</b>
Nguyên lí vứng bền Nguyên lí Pauli Quy tắc Hund
Ở trạng thái cơ bản, trong
nguyên tử các electron chiếm lần
lượt những obitan có mức năng
lượng từ thấp đến cao.
Trên một obitan chỉ có thể có
nhiều nhất là hai electron và
hai electron này chuyển động
tự quay khác chiều nhau xung
quay trục riêng của mỗi
electron.
Trong cùng một phân lớp,
các electron sẽ phân bố trên
các obitan sao cho số
electron độc thân là tối đa và
các electron này phái có
chiều tự quay giống nhau.
Lưu ý: 3d4<sub>4s</sub>2<sub></sub><sub> 3d</sub>5<sub>4s</sub>1<sub> và 3d</sub>9<sub>4s</sub>2<sub></sub><sub> 3d</sub>10<sub>4s</sub>1
Vỏ nguyê tử KLMNOPQLớp e Phân lớp es, p, d, f
1, 3, 5, 7
Obitan (AO)
Nguyên tử
Vỏ nguyên tử
Hạt nhân
nguyên tử
Electron
1-9,1094. 10-31 <sub>kg ≈ 1u</sub>
proton
1+
1,6726.10-27<sub>kg ≈ 1u</sub>
</div>
<!--links-->