kim loai nang
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (1.6 MB, 38 trang )
<span class='text_page_counter'>(1)</span>BÀI TIỂU LUẬN 1. CÁC PHƯƠNG PHÁP PHÂN TÍCH KIM LOẠI NẶNG PHƯƠNG PHÁP HÓA HỌC VÀ PHƯƠNG PHÁP TRẮC QUANG Giáo viên hướng dẫn: PGS. TS Đồng Thị Kim Loan Học viên: - Nguyễn Tú Oanh - Vũ Hồng Nhung - Nguyễn Mai Phong - Phạm Trường Sơn - Trần Đình Minh.
<span class='text_page_counter'>(2)</span> MỤC LỤC 2. Phương pháp hóa học. Phương pháp trắc quang.
<span class='text_page_counter'>(3)</span> I. Phương pháp hóa học 3. I.1 Phương pháp khối lượng Nguyên tắc: là phương pháp định lượng cấu tử X dựa trên phép đo khối lượng. Việc thực hiện có thể tiến hành theo 2 phương pháp: • phương pháp trực tiếp • phương pháp gián tiếp • phương pháp kết tủa ( đóng vai trò quan trọng và ứng dụng rộng rãi nhất).
<span class='text_page_counter'>(4)</span> Phöông phaùp keát tuûa 4. Hòa tan mẫu để chuyển X thành ion trong DD; dùng thuốc. thử C kết tủa và tách X dưới dạng hợp chất ít tan CX: AX →A+ X X + C →CX↓ Dựa trên kết tủa chất cần phân tích với thuốc thử phù hợp. Lọc, rửa, sấy hoặc nung rồi cân và từ đó xác định được hàm lượng chất phân tích.. VD: Asen thường được kết tủa dưới dạng Ag3AsO4, As2S3, Mg(NH4)AsO4 hay Ag2HAsO4, sau đó kết tủa được lọc, rửa, sấy rồi đem cân từ đó xác định hàm lượng chất phân tích..
<span class='text_page_counter'>(5)</span> Một số điều kiện quan trọng trong quá trình phân tích bằng khối lượng: - Sự kết tủa hoàn toàn:. 5. Chọn điều kiện thích hợp để kết tủa hoàn toàn chất cần xác định (kết tủa trong điều kiện tối ưu) như nhiệt độ, dung môi, kích thước hạt kết tủa tạo thành, lượng thuốc kết tủa, pH của dung dịch, sự tồn tại chất điện li lạ. - Độ sạch của kết tủa: Kết tủa tạo thành phải có độ tinh khiết cao, do đó cần chú ý đến sự hấp phụ và cộng kết của kết tủa..
<span class='text_page_counter'>(6)</span> Ưu điểm và nhược điểm của phương pháp khối lượng 6. Phương pháp phân tích khối lượng là phương pháp cổ điển, độ chính xác có thể đạt tới 0,1%. Phương pháp này không đòi hỏi dụng cụ đắt tiền nhưng quá trình phân tích lâu, nhiều giai đoạn phức tạp đặc biệt khi phân tích lượng vết các chất. Vì vậy phương pháp này không được dùng phổ biến trong thực tế để xác định lượng vết các chất mà chỉ dùng trong phân tích hàm lượng lớn..
<span class='text_page_counter'>(7)</span> I. Phương pháp hóa học 7. I.2 Phương pháp thể tích Nguyên tắc: là phương pháp định lượng cấu tử X dựa trên phép đo thể tích. • Đo thể tích dung dịch thuốc thử đã biết nồng độ chính xác (dung dịch chuẩn) được thêm vào dung dịch chất định phân để tác dụng đủ toàn bộ lượng chất định phân tích đó. Thời điểm thêm lượng thuốc thử tác dụng với toàn bộ chất định phân gọi là điểm tương đương. Để nhận biết điểm tương đương, người ta dùng các chất gây ra hiện tượng có thể quan sát bằng mắt gọi là các chất chỉ thị..
<span class='text_page_counter'>(8)</span> Phương pháp thể tích 8. CÁC PHƯƠNG PHÁP PHÂN TÍCH THỂ TÍCH. TRUNG HÒA. OXY HÓA –KHỬ. KẾT TỦA. TẠO PHỨC.
<span class='text_page_counter'>(9)</span> Phương pháp thể tích 9. VD: Ta có thể xác định Cadimi bằng EDTA ở môi trường pH = 9-10 với chỉ thị ETOO hoặc môi trường pH=6 với chỉ thị xylendacam. Khi đó chất chỉ thị chuyển từ màu đỏ sang màu vàng : H6F + Cd2+ H4FCd + 2H+ H4FCd + H2Y2- CdY2- + H6F (đỏ). (vàng). Phương pháp phân tích thể tích có ưu điểm là nhanh chóng và dễ thực hiện, tuy nhiên cũng giống như phương pháp phân tích khối lượng, phương pháp này cũng không được sử dụng trong phân tích lượng vết, vì phải thực hiện quá trình làm giàu phức tạp..
<span class='text_page_counter'>(10)</span> II. Phương pháp trắc quang 10. Định nghĩa – Nguyên tắc Phân tích trắc quang là tên gọi chung của các phương pháp phân tích quang học dựa trên sự tương tác chọn lọc giữa chất cần xác định với năng lượng bức xạ thuộc vùng tử ngoại, khả kiến hoặc hồng ngoại. Nguyên tắc của phương pháp trắc quang là dựa vào lượng ánh sáng đã bị hấp thu bởi chất hấp thu để tính hàm lượng của chất hấp thu.. c.
<span class='text_page_counter'>(11)</span> Phân loại các phương pháp phân tích trắc quang 11. Phương pháp UV-VIS Phương pháp so màu quang điện. Phương pháp quang kế ngọn lửa.
<span class='text_page_counter'>(12)</span> Phương pháp UV-VIS 12. Đặc trưng năng lượng của miền phổ.
<span class='text_page_counter'>(13)</span> Phương pháp UV-VIS 13. Đặc trưng năng lượng của miền phổ Ánh sáng vùng UV có bước sóng trong khoảng: 200 – 400 nm Ánh sáng vùng IR có bước sóng trong khoảng: 800 – 2000 nm Ánh sáng vùng VIS có bước sóng trong khoảng: 396 – 760 nm Trong phương pháp trắc quang – phương pháp hấp thu quang học, chúng ta thường sử dụng vùng phổ UV – VIS có bước sóng từ 200 – 800 nm.
<span class='text_page_counter'>(14)</span> Đặc trưng năng lượng của miền phổ 14. Đỏ. Da cam. Vàng. Lục. 739 - 610. 610 - 590. 590 - 560. 560 - 510. Lam. Chàm. Tím. 510 - 490. 490 - 430. 430 - 400.
<span class='text_page_counter'>(15)</span> Cở sở lý thuyết của phương pháp 15. Nếu dung dịch hấp thu bức xạ vùng tử ngoại,. ánh sáng trắng truyền suốt hoàn toàn đến mắt, dung dịch không màu. Dung dịch có màu khi chứa cấu tử có khả năng hấp thu bức xạ vùng thấy được, do đó khi định lượng bằng phương pháp quang phổ hấp thu thấy được còn được gọi là phương pháp so màu hay đo màu. Dung dịch mẫu có nồng độ càng cao, khả năng hấp thu của mẫu càng mạnh, cường độ ánh sáng đến mắt càng yếu, dung dịch có màu càng sẫm..
<span class='text_page_counter'>(16)</span> Định luật Bouguer – Lambert – Beer 16. Chiếu bức xạ đơn sắc có bước sóng I có cường độ I0 qua dung dịch chứa cấu tử khảo sát có nồng độ C. Bề dày dung dịch là l. Tại bề mặt cuvet đo, một phần bức xạ bị phản xạ có cường độ IR, một phần bức xạ bị hấp thu có cường độ IA. Bức xạ ra khỏi dung dịch có cường độ I..
<span class='text_page_counter'>(17)</span> Định luật Bouguer – Lambert – Beer 17. IR I0. IA. I. Do đó : I0 = IR + IA + I Chọn cuvet đo có bề mặt nhẵn, truyền suốt để IR = 0 I0 = IA + I.
<span class='text_page_counter'>(18)</span> Định luật Bouguer – Lambert – Beer 18. I0 log =A= .l.C I. Trong đó : là một hằng số tỉ lệ có tên độ hấp thu phân tử biểu thị độ hấp thu của dung dịch có nồng độ chất tan là 1M được đựng trong bình dày 1cm và có đơn vị là l.mol-1cm-1. Bây giờ ta có thể áp dụng dễ dàng định luật Beer vào việc xác định nồng độ các chất tan bằng cách đo độ hấp thu A của chúng..
<span class='text_page_counter'>(19)</span> Cường độ hấp thu bức xạ của cấu tử được xác định bằng 2 đại lượng 19. Độ truyền suốt T (Transmittance). I I T = hay T% = ×100 I0 I0 Độ hấp thu A (Absorbance) hay mật độ. quang OD (optical density). I0 1 100 A = log = log = log = 2 - logT% I T T%.
<span class='text_page_counter'>(20)</span> Các nguyên nhân gây sai lệch khỏi định luật Beer Mức độ đơn sắc của ánh sáng tới. Ánh sáng không đơn sắc thường dẫn đến độ lệch âm. Chất màu hấp thu cực đại ở max và chỉ ở max mới có sự tuyến tính giữa Aimax – Ci và đồ thị Aimax – Ci là một đường thẳng, khi đó mật độ quang là cực đại. Mức độ đơn sắc càng lớn, khả năng tuân theo định luật Lambert – Beer càng lớn. Nồng độ lớn của dung dịch khảo sát: Nồng độ của dung dịch lớn sẽ xảy ra tương tác điện, đại lượng thay đổi, thông thường khi tăng nồng độ dung dịch, giá trị giảm. Sự sai lệch khỏi định luật06/23/21 Lambert – Beer thường là sai số âm.. 20.
<span class='text_page_counter'>(21)</span> 21. Sự trùng hợp hoặc khử trùng hợp phân tử,. sự solvat hoá hay hydrat hoá xảy ra khi thay đổi nồng độ chất hấp thu; sự tạo thành các hợp chất trung gian, phức phụ, các hợp chất đồng phân, tạo hệ keo hay sự có mặt của các chất điện ly mạnh, pH đều có khả năng làm thay đổi độ hấp thu của dung dịch, làm sai lệch khỏi định luật Beer..
<span class='text_page_counter'>(22)</span> Phân tích định lượng bằng phương pháp trắc quang UV-VIS 22. Phương pháp đường chuẩn Phương pháp thêm chuẩn Phương pháp vi sai Phương pháp chuẩn độ trắc quang Phương pháp so sánh.
<span class='text_page_counter'>(23)</span> Phương pháp đường chuẩn QUI TRÌNH 23 - Pha một loạt dung dịch chuẩn có Ctc tăng dần một cách đều đặn. (thường 5 – 8 Ctc) (Các dung dịch chuẩn phải có cùng điều kiện như dung dịch xác định) - Tiến hành đo A hoặc T của dãy chuẩn ở đã chọn. - Dựng đồ thị AX = f(Cx). Viết PTHQ tuyến tính của đường chuẩn. - Tiến hành pha chế dung dịch xác định. - Do A hoặc T của mẫu. - Căn cứ vào PTHQ tuyến tính của dãy chuẩn và AX mà xác định nồng độ của chất X trong mẫu.
<span class='text_page_counter'>(24)</span> Phương pháp đường chuẩn 24. - Đồ thị A = f(Ctc) tuỳ theo cách đo ta thu được 2 dạng đường chuẩn: + Dạng 1: đi qua gốc tọa độ + Dạng 2: không đi qua gốc tọa độ - Khi chọn vùng nồng độ để xây dựng đường chuẩn phải chú ý: + Vùng nồng độ của dãy chuẩn phải bao gồm cả CX + Với vùng nồng độ đã chọn dung dịch phải tuân theo định luật Beer + Các giá trị Atc ứng với nồng độ đã chọn phải sao cho khi đo trên máy có độ lặp lại cao và bảo đảm sự tuyến tính A = f(C).
<span class='text_page_counter'>(25)</span> Phương pháp đường chuẩn 25. ƯU VÀ NHƯỢC ĐIỂM CỦA PHƯƠNG PHÁP. ƯU ĐIỂM - Với một đường chuẩn cho phép phân tích hàng loạt mẫu. - Dung dịch cũng không đòi hỏi phải tuân theo định luật Beer một cách nghiêm ngặt. NHƯỢC ĐIỂM - Độ chính xác của phương pháp không cao. - Không loại được ảnh hưởng của nền mẫu.
<span class='text_page_counter'>(26)</span> Phương pháp so sánh So sánh 1 chuẩn -Pha một dung dịch chuẩn có Ctc. -Tiến hành đo A hoặc T của dd chuẩn so với dd so sánh (Atc) Theo định luật Lambert – Beer: AAtc = lCtc. CX =. X. A tc. ×C tc. -Pha dung dịch mẫu với nồng độ cần xác định CX (chưa biết) -Tiến hành đo A hoặc T của dd mẫu so với dd so sánh (AX) Theo định luật Lambert – Beer: AX = lCX. Khi dung dịch xác định và dd chuẩn có cùng bản chất, có thể xem như nhau, và l = const. 26.
<span class='text_page_counter'>(27)</span> Phương pháp so sánh - Dung dịch cần xác định và dung dịch tiêu chuẩn phải nằm trong khoảng tuân theo định luật Lambert – Beer. - Thuận lợi khi số lượng mẫu ít - So sánh với nhiều mẫu chuẩn. - Để kết quả chính xác thì Ctc1,Ctc2 và Cx phải có nồng độ gần bằng nhau.. 27.
<span class='text_page_counter'>(28)</span> Phương pháp thêm chuẩn 28. Theo phương pháp này thì mật độ quang của dd mẫu chứa chất cần xác định được so sánh với chính dung dịch đó có thêm những lượng xác định của chất cần xác định. Trong phương pháp thêm chuẩn, ta thêm vào dd xác định một lượng dd tiêu chuẩn. Có 2 cách thực hiện: -Dùng một dung dịch chuẩn và áp dụng công thức tính -Dùng đồ thị để biểu diễn.
<span class='text_page_counter'>(29)</span> Phương pháp thêm chuẩn 29.
<span class='text_page_counter'>(30)</span> Phương pháp thêm chuẩn Phạm vi ứng dụng của phương pháp thêm chuẩn. Phương pháp thêm chuẩn thường được áp dụng khi nồng độ chất phân tích rất nhỏ (vi lượng) Ưu điểm của phương pháp thêm chuẩn là có thể loại được ảnh hưởng của nền mẫu. Tuy nhiên, chỉ áp dụng đối với những dung dịch tuân theo định luật Lambert – Beer . 30.
<span class='text_page_counter'>(31)</span> Máy đo quang 31. Cuvet chứa dung dịch phức màu..
<span class='text_page_counter'>(32)</span> Phương pháp so màu quang điện 32. Phương pháp so màu quang điện là phương pháp phân tích dựa trên sự so sánh cường độ màu của dung dịch nghiên cứu với cường độ màu của dung dịch tiêu chuẩn có nồng độ xác định. Phương pháp này được dùng chủ yếu để xác định lượng nhỏ của các chất, tốn ít thời gian so với các phương pháp hoá học khác..
<span class='text_page_counter'>(33)</span> Định luật cơ bản của phương pháp so màu: 33. Nếu chiếu một dòng sáng (cường độ I0) vào một cuvet đựng dung dịch thì một phần của nó (cường độ Ir) bị phản xạ từ mặt cuvet, một phần khác (cường độ Ia) bị dung dịch hấp thụ, phần còn lại (cường độ It) đi qua cuvet. Ta có: Io = Ia + Ir + It Khi sử dụng một loại cuvet có thể xem cường độ dòng ánh sáng phản xạ là không đổi, và thường không lớn nên có thể bỏ qua. Khi đó phương trình trên có dạng: I0 = Ia + It I0 và It có thể đo trực tiếp còn I a tìm được theo công thức I a = I 0 - I t. Dựa trên nghiên cứu thực nghiệm Bugơ (Bougueur) và Lămbe (Lambert) đã thiết lập định luật và phát biểu như sau: Những lớp chất có chiều dày đồng nhất trong những điều kiện khác như nhau, luôn hấp thụ một tỉ lệ bằng nhau của chùm sáng chiếu vào những lớp chất đó..
<span class='text_page_counter'>(34)</span> Phương pháp so màu quang điện 34. Biểu thức toán học của định luật là: It = I0 . e -kl Trong đó: l : Chiều dày lớp hấp thụ k : Hệ số tắt, hệ số này chỉ phụ thuộc vào bản chất chất tan và bước sóng ánh sáng chiếu vào dung dịch. Do đó định luật hấp thụ ánh sáng Bugơ - Lămbe chỉ đúng cho tia đơn sắc. Khi nghiên cứu sự hấp thụ ánh sáng của dung dịch, Bia (Beer) đã thiết lập được mối tương quan giữa hệ số tắt k với nồng độ chất hấp thụ theo phương trình: k = ε' . C Kết hợp những nghiên cứu của Bugơ - Lămbe - Bia thì: It = I0 . 10 - ε Cl Nếu nồng độ C được tính theo mol/l; chiều dày lớp dung dịch (l) đo bằng cm thì ε được gọi là hệ số tắt phân tử hay hệ số hấp thụ phân tử; ε là một đại lượng không đổi phụ thuộc vào bước sóng ánh sáng, bản chất của chất tan, nhiệt độ dung dịch..
<span class='text_page_counter'>(35)</span> Phương pháp quang kế ngọn lửa 35. Phương pháp quang kế ngọn lửa là một dạng phân tích quang phổ phát xạ. Nguyên lý cơ bản của phương pháp như sau: Dưới tác dụng của nhiệt độ ngọn lửa các nguyên tử, phân tử hoặc ion của chất bị kích thích sẽ chuyển sang trạng thái các dao động của điện tử phát xạ. Cường độ phát xạ này được đo bằng dụng cụ quang học rồi từ đó tính ra nồng độ chất cần xác định. Phạm vi sử dụng quang kế ngọn lửa rất lớn. Rất nhiều nguyên tố có thể dùng phương pháp này để xác định trực tiếp hoặc gián tiếp với tốc độ nhanh và có độ chính xác cao..
<span class='text_page_counter'>(36)</span> Phương pháp quang kế ngọn lửa 36. Cơ sở lí thuyết : Sự hấp thụ hoặc phát xạ năng lượng ánh sáng làm cho nguyên tử (hoăc phân tử, ion) chuyển từ trạng thái bình thường sang trạng thái kích thích và ngược lại. ở trạng thái bình thường nguyên tử có năng lượng nhỏ nhất, khi hấp thụ năng lượng chúng chuyển sang trạng thái kích thích. Thời gian nguyên tử ở trạng thái kích thích rất ngắn (thường là 10 -8 giây) rồi lại chuyển về trạng thái cân bằng kèm theo sự phát xạ. Sự phát xạ phụ thuộc vào mức năng lượng của chúng ở trạng thái bình thường và trạng thái kích thích. ∆E = E2 – E2 = hv Như vậy mỗi một nguyên tử hay ion biến đổi từ trạng thái bình thường sang trạng thái kích thích được đặc trưng bằng một trị số năng lượng nhất định. Vì vậy, sự phát xạ nguyên tử của bất kì một nguyên tố nào cũng có thành phần quang phổ ñặc trưng hay cấu tạo vạch quang phổ đặc trưng..
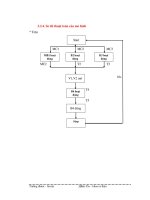
<span class='text_page_counter'>(37)</span> Phương pháp quang kế ngọn lửa 37. 1. 2. 3. 4. 1. Nguồn phát xạ: gồm máy bơm không khí nối với ống phun mù để chuyển dung dịch sang trạng thái sol khí đưa vào ngọn lửa, bộ phận cấp hơi đốt đưa vào đèn. 2. Thiết bị đơn sắc: thường là các kính lọc phân lập, mỗi nguyên tố có kính lọc màu riêng, thường có các kính lọc của natri, kali, canxi... 3. Máy thu phát xạ: đo cường độ phát xạ. đa số các nước thường dùng tế bào quang điện. 4. Điện kế nhạy (đến 10 -10 A). đó là kiểu điện kế gương quay..
<span class='text_page_counter'>(38)</span> 38.
<span class='text_page_counter'>(39)</span>