Bai 13 Luyen tap chuong 1 Cac loai hop chat vo co
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (317.25 KB, 17 trang )
TIẾT 18: LUYỆN TẬP CHƯƠNG I:
CÁC LOẠI HỢP CHẤT VÔ CƠ
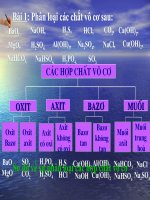
Bài 1: Phân loại các hợp chất vô cơ sau
BaO,
H2S,
NaOH,
H2SO4, Al(OH)3,
MgO,
NaHCO3,
NaHSO4,
H3PO4,
HCl,
Na2SO4,
CO2, Ca(OH)2,
NaCl, Cu(OH)2,
SO3.
Các hợp chất vô cơ
oxit
Oxit
Oxit
Bazơ
axit
SO3
BaO
MgO
Axit
Bazơ
Muối
Axit
Bazơ
Bazơ
Muối Muối
không
trung
không
có oxi có oxi
tan
axit
hoµ
tan
H3PO4 H2S Ca(OH)2 Al(OH)3 NaHCO3 NaCl
Axit
SơCOđồ
vềHsự
phân
các hợp
chất
vơ cơ4 Na2SO4
NaHSO
Cu(OH)
NaOH
HClloại
2
2SO4
2
Tính chất hoá học của các loại hợp chất vô cơ
OXIT AXIT
OXIT BAZƠ
+ Axit
+ Oxit axit
?
?
+ H2 O
Nhiệt
phân
huỷ
+ Bazơ
+ Oxit baz¬
?
?
MUèI
?
+ Baz¬
?
+ Axit
+ Oxit axit
+ Muèi
?
+ H2 O
?
+ Axit
+ Kim loại
+ Bazơ
+ Oxit bazơ
+ Muối
?
BAZƠ
AXIT
Chú thích: Mui cũn cú thờm một số tính chất sau:
Mi + Mi
Mi + kim lo¹i
Hai muối mới.
Kim loại mới + Muối mới.
Muối b nhiệt phân hủ sinh ra nhiỊu chÊt kh¸c.
Bài 2:
Căn cứ vào sơ đồ biểu thị những tính chất hóa học của chất vơ cơ,
hãy chọn các chất thích hợp để viết các phương trình hóa học cho
mỗi loại hợp chất.
1. Oxit
a) Oxit bazơ + ………
Nước → Bazơ
Na2 O + H2O → 2NaOH
b) Oxit bazơ + .............
Axit → Muối + nước
Na2O + H2SO4 → Na2SO4 + H2O
c) Oxit axit + ……
Nước → Axit
SO3 + H2O → H2SO4
d) Oxit axit + ……….
Bazơ → Muối + nước
CO2 + 2NaOH → Na2CO3 + H2O
e) Oxit axit + Oxit bazơ → ……….
Muối
CaO + CO2 → CaCO3
2. Bazơ
a) Bazơ + ………..
Axit → Muối + Nước
NaOH + HCl → NaCl + H2O
Oxit axit
b) Bazơ + ……….
→ Muối + Nước
2NaOH + SO2 → Na2SO3 + H2O
Muối
c) Bazơ + ……….
→ Muối + Bazơ
FeCl2 + 2NaOH → Fe(OH)2 + 2NaCl
d) Bazơ
t0
→ Oxit bazơ + Nước
t0
Cu(OH)2 → CuO + H2O
3. Axit
Kim loại → muối + hiđro
a) Axit + ………..
H2SO4 + Zn → ZnSO4 + H2
Bazơ → muối + nước
b) Axit + ……….
2NaOH + H2SO4 → Na2SO4 + 2H2O
c) Axit + ……….
Oxit bazơ → muối + nước
H2SO4 + CaO → CaSO4 + H2O
Muối → muối + axit
d) Axit + ……….
Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
4. Muối
a) Muối +
……..
→ Muối + Axit
Axit
H2SO4 + BaCl2 → BaSO4 + 2HCl
Bazơ → Muối + Bazơ
b) Muối + ……….
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2
Muối
c) Muối + …….
→ Muối + Muối
AgNO3 + NaCl → AgCl + NaNO3
Kim loại → Muối + Kim loại
d) Muối + ……….
Fe + CuSO4 → FeSO4 + Cu
e) Muối
t0
→
t0
Muối
………..
+
2KClO3 → 2KCl + 3O2
Khí…
Bài 3:
Bằng phương pháp hóa học hãy trình bày cách nhận
biết các dung dịch sau:
NaOH, HCl, Na2SO4 , Na2CO3 , H2SO4
Viết các PTHH xảy ra.
Gợi ý làm bài
-Lấy mẫu thử và đánh số thứ tự từng mẫu.
-Cho quỳ tím lần lượt vào từng mẫu thử:
+ Nhóm 1: làm q tím hóa đỏ: HCl và H2SO4
+ Nhóm 2: làm q tím hóa xanh: NaOH
+ Nhóm 3: q tím khơng đổi màu: Na2CO3 và Na2SO4
-Cho dung dịch BaCl2 vào từng mẫu thử trong nhóm 1. Thấy có kết
tủa trắng là H2SO4
BaCl2 + H2SO4(lỗng) → BaSO4
trắng
+ 2HCl
-Cho dung dịch HCl vào từng mẫu trong nhóm 3. Thấy sủi bọt, khí
thốt ra làm vẩn đục nước vơi trong thì đó là Na2CO3 .
Na2CO3 + 2HCl → NaCl + CO2 + H2O
Bài 4: Cho hai nhóm dung dịch sau đây, những cặp chất nào
giữa hai nhóm có phản ứng với nhau?
HCl
H2SO4
NaOH
KCl
Ba(NO3)2
Viết các PTHH xảy ra.
MgSO4
HCl
H2SO4
MgSO4
phản ứng
phản ứng
không xảy ra
NaOH
phản ứng
KCl
không xảy ra
không xảy ra
không xảy ra
phản ứng
Ba(NO3)2
PTHH:
NaOH + HCl →
NaOH + H2SO4 →
phản ứng
NaCl + H2O
Na2SO4 + H2O
NaOH + MgSO4 → Na2SO4 + Mg(OH)2
Ba(NO3)2 + H2SO4 → BaSO4 + 2HNO3
Ba(NO3)2 + MgSO4 → BaSO4 + Mg(NO3)2
.
Bài 5: Hoà tan hoàn toàn 5,6 gam Fe trong dung dịch HCl Sau
phản ứng thu được thể tích khí hiđro ở đktc là:
A. 22,4 l
B. 12,2 l
C. 2,24 l
Tóm tắt:
D. 1,12l
nFe = 5,6: 56 = 0,1 (mol)
Fe + 2HCl → FeCl2 + H2
nFe = nH = 0,1 (mol)
Thể tích khí hiđro ở đktc là
2
V= 0,1. 22, 4 =2,24 l
Bài 5 :
Đốt cháy hoàn toàn 8g bột Lưu huỳnh ngồi khơng khí rồi dẫn
tồn bộ khí sinh ra vào trong 200ml dung dịch KOH 0,75M
thu được dung dịch A. Các chất khí đo ở đktc.
a. Viết các PTHH xảy ra ?
b.Tính khối lượng của muối thu được trong dung dịch A.
c. Tính CM của dung dịch A sau phản ứng. Coi thể tích dung
dịch khơng đổi.
Gợi ý làm bài
a. -Tính số mol của lưu huỳnh để suy ra số mol của SO2 (đktc).
- Tính số mol của KOH
+ Lập tỉ số giữa số mol KOH / số mol SO2 suy ra sản phẩm.
Viết các PTHH xảy ra.
b. So s¸nh tØ lƯ sè mol của 2 chất tham gia phản ứng để suy ra
chÊt hÕt, chÊt dư. TÝnh to¸n theo chÊt hÕt.
-Tính số mol của Muối suy ra khối lượng.
c. Áp dụng cơng thức tính nồng độ mol/lít tìm ra kết quả.
DẶN DỊ
• Ơn tập lại nội dung của bài
• Làm bài tập SGK
• Chuẩn bị báo cáo thí nghiệm cho tiết thực
hành.