Tiểu luận nhóm II rong sụn chống biến đen ở tôm
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (941.95 KB, 77 trang )
TRƯỜNG ĐẠI HỌC NHA TRANG
KHOA SAU ĐẠI HỌC – NGÀNH CÔNG NGHỆ THỰC PHẨM
MÔN HỌC
“THU NHẬN VÀ ỨNG DỤNG CÁC CHẤT CĨ HOẠT TÍNH SINH HỌC”
TIỂU LUẬN
CHIẾT TÁCH HOẠT CHẤT ỨC CHẾ ENZYME TYROSINASE TỪ
LOÀI RONG SỤN (KAPPAPHYCUS ALVAREZII) VÀ ỨNG DỤNG
TRONG BẢO QUẢN “TÔM THẺ CHÂN TRẮNG”
GVHD: PGS. TS. Huỳnh Nguyễn Duy Bảo
HVTH: Nhóm II – Lớp CHTP2020
1. Võ Duy Bằng
– 62CH013
2. Lê Thị Bích Vân – 62CH014
3. Lê Thị Ánh Tuyết -
LỜI CẢM ƠN
Lời đầu tiên tập thể nhóm II xin gửi lời cảm ơn đến thầy PGS.TS Huỳnh Nguyễn Duy
Bảo, đã truyền đạt và hướng dẫn bộ môn “Thu nhận và ứng dụng các chất có hoạt tính sinh
học” trong suốt thời gian qua.
Mặc dù thời gian chỉ 4 tuần học , với sự nỗ lực và hướng dẫn của thầy, đã giúp nhóm
hiểu sâu hơn về khái niệm các chất có hoạt tính sinh học và cách thức, phương pháp chiết
tách, tinh sạch các hoạt chất có hoạt tính sinh học từ tự nhiên và ứng dụng trong nhiều lĩnh
vực như y học và thực phẩm.
Để tìm hiểu thêm về mơn học, nhóm chọn chủ đề “Chiết tách hoạt chất ức chế
enzyme tyrosinase từ loài rong sụn (kappaphycus alvarezii) và ứng dụng
trong bảo quản “tôm thẻ chân trắng” để tìm hiểu nghiên cứu, đánh giá một cách
đầy đủ hơn. Đây là chủ đề có tính ứng dụng cao trong ngành chế biến, bảo quản tôm đông
lạnh xuất khẩu ở nước ta.
Với thời gian có hạn nên nhóm chỉ tìm đề tài để nghiên cứu tổng quan và nhận xét đánh
giá rút ra bài học cho mỗi thành viên nhóm.
Rất mong thầy thơng cảm, tạo điều kiện và góp ý để các thành viên nhóm hiểu rõ và
nắm vững kiến thức đã được học.
Nhóm II một lần nữa xin chân thành cảm ơn thầy PGS.TS Huỳnh Nguyễn Duy Bảo.
MỤC LỤC
LỜI CẢM ƠN...................................................................................................................... i
DANH MỤC BẢNG......................................................................................................... vi
DANH MỤC HÌNH.......................................................................................................... vii
MỞ ĐẦU............................................................................................................................ 1
CHƯƠNG 1.
TỔNG QUAN.......................................................................................... 3
1.1 Tổng quan về rong sụn Kappaphycus alvarezii.......................................................... 3
1.2 Tổng quan về tơm....................................................................................................... 5
1.2.1
Tình hình nuôi trồng và xuất khẩu thủy sản........................................................... 5
1.2.2
Tổng quan về tơm thẻ chân trắng........................................................................... 5
1.2.3
Thành phần hóa học của tơm................................................................................. 7
1.2.3.1 Nước...................................................................................................................... 7
1.2.3.2 Protein.................................................................................................................... 8
1.2.3.3 Lipid...................................................................................................................... 8
1.2.3.4 Vitamin.................................................................................................................. 9
1.2.3.5 Chất khống........................................................................................................... 9
1.2.4
Biến đổi của tơm sau khi chết................................................................................ 9
1.2.4.1 Các biến đổi về cảm quan.................................................................................... 10
1.2.4.2 Biến đổi do vi sinh vật......................................................................................... 11
1.2.4.3 Biến đổi hóa học.................................................................................................. 11
1.2.4.4 Biến đổi enzyme.................................................................................................. 13
1.3 Tổng quan về enzyme tyrosinase và hiện tượng biến đen ở tôm..............................14
1.3.1
Tyrosinase............................................................................................................ 14
1.3.2
Hiện tượng biến đen ở tôm................................................................................... 15
1.4 Tình hình nghiên cứu về rong sụn, enzyme tyrosinase gây biến đen ở tôm..............16
1.4.1 Nghiên cứu trên thế giới...................................................................................... 16
iv
1.4.2
Nghiên cứu trong nước........................................................................................ 19
CHƯƠNG 2.
ĐỐI TƯỢNG, VẬT LIỆU VÀ PHƯƠNG PHÁP NGHIÊN CỨU.........23
2.1 Đối tượng nghiên cứu và phạm vi nghiên cứu.......................................................... 23
2.1.1
Rong sụn.............................................................................................................. 23
2.1.2
Tôm thẻ chân trắng.............................................................................................. 23
2.2 Phương pháp nghiên cứu.......................................................................................... 24
2.2.1
Bố trí thí nghiệm.................................................................................................. 24
2.2.1.1 Thí nghiệm xác định điều kiện chiết thích hợp.................................................... 26
2.2.1.2 Nghiên cứu tách phân đoạn.................................................................................. 28
2.2.1.3 Nghiên cứu bảo quản tôm sau thu hoạch.............................................................. 29
2.2.2
Phương pháp phân tích......................................................................................... 30
2.2.2.1 Thành phần hóa học cơ bản của mẫu rong........................................................... 30
2.2.2.2 Thành phần hóa học cơ bản của dịch chiết rong.................................................. 30
2.2.2.3 Đánh giá hoạt tính ức chế enzyme tyrosinase...................................................... 31
2.2.2.4 Đánh giá sự biến đổi cảm quan của tơm trong q trình bảo quản.......................32
2.2.3
Phương pháp xử lý số liệu.................................................................................... 32
2.3 Hóa chất và thuốc thử............................................................................................... 32
CHƯƠNG 3.
KẾT QUẢ NGHIÊN CỨU VÀ THẢO LUẬN...................................... 33
3.1 Định tính và định lượng thành phần hóa học của rong sụn Kappaphycus alvarezii .33
3.1.1
Định lượng thành phần cơ bản trong rong sụn Kappaphycus alvarezii................33
3.1.2
Định tính thành phần cơ bản trong dịch chiết rong sụn Kappaphycus alvarezii...33
3.2 Điều kiện chiết thích hợp......................................................................................... 34
3.2.1
Ảnh hưởng của thời gian chiết đến khả năng ức chế enzyme tyrosinase..............34
3.2.2
Ảnh hưởng của nhiệt độ chiết đến khả năng ức chế enzym tyrosinase tại nồng
độ 3500 μg/ml................................................................................................................... 36
3.3 Tách phân đoạn dung môi chiết................................................................................ 38
v
3.3.1
Hiệu suất chiết..................................................................................................... 38
3.3.2
Khả năng ức chế enzyme tyrosinase.................................................................... 40
3.4 Bảo quản tôm sau thu hoạch..................................................................................... 43
KẾT LUẬN VÀ KIẾN NGHỊ........................................................................................... 47
TÀI LIỆU THAM KHẢO................................................................................................ 48
PHỤ LỤC......................................................................................................................... 56
vi
DANH MỤC CÁC KÝ HIỆU, CÁC CHỮ VIẾT TẮT
DMSO
Dimethyl sunlfoxide
DNS
Acid dinitrosalicylic
EA-AP
Chiết xuất phân đoạn etyl acetate
En-AP
Chiết xuất phân đoạn enzyme
EtoAc
Ethyl acetate
L-DOPA
L-3,4-dihydroxyphenylalanine
MBC
Nồng độ diệt khuẩn tối thiểu
MIC
Nồng độ ức chế tối thiểu
NL/DM
Nguyên liệu/ dung môi
NMR
Kỹ thuật quang phổ
PA
Poly Amid
PPO
Polyphenol oxidase
DANH MỤC BẢNG
Bảng 1.1 : Hàm lượng một số vitamin trong thịt tôm.........................................................9
Bảng 3.1: Định lượng thành phần cơ bản của rong sụn Kappaphycus alvarezii...............35
Bảng 3.2: Bảng định tính thành phần cơ bản có trong dịch chiết rong sụn Kappaphycus
alvarezii............................................................................................................................ 36
Bảng 3.3: Hiệu suất chiết qua các phân đoạn của rong sụn..............................................40
Bảng 3.4: Bảng điểm đánh giá cảm quan mức độ biến đen của tôm khi sử dụng dịch
chiết rong sụn ở nồng độ 20mg/mL và 30mg/mL sau 6 ngày bảo quản............................47
Bảng 3.5: Bảng điểm đánh giá chất lượng cảm quan của tôm khi sử dụng dịch chiết
rong sụn ở nồng độ 20 mg/mL và 30 mg/mL sau 6 ngày bảo quản..................................48
DANH MỤC HÌNH
Hình 1.1: Q trình biến đổi của tơm sau khi chết.......................................................10
Hình 1.2: Quá trình biến đổi của ATP..........................................................................13
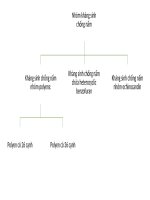
Hình 1.3: Cơ chế của sự biến đen ở tơm......................................................................17
Hình 2.1: Rong sụn Kappaphycus alvarezii.................................................................24
Hình 2.2: Tơm thẻ chân trắng (Litopenaeus vannamei)..............................................25
Hình 2.3: Sơ đồ thí nghiệm tổng qt..........................................................................26
Hình 2.4: Sơ đồ bố trí thí nghiệm nghiên cứu ảnh hưởng của các thời gian chiết khác
nhau của rong sụn đến khả năng ức chế enzyme tyrosinase.........................................27
Hình 2.5: Sơ đồ bố trí thí nghiệm nghiên cứu ảnh hưởng của các nhiệt độ chiết khác
nhau của rong sụn Kappaphycus aleverizii đến khả năng ức chế enzyme tyrosinase. . .28
Hình 2.6: Tách phân đoạn............................................................................................29
Hình 2.7: Sơ đồ bố trí thí nghiệm bảo quản tơm từ dịch chiết rong sụn.......................31
Hình 3.1: Phần trăm ức chế của mẫu rong sụn Kappaphycus alvarezii đối với enzyme
tyrosinase tại nồng độ 3500 μg/ml và 4000 μg/ml ở các thời gian chiết khác nhau.
37
Hình 3.2: Phần trăm ức chế của mẫu rong sụn Kappaphycus alvarezii đối với enzyme
tyrosinase tại nồng độ 3500 μg/ml, 4000 μg/ml ở các nhiệt độ chiết khác nhau
39
Hình 3.3: Khả năng ức chế enzym tyrosinase (giá trị %) ở các phân đoạn chiết khác
nhau của rong sụn Kappaphycus alvarezii...................................................................42
Hình 3.4: Khả năng ức chế enzym tyrosinase (giá trị IC 50) ở các phân đoạn chiết khác
nhau của rong sụn Kappaphycus alvarezii.Các chữ cái khác nhau chỉ ra sự khác nhau
có ý nghĩa thống kê p<0,05..........................................................................................43
Hình 3.5 : Hình ảnh tơm qua các ngày bảo quản..........................................................46
MỞ ĐẦU
1.
Tính cấp thiết của đề tài
Tơm là sản phẩm quan trọng mũi nhọn của ngành thủy sản Việt Nam và luôn
chiếm phần lớn trong kim ngạch xuất khẩu thủy sản. Trong chế biến, bảo quản tôm
nguyên liệu là công đoạn rất quan trọng nhằm duy trì chất lượng ban đầu để đảm bảo
chất lượng sản phẩm đầu ra. Một trong những biến đổi thường gặp nhất ở tôm nguyên
liệu sau khi thu hoạch là hiện tượng biến đen do enzyme tyrosinase. Biến đen không
gây ảnh hưởng đến chất lượng sản phẩm nhưng làm giảm giá trị cảm quan.
Tyrosinase (hay còn gọi là polyphenol oxydase (PPO)) được biết đến như là
một enzym chủ chốt trong quá trình tổng hợp melanin. Tác động của PPO là xúc tác
q trình oxi hóa phenol thành quinon tạo màu nâu trong mô tế bào bị tổn thương.
PPO là nguyên nhân chính gây ra hiện tượng hóa nâu ở nhiều loại trái cây, rau củ và
biến đen trên một số loại hải sản (chủ yếu là tơm) trong q trình chế biến và bảo quản
sau thu hoạch. Sự biến đen ảnh hưởng đến chất lượng và giảm giá trị cảm quan thực
phẩm, tác động đến nền kinh tế, ảnh hưởng đến các nhà sản xuất và ngành công
nghiệp chế biến thực phẩm.
Việc dùng các chất bảo quản: acid boric, hợp chất chứa sulphite, acid ascorbic,
hỗn hợp acid citric ascorbic, acid kojic, 4- hexylresorcinol đã được nghiên cứu [55].
Tuy nhiên, việc sử dụng các hóa chất ảnh hưởng đến vấn đề an toàn thực phẩm do dư
lượng hóa chất gây lo ngại cho người tiêu dùng. Gần đây các nguyên liệu tự nhiên có
nguồn gốc từ thực vật và vi sinh vật cũng đã được nghiên cứu để hạn chế sự biến đen.
Dịch chiết có nguồn gốc từ thực vật như: dịch chiết măng tây xanh [79], Hoa Crocus
Sativus [75], thực vật ăn được ở Việt Nam: lá trà xanh, lá trầu không, lá ổi, lá khoai
lang, lá lốt, lá nhàu [14]. Dịch chiết có nguồn gốc từ vi sinh vật như: Streptomyces
swartbergensis sp. Nov. [51], Streptomyces roseolilacinus NBRC. 12815 [62],
Lactobacilus sp. [46]. Việc tìm kiếm các hợp chất ức chế mới có nguồn gốc tự nhiên
để đảm bảo an toàn chất lượng cho sản phẩm hiện nay vẫn là mối quan tâm của các
ngành chế biến và bảo quản thực phẩm.
Việt Nam là nước nhiệt đới, có bờ biển dài có khí hậu thuận lợi cho việc
nuôi trồng và phát triển nhiều loại rong quý có giá trị kinh tế cao. Kể từ khi du nhập
vào nước ta từ năm 1993 cây rong sụn tỏ ra thích hợp với khí hậu Việt Nam. Đặc biệt
1
là các tỉnh miền Trung nước ta. Hiện nay, việc nuôi trồng rong sụn đã và đang phát
triển mạnh ở các tỉnh như Ninh Thuận, Khánh Hoà, Phú Yên và ở nhiều địa phương
khác. Rong sụn là một loại thực phẩm có giá trị dinh dưỡng cho sức khỏe, có giá trị
cao về kinh tế. Vì thế, việc tìm hiểu về các ứng dụng của loài rong biển này là cấp
thiết.
Xuất phát từ thực tế trên, đề tài “Nghiên cứu khả năng ức chế enzyme
tyrosinase từ loài rong sụn (Kappaphycus alvarezii) ở Nha Trang, Khánh Hòa và
thử nghiệm bảo quản tơm thẻ chân trắng” với mục tiêu là tìm ra khả năng ức chế
của rong Sụn đối với enzyme tyrosinase gây hiện tượng biến đen ở tôm.
2.
Mục tiêu của đề tài
a) Định tính và định lượng các thành phần trong rong sụn (Kappaphycus
alvarezii).
b) Xác định được điều kiện chiết thích hợp để thu nhận được chất ức chế enzyme
tyrosinase cao nhất.
c) Xác định được phân đoạn cho hoạt tính ức chế enzyme tyrosinase cao nhất.
d) Thử nghiệm khả năng chống biến đen trên tôm.
3.
Nội dung nghiên cứu
-
Xác định thành phần của rong sụn (Kappaphycus alvarezii).
-
Nghiên cứu ảnh hưởng của điều kiện chiết (thời gian, nhiệt độ) đến hiệu quả
ức chế enzyme tyrosinase.
-
Nghiên cứu phân đoạn có hoạt tính ức chế cao nhất.
-
Nghiên cứu khả năng chống biến đen của rong sụn (Kappaphycus alvarezii)
trên tôm.
4.
Ý nghĩa khoa học và thực tiễn
Đề tài cung cấp dữ liệu khoa học để xác định khả năng ức chế enzym tyrosinase
của rong sụn (Kappaphycus alvarezii) và nghiên cứu được điều kiện chiết thích hợp để
thu được dịch chiết có hoạt tính ức chế enzym tyrosinase cao nhất.
Kết quả nghiên cứu của đề tài là cơ sở để ứng dụng dịch chiết từ rong sụn trong
bảo quản tôm sau thu hoạch nhằm hạn chế sự biến đen trên tôm.
2
CHƯƠNG 1.
TỔNG QUAN
1.1 Tổng quan về rong sụn Kappaphycus alvarezii
Rong biển được biết đến là nguồn nguyên liệu giàu các hợp chất có hoạt tính
sinh học quan trọng. Việt Nam có một hệ tảo biển phong phú với khoảng 1000 lồi,
trong đó có 638 lồi rong biển đã được định danh [38]. Trong những năm gần đây,
rong biển thu hoạch tại các vùng biển ở Việt Nam đã bước đầu được nghiên được
nghiên cứu một số hoạt tính sinh học như hoạt tính chống oxy hóa, kháng tế bào tế bào
ung thư và kháng khuẩn. Ví dụ, Cương và cộng sự (2016) đã đánh giá khả năng chống
oxy hóa của một số loài rong biển thu hoạch tại vùng biển Khánh Hịa. Tại vùng biển
Khánh Hịa có cả ba ngành rong đỏ, rong lục và rong nâu [37].
Trong năm 2010- 2011, dự án “điều tra tổng thể đa dạng sinh học các hệ sinh
thái rạn san hô và vùng ven đảo ở vùng biển Việt Nam phục vụ phát triển bền vững” đã
tiến hành nghiên cứu, đánh giá hiện trạng thành phần loài rong biển tại 19 vùng đảo ở
biển Việt Nam. Bằng phương pháp hình thái so sánh và phân tích cấu trúc tế bào, tác
giả đã xác định được 376 loài rong biển, thuộc 62 họ, 31 bộ thuộc 4 ngành rong biển.
Trong đó, ngành rong Đỏ (Rhodophyta) có 178 lồi, ngành rong Lục (Chlorophyta) có
94 lồi, ngành rong nâu (Ochrophyta) có 80 lồi và ngành rong Lam (Cyanobacteria)
có 24 lồi [13].
Rong đỏ là lồi có số lượng loài lớn nhất trong các loài rong và là loài có lợi ích
đối với thiên nhiên và con người, là nguồn thực phẩm có giá trị đối với sức khỏe của
con người cũng như vật ni [16] trong đó điển hình là rong sụn. Rong sụn là nguồn
cung cấp dồi dào các vitamin, khoáng chất và acid amin tốt cho cơ thể như A, B1, B2,
B6, C, D, E, sắt, đồng, kẽm, magne, calci, florua, mangan, niken, coban.
Hàm lượng
vitamin A có trong rong sụn đã cao gấp 2 – 3 lần so với cà rốt, gấp 10 lần bơ. Hàm
lượng vitamin B2 cao gấp 7 lần trong trứng. Vitamin C, E cao gấp nhiều lần trong rau
quả. Hàm lượng canxi cao gấp 3 lần so với sữa bò [9]. Hàm lượng iod cũng cao hơn so
với những loại thực phẩm khác, kể cả những thực phẩm có nguồn gốc từ biển. Từ đó,
rong sụn được trồng rộng rãi hơn. Ngày nay khoa học ngày càng phát triển, công
nghiệp chế biến rong biển và việc sử dụng ngày càng nhiều. Rong sụn đã được nghiên
cứu và ứng dụng như: Tách chiết carrageenan thô và tinh chế phục vụ cho ngành công
nghiệp thực phẩm và phi thực phẩm; chế biến nước giải khát, siro từ rong sụn; chế
biến mứt, kẹo Gum, kẹo thạch và rượu rong sụn; chế biến kim chi, rong sụn dầm dấm,
bánh tráng rong sụn; sản xuất chế phẩm thay thế hàn the sử dụng trong thực phẩm; và
nhiều sản phẩm khác [21].
Rong sụn thuộc ngành rong đỏ (Rhodophyta), Lớp: Florideophyceae, Bộ:
Gigartinales, Họ: Areschougiaceae, Giống: Kappaphycus, Loài: bao gồm các loài
alvarezii, cottonii, inermis, procrusteanum, striatum. Trong đó lồi Kappaphycus
alvarezii (Doty) Doty là lồi có sản lượng cao nhất.
Rong sụn (Kappaphycus alvarezii) là một loài rong biển nhiệt đới, sinh trưởng
và có nguồn gốc tự nhiên ở vùng biển châu Á - Thái Bình Dương. Đây là lồi rong
biển có giá trị kinh tế cao, có thể chế biến thành các dạng thực phẩm sử dụng trực tiếp
từ rong tươi hay đã phơi khô. Thành phần hóa học chủ yếu của rong sụn là
Carrageenan, chiếm 40-55% khối lượng rong khô. Đây là một loại polysaccharide có
tính tạo đơng, kết dính và được sử dụng rộng rãi trong nhiều lĩnh vực kinh tế [6].
Rong sụn có hình trụ trịn, phân nhánh lộn xộn. Đường kính có thể đạt đến 5÷6
mm, giịn màu lục vàng hoặc lục thẫm. Rong sụn là lồi rong nhập nội, có đặc tính
giịn dễ gãy khi tươi. Vì vậy, các nhà khoa học tại Phân viện khoa học Vật liệu Nha
Trang đã thống nhất đặt tên cho loài này là rong sụn. Đặc điểm này cũng được sử dụng
để phân biệt với các lồi rong hiện có ở Việt Nam, trong sản xuất giao dịch thương
mại trao đổi tư liệu. Đường kính thân chính có thể đạt tới 20 mm. Từ trọng lượng 100g
ban đầu sau một năm rong sụn có thể tăng trưởng thành bụi rong, nặng 14-16 kg. Rong
sụn chia nhánh rậm rạp, kiểu tự do không theo quy luật, thể chất trơn nhớt keo sụn, có
màu nâu xanh, thân giịn dễ gãy, khi khơ thành sợi cứng. Rong s ụn có tốc độ tăng
trưởng tới 10%/ngày. Rong phát triển tốt ở nhiệt độ 25-28⁰C [15].
Từ tháng 3/1993, chương trình hợp tác về khu hệ và nguồn lợi rong biển kinh tế
Việt Nam giữa Phân viện Vật liệu Nha Trang (nay là Viện nghiên cứu và Ứng dụng
Công nghệ Nha Trang) và Nhật Bản, Phân viện Vật liệu Nha Trang đã tiến hành du
nhập rong sụn giống, nghiên cứu nhân giống và thử nghiệm nuôi trồng rong sụn tại
vùng biển Nam Trung bộ nước ta. Với nguồn giống ban đầu này, từ cuối năm 1993,
các nhà khoa học thuộc Phân viện Vật liệu Nha Trang do ông Huỳnh Quang Năng phụ
trách đã trồng thử nghiệm rong sụn tại các vùng ven biển của tỉnh Khánh Hòa và Ninh
Thuận. Qua thử nghiệm thấy, rong sụn hồn tồn thích nghi với điều kiện tự nhiên ở
nước ta [26].
Từ đó đến nay, nghề nuôi trồng rong sụn đã và đang phát triển ở các tỉnh: Ninh
Thuận, Khánh Hòa, Phú Yên, Bình Định, Kiên Giang và hiện đang là đối tượng nuôi
nhiều tỉnh ven biển miền Trung từ Nghệ An trở vào quan tâm. Đến nay, nuôi trồng
rong sụn trở thành một nghề mới bổ sung vào nghề nuôi trồng thủy hải sản của Việt
Nam, góp phần tạo cơng việc làm cho hàng ngàn lao động. Rong sụn trở thành cây
giảm nghèo do kỹ thuật nuôi trồng đơn giản và chi phí đầu tư ban đầu để ni trồng
rong sụn thấp [5].
1.2 Tổng quan về tơm
1.2.1 Tình hình ni trồng và xuất khẩu thủy sản
Việt Nam đứng thứ 4 thế giới về xuất khẩu thủy sản, đứng số 1 Đông Nam Á và
số 2 châu Á [28].
Năm 2018, kim ngạch xuất khẩu thủy sản ước đạt khoảng 9 tỷ USD, tăng 8,4%.
Trong đó hầu hết các nhóm sản phẩm đều tăng so với năm 2017: tôm đạt 3,58 tỷ USD,
giảm 7,1% (tôm chân trắng 2,48 tỷ USD giảm 2,0%; tôm sú 810 triệu USD, giảm
7,8%) [3].
Về tình hình sản xuất giống một số đối tượng thủy sản chủ lực cơ bản đã đáp
ứng nhu cầu giống cho ni. Cả nước có 2.457 cơ sở sản xuất giống tơm nước lợ,
trong đó có 1.855 cơ sở sản xuất giống tơm sú và 602 cơ sở sản xuất giống tôm thẻ
chân trắng. Năm 2018, số lượng tôm thẻ chân trắng bố mẹ nhập khẩu khoảng 200.000
con; sản lượng tôm giống sản xuất là 120 triệu con tôm giống. So với chỉ tiêu tại
phương án tăng trưởng năm 2018 của Bộ: Giá trị sản xuất vượt 2,4%; tổng sản lượng
vượt 3,0%, trong đó sản lượng khai thác vượt 2,4%, sản lượng nuôi trồng tượt 3,6%
(cá tra vượt 10,4%, tôm nước lợ vượt 0,3%); kim ngạch xuất khẩu đạt 90%. Diện tích
ni tơm nước lợ vượt 2,9% [3].
1.2.2 Tổng quan về tôm thẻ chân trắng
Tên khoa học: Litopenaeus vannamei
Tên tiếng anh: White Shrimp
Tên gọi khác: Penaeus
vannamei
Tôm thẻ chân trắng thuộc: Ngành: Arthropoda, Lớp: Malacostraca, Bộ: Decapoda,
Họ: Penaeidae, Chi: Litopenaeus, Lồi: L.vannamei.
Đặc điểm hình thái, sinh thái và tập tính sống của tơm thẻ chân trắng [27].
Tơm thẻ chân trắng có màu trắng đục, trên thân khơng có đốm vằn, chân bị có
màu trắng ngà, chân bơi có màu vàng, các vành chân đi có màu đỏ nhạt và xanh.
Râu tơm có màu đỏ gạch và dài gấp rưỡi lần chiều dài thân, chùy tôm có 8-9 răng cưa
ở gờ phía trên, có 2-4 (đơi khi có 5-6) răng cưa ở phía bụng.
Đây là lồi tơm nhiệt đới, có khả năng thích nghi và có giới hạn rộng về nhiệt
độ và độ mặn. Tơm có khả năng sống được ở dộ mặn 0-45‰, thích hợp từ 7-34‰,
tăng trưởng tốt nhất ở độ mặn 10-20‰. Khả năng thích nghi giới hạn rộng với nhiệt độ
15-33⁰C nhưng nhiệt độ thích hợp nhất cho ni tơm là từ 27-33⁰C.
Trong tự nhiên, tôm thẻ chân trắng sống nơi đáy cát bùn, tôm trưởng thành sống
ở vùng biển ven bờ, tôm con phân bố ở vùng cửa sông - nơi giàu chất dinh dưỡng.
Đặc điểm dinh dưỡng và khả năng tăng trưởng [27].
Tơm thẻ chân trắng là lồi ăn tạp thiên về động vật, phổ thức ăn rộng, khả năng
bắt mồi khỏe, tôm sử dụng được nhiều thức ăn tự nhiên có kích cỡ phù hợp từ bùn bã
hữu cơ đến các động vật, thực vật thủy sinh.
Nhu cầu protein trong khẩu phần thức ăn cho tôm thẻ chân trắng từ 20-35%,
thấp hơn so với các lồi tơm khác cùng họ. Khả năng chuyển hóa thức ăn của tơm rất
cao, trong điều kiện nuôi thâm canh hệ số chuyển đổi thức ăn từ 1,1-1,3.
Tôm thẻ chân trắng lột xác vào ban đêm, thời gian giữa hai lần lột xác từ 1-3
tuần, tơm nhỏ trung bình một tuần lột xác một lần, thời gian giữa hai lần lột xác tăng
dần theo thời gian nuôi, đến giai đoạn lớn (15-20g) trung bình 2,5 tuần lột xác một lần.
Loại này có tốc độ tăng trưởng nhanh trong thời gian 60 ngày nuôi, sau đó mức
tăng trọng giảm dần theo thời gian. Tháng ni đầu tiên, mỗi tuần có thể tăng 3g với
mật độ 100/m2, tới cỡ 30g tôm lớn chậm dần 1g/tuần. Do đó trong q trình ni giai
đoạn đầu cần chú ý tăng lượng thức ăn và đảm bảo thành phần dinh dưỡng đầy đủ
nhằm tận dụng hết khả năng lớn của tôm, rút ngắn thời gian nuôi.
Nhờ đặc tính ăn tạp, bắt mồi khỏe, linh hoạt nên tơm chân trắng trong quần đàn
có khả năng bắt mồi như nhau vì thế tơm ni tăng trưởng khá đồng đều, ít bị phân
đàn.
1.2.3 Thành phần hóa học của tơm
Thành phần hóa học của cơ thịt tơm gồm có: nước, protein, lipid, glucid,
khoáng chất, vitamin, enzyme và hoocmon. Những thành phần có hàm lượng tương
đối nhiều là: nước, protein, lipid và khống chất, hàm lượng glucid trong tơm rất ít và
tồn tại dưới dạng glucogen [12].
Thành phần hóa học của tơm thường khác nhau theo giống lồi. Trong cùng
một lồi nhưng hồn cảnh sinh sống khác nhau thì thành phần hóa học cũng khác
nhau, ngồi ra thành phần hóa học của tơm cịn phụ thuộc vào trạng thái sinh lý, mùa
vụ, thời tiết và nhiều yếu tố khác. Sự khác nhau về thành phần hóa học và sự biến đổi
của chúng làm ảnh hưởng rất lớn đến mùi vị và giá trị dinh dưỡng của sản phẩm, đến
việc bảo quản tươi nguyên liệu và quá trình chế biến [12].
1.2.3.1 Nước
Cơ thịt của tôm chứa khoảng từ 70-85% nước, hàm lượng này phụ thuộc vào
giống lồi tơm và tình trạng dinh dưỡng của tơm [12]. Giai đoạn nhịn đói, thường xảy
ra ở nhiều lồi tơm trong thời gian đẻ trứng, là giảm số năng lượng dự trữ trong mô cơ
và dẫn đến làm gia tăng hàm lượng nước trong cơ thể tơm.
Trong cơ và trong các tế bào, nước đóng một vai trị quan trọng làm dung mơi
cho các chất vô cơ và hữu cơ, tạo ra môi trường cho các hoạt động sinh hóa trong tế
bào, đồng thời nước cũng tham gia vào rất nhiều các phản ứng của các protein. Trạng
thái của nước trong cơ thịt tôm phụ thuộc vào nhiều tương tác giữa cấu trúc của nước
với các dung dịch khác nhau trong tế bào và đặc biệt là với các protein.
Những thay đổi về hàm lượng nước trong thịt tơm, gây ra bởi q trình chế
biến, ảnh hưởng mạnh đến các đặc tính thẩm thấu, giá trị dinh dưỡng, và chất lượng
cảm quan của thịt tôm. Những thay đổi này cũng ảnh hưởng lớn đến thời gian bảo
quản của sản phẩm.
1.2.3.2 Protein
Cơ thịt của tôm thông thường chứa khoảng từ 13-25% protein (Nguyễn Việt
Dũng, 1998). Hàm lượng này biến thiên tùy thuộc vào giống lồi tơm, điều kiện dinh
dưỡng và loại cơ thịt [13].
Có thể chia protein trong mơ cơ của tơm ngun liệu thành 3 nhóm sau:
- Protein cấu trúc (actin, myosin, tropomyosin và actomyosin), chúng chiếm
khoảng 70-80% tổng hàm lượng protein (so với 40% trong các loài động vật có
vú), các protein hịa tan trong các dịch muối trung tính với nồng độ ion khá cao (≥
0,5M).
- Protein tương cơ (myoalbumin, globulin và các enzyme), chúng hòa tan trong
các dung dịch muối trung tính với nồng độ ion thấp (<0,15M). Nhóm này chiếm
25-30% protein.
- Protein mơ liên kết: điểm đẳng điện của protein tôm vào khoảng pH = 4,5-5,5 ở
độ pH này các protein trung tính về điện và kém ưa nước hơn so với trạng thái ion
hóa, điều đó có nghĩa là lực liên kết nước và độ hòa tan ở điểm cực tiểu. Nếu pH
cao hơn hoặc thấp hơn điểm đẳng điện thì độ hịa tan sẽ tăng lên.
Tỷ lệ giữa các loại protein này phụ thuộc và sự phát triển giới tính của tơm và
chúng giao động trong suốt chu kỳ sinh trưởng [12].
1.2.3.3 Lipid
Mô cơ của tôm chứa khoảng từ 0,05-0,3% lipid, mà thành phần chủ yếu là các
phospholipid [12].
Phosphatidyl chlorin và cholesterol là loại photpholipid và loại lipid trung tính
chiếm tỷ trọng khá lớn trong mô cơ thịt tôm [12]. Trong thành phần của các acid béo
các sphigomyelin chiếm tỷ lệ lớn nhất trong các acid béo bão hòa. Nhiều nghiên cứu
về thành phần lipid của tôm tập trung vào hàm lượng cholesterol [13] và hàm lượng
acid béo tổng số cho thấy rằng sự khác nhau về giống loài ảnh hưởng rất nhỏ đến
thành phần các acid béo và hàm lượng cholesterol. Tuy vậy hàm lượng của các acid
béo và cholesterol trong thịt tôm lại chịu ảnh hưởng của sự thay đổi mùa vụ, nhiệt độ
môi trường nước sinh sống, điều kiện dinh dưỡng và thời kỳ phát triển của tôm [12].
1.2.3.4 Vitamin
Hàm lượng vitamin trong tơm có đặc trưng theo lồi và sau đó là biến thiên
theo mùa vụ [12]. Hàm lượng một số vitamin trong thịt tơm được trình bày trên Bảng
1.1. Nhìn chung thịt tơm là nguồn thực phẩm khá giàu vitamin.
Bảng 1.1 : Hàm lượng một số vitamin trong thịt tơm [12]
Vitamin
Đơn vị tính
Hàm lượng
Khoảng biến thiên
Thiamin
(μg/100g)
41
10-143
Riboflavin
(μg/100g)
76
13-190
Niacin
(mg/100g)
2,7
0,7-4,9
Pyridoxine
(μg/100g)
66
16-125
Acid pantothenic
(μg/100g)
278
165-372
Biotin
(μg/100g)
1,0
-
Acid folic
(μg/100g
5,2
3,0-7,1
Cobalamine
(μg/100g)
3,8
0,9-8,1
Acid ascorbic
(mg/100g)
1,5
0-3,0
1.2.3.5 Chất khống
Tơm là loại thực phẩm rất giàu chất khống. Hàm lượng chất khống có trong
thịt tơm biến thiên trong khoảng từ 0,6-1,5% khối lượng tươi. Hàm lượng chất khống
có trong thịt tơm có đặc trưng theo loài và biến thiên theo mùa, đồng thời hàm lượng
chất khống cịn phụ thuộc rất lớn vào điều kiện mơi trường sống của tôm [12].
1.2.4 Biến đổi của tôm sau khi chết
Tôm nguyên liệu sau khi chết dưới tác dụng của các enzyme nội tại và hoạt
động của các vi sinh vật trong cơ thịt tôm xảy ra hàng loạt những biến đổi phức tạp
đặc biệt là những biến đổi sâu sắc về mặt hóa học đó là các quá trình tự phân giải,
phân hủy tự nhiên làm cho nguyên liệu bị biến chất hồn tồn khơng sử dụng được
nữa. Sự biến đổi của cơ thịt tôm nguyên liệu sau khi chết gồm các quá trình cơ bản
sau:
-
Sự tiết nhớt ra ngoài cơ thể
-
Sự phân giải glycogen (glycolysis)
-
Sự tê cứng của cơ thịt (rigor mortis)
-
Sự mềm hóa trở lại
-
Tác dụng tự phân giải (autolysis)
-
Sự thối rữa (putrefaction)
Những biến đổi trên đây không phải tuân theo một thứ tự nhất định mà chúng
thường gối lên nhau. Các quá trình biến đổi đó hoặc là song song hoặc là cuối quá
trình này đã bắt đầu quá trình khác nối tiếp nhau. Các q trình biến đổi đó có thể tóm
tắt theo sơ đồ Hình 1.1 [12].
Hình 1.1: Q trình biến đổi của tôm sau khi chết
1.2.4.1 Các biến đổi về cảm quan
Biến đổi cảm quan là những biến đổi được nhận biết nhờ các giác quan như bề
ngoài, mùi, vị, cấu trúc. Khi thủy sản vừa chết thì cơ thịt mềm mại đàn hồi tốt, sau một
thời gian chuyển sang trạng thái cứng. Khi ở giai đoạn tê cứng, các sợi cơ co rút cực
độ. Khi hết giai đoạn này, cơ hết cứng, cơ sẽ duỗi ra và trở lên mềm mại nhưng khơng
cịn đàn hồi như trước khi tê cứng, cơ thịt chuyển sang giai đoạn mềm hóa, lúc này
chúng dễ bị biến dạng, thân mềm nhão, hư hỏng. Thời điểm xuất hiện và thời gian tê
cứng phụ thuộc tùy vào giống loài và chịu ảnh hưởng của các yếu tố như nhiệt độ bảo
quản, quá trình xử lý thu hoạch, đánh bắt, kích cỡ, tình trạng cơ thể trước khi chết
[11].
1.2.4.2 Biến đổi do vi sinh vật
Thủy sản sau khi chết quá trình sinh tổng hợp trong cơ thể sẽ dừng lại, enzyme
trong cơ thịt sẽ tiến hành quá trình tự phân giải, đồng thời lúc đó vi sinh vật sẽ phân
hủy những sản phẩm của quá trình tự phân giải thành sản phẩm cấp thấp, làm cho
nguyên liệu biến chất hư hỏng đó chính là hiện tượng thối rữa. Vi sinh vật chính là
nguyên nhân chính gây thối rữa ngun liệu và cơ chất chính của q trình thối rữa là
protein. Muốn phân giải được protein, trước tiên vi sinh vật phải tiết ra các enzyme
phân giải protein ngoại bào và thủy phân protein thành các hợp chất có phân tử nhỏ
hơn (các polypeptit và oligopeptit). Các chất này hoặc tiếp tục được phân hủy thành
amino acid nhờ các peptidase ngoại bào hoặc xâm nhập ngay vào tế bào vi sinh vật sau
đó mới chuyển thành amino acid. Một phần các amino acid này được vi sinh vật sử
dụng trong quá trình tổng hợp protein của chúng, một phần khác được tiếp tục phân
giải theo những con đường khác để sinh NH 3, CO2 và nhiều sản phẩm trung gian khác.
Sau khi tôm chết, gặp điều kiện thuận lợi thì các vi sinh vật phát triển rất nhanh. Vi
sinh vật gây thối rữa có hai nhóm, một nhóm là những vi sinh vật tồn tại trong nguyên
liệu trong quá trình sống, cịn một nhóm là do ơ nhiễm trong quá trình bảo quản và chế
biến. Đối với quá trình gây thối rữa của ngun liệu khơng phải các lồi vi sinh vật
đều tác dụng như nhau mà trong đó họ Pseudomonas là tích cực nhất cịn các lồi khác
thì phát triển ít và một số thì giảm đi. Tơm sau khi chết nếu khơng kịp thời bảo quản
thì số lượng vi sinh vật tăng lên rất nhanh đặc biệt là ở phạm vi nhiệt độ thích hợp [4].
1.2.4.3 Biến đổi hóa học
Sự phân giải glycogen
Tơm sau khi chết, glycogen trong cơ thể dần dần bị phân giải. Đây là một q
trình yếm khí rất phức tạp xảy ra bằng con đường phosphorin hóa với sự tham gia của
Adenosintriphosphat (ATP) và được biểu thị một cách đơn giản như sau:
(C6H10O5)n + n H2O
Glycogen
2n C3H6O2
Acid lactic
Glycogen phân giải sản sinh ra các acid lactic làm cho pH của cơ thịt thay đổi.
Sự acid hóa mơi trường này có tác dụng hạn chế phần nào sự phát triển của vi sinh vật
gây thối rữa. Những biến đổi của các chất đường và đường chứa phospho trong mô cơ
làm mất dần vị ngọt và hương vị đặc trưng của tôm tươi.
Sự biến đổi của Adenosintriphosphat (ATP)
ATP là hợp chất quan trọng tham gia tải năng lượng tự do trong quá trình oxy
hóa các chất trao đổi. Những bước đầu tiên của q trình phân hủy ATP trong mơ cơ
thịt tơm xảy ra rất nhanh và nhờ tác dụng của enzyme nội tại. Q trình biến đổi của
ATP được tóm tắt bằng sơ đồ Hình 1.3.
Adenosintriphosphat (ATP)
Adenosidiphosphat (ADP)
Adenosinmonophosphat (AMP)
Inosinmonophosphat (IMP)
Inosin (HxR)
Hipoxanthin (Hx)
Hình 1.2: Quá trình biến đổi của ATP
Hàm lượng IMP trong cơ thịt giảm dần cũng đồng thời với sự mất dần mùi
thơm đặc trưng của tôm tươi. Tốc độ của quá trình phân hủy ATP phụ thuộc nhiều vào
giống lồi tơm, vị trí cơ thịt trên cơ thể tơm và q trình đánh bắt, xử lý và bảo quản
tơm.
Sự phân giải phân hủy acid amin
Trong quá trình tự phân giải enzyme trong tổ chức cơ thịt phân giải protein
thành acid amin, tiến thêm bước nữa là vi sinh vật phân hủy các aicd amin thành các
sản phẩm cấp thấp làm cho tơm thối rữa. Trong q trình thối rữa chủ yếu phân hủy
acid amin thành các sản phẩm cấp thấp như indol, skatol, phenol, putrescin, các loại
acid có đạm, acid béo cấp thấp, H2S, thioancol, CH4, NH3, CO2 ... Có thể quy về 5 loại
phân giải acid amin: phản ứng làm mất gốc amin, phản ứng làm mất gốc cacboxyl, tác
dụng cùng làm mất gốc cacboxyl và amin, phân giải các phân tử amin và phân giải các
chất có đạm khác [4, 11].
1.2.4.4 Biến đổi enzyme
Tơm sau khi tê cứng dần dần trở lại mềm, ta gọi đó là sự tự phân giải. Quá trình
này do các loại enzyme nội tại trong tôm hoạt động phân giải. Khi tơm cịn sống do sự
tồn tại của kháng thể, cho nên các loại enzyme thủy phân không hoạt động tự phân giải
tổ chức của mình, nhưng khi tơm đã chết kháng thế này mất đi nên hoạt động của
enzyme sẽ trở nên dễ dàng. Trong q trình này có nhiều loại enzyme tham gia nhưng
chủ yếu là enzyme cathepsin phân giải protein thành peptone, enzyme tripsin và
enterokinaza tiếp tục phân giải các sản phẩm trung gian thành acid amin. Sự tự phân
giải là do enzyme nội tại gây ra, còn sự thối rữa là do vi sinh vật ở bên ngoài xâm nhập
vào hoạt động, sản phẩm cuối cùng của q trình tự phân giải là acid amin, các đạm
hịa tan, cịn q trình thối rữa là sản phẩm cấp thấp thối nát. Nếu khơng có q trình
thối rữa thì q trình tự phân giải sẽ khơng tăng lên một cách vô hạn mà sẽ đạt tới
trạng thái cân bằng ở mức độ sản phẩm nào đó [4].
Trong q trình tự phân giải chủ yếu là sự tự phân giải protein nhưng chất béo
cũng có sự biến đổi. Phân giải chất béo chủ yếu là do enzyme lipase và xảy ra song
song với quá trình phân giải protein. Quá trình tự phân giải tuy làm tôm chuyển từ
cứng sang mềm nhưng vẫn cịn tươi tốt.
Q trình tự phân giải phụ thuộc vào rất nhiều yếu tố, như giống lồi, mơi
trường pH, các loại muối, ảnh hưởng của nhiệt độ. Sự khác nhau về giống loài dẫn đến
sự hoạt động của enzyme là khác nhau. Tác động tự phân giải ở động vật máu lạnh
nhanh hơn lồi máu nóng, vì enzyme trong động vật máu lạnh mạnh hơn của lồi máu
nóng. Cịn nếu tăng độ acid của mơi trường tức là giảm pH thì tác dụng tự phân giải
tăng lên nhưng pH giảm đến một mức độ nhất định làm enzyme khơng hoạt động được
nữa thì tác dụng tự phân giải lại giảm, ngược lại pH càng tăng thì tác dụng tự phân giải
càng giảm. Muối ăn cũng làm cản trở tác dụng tự phân giải, nồng độ muối ăn càng cao
cản trở càng lớn, nhưng không làm ngừng được quá trình tự phân giải. Ở dung dịch
nước muối bão hịa, q trình tự phân giải vẫn xảy ra nhưng rất chậm... nhiệt độ cũng
ảnh hưởng rất nhiều đến quá trình tê cứng, phân giải cũng như thối rữa sau này. Trong
phạm vi nhiệt độ thích hợp thì cứ tăng 10⁰C thì tốc độ phân giải tăng 2-3 lần. Khi nhiệt
độ giảm thì tốc độ tự phân giải sẽ giảm, nhưng khi nhiệt độ vượt quá nhiệt độ thích
hợp thì tốc độ phân giải cũng giảm, do nhiệt độ quá cao hay quá thấp đều làm giảm sự
hoạt động của enyme. Nhiệt độ thích hợp của enzyme ở từng loài khác nhau là khác
nhau [4].
1.3 Tổng quan về enzyme tyrosinase và hiện tượng biến đen ở tôm
1.3.1 Tyrosinase
Tyrosinase (EC 1.14.18.1) là enzyme thuộc nhóm polyphenol oxydase, là
một phân tử quan trọng tham gia vào quá trình hình thành các sắc tố melanin.
Enzym chủ yếu tham gia vào hai phản ứng khác nhau của tổng hợp melanin. Một là
hydroxy hóa monophenol thành o-diphenol, hai là oxy hóa o- diphenol thành
dopaquinone [18]. Sau đó dopaquinone tham gia một loạt các phản ứng để tạo thành
melanin.
Tyrosinase là một monooxygenase có chứa Cu được phân bố rộng rãi trong các
vi sinh vật, động vật và thực vật [43]. Tyrosinase chịu trách nhiệm cho quá trình sinh
tổng hợp melanin quyết định màu sắc của da. Tích lũy melanin quá mức sẽ gây ra các
rối loạn về da khác nhau bao gồm nám và các đốm đồi mồi. Tyrosinase cũng chịu trách
nhiệm cho các phản ứng hóa nâu enzyme trong trái cây và rau quả trong q trình lão
hóa hoặc chịu thiệt hại tại thời điểm xử lý sau thu hoạch [54].
Enzyme này có mặt trong tơm và một số lồi rau quả nó đóng vai trị quan trọng
trong hình thành sắc tố. Enzyme tyrosinase tồn tại ở 3 dạng: oxy, deoxy, met-tyrosine.
Cả dạng met-tyrosinase và dạng oxy- tyrosinase đều có hoạt tính diphenolase. Trong
khi chỉ có ở dạng oxy- tyrosinase là có hoạt tính monophenolase.
Sự ức chế tyrosinase được mong muốn vì tyrosinase xúc tác q trình oxy
hóa các hợp chất phenolic có trong trái cây và rau quả thành quinone , mang lại
hương vị và màu sắc không mong muốn và cũng làm giảm khả năng tiêu hóa của
một số axit amin thiết yếu cũng như khả năng tiêu hóa của sản phẩm. Như vậy, các
chất ức chế tyrosinase có hiệu quả cao cũng cần thiết trong nông nghiệp và công
nghiệp thực phẩm. Các chất ức chế tyrosinase bao gồm axit kojic, tropolone,
coumarin , axit vanillic, vanillin và rượu vanillic [44].
1.3.2 Hiện tượng biến đen ở tôm
Trong cơ thể tôm tồn tại rất nhiều hệ enzyme khác nhau. Khi tơm cịn sống, các
hệ enzyme này có tác dụng tham gia vào quá trình kiến tạo nên các tổ chức trong cơ
thể tơm, giúp tiêu hóa thức ăn và sự co giãn cơ. Khi tôm chết, các hệ enzyme vẫn tiếp
tục hoạt động và tham gia vào quá trình phân giải các hợp chất quan trọng trong cơ thể
tôm như phân giải adenosintriphotphat, glycogen, creatinphotphat...đặc biệt là sự hoạt
động của hệ enzyme tiêu hóa sẽ làm phân giải tổ chức cơ thịt tơm. Đây chính là
ngun nhân làm cho cơ thịt tơm bị mềm và tôm bị giảm chất lượng. Sản phẩm phân
giải của các hệ enzyme là nguồn dinh dưỡng tốt cho vi sinh vật. Do vậy, sự hoạt động
của các hệ enzyme trong tơm sẽ góp phần làm tăng nhanh tốc độ ươn hỏng xảy ra ở
tôm [1].
Biến đen là hiện tượng hư hỏng phổ biến ở tôm nguyên liệu sau vài giờ đánh
bắt lên bờ. Nếu không được xử lý bảo quản tốt tôm sẽ dẫn đến hiện tượng biến đen rõ
rệt. Đầu tiên là các vết đen xuất hiện ở vùng mang và các đốt chân, ban đầu là các
chấm màu nâu nhạt dần chuyển sang các vệt màu nâu đen. Sau đó các vệt đen phát
triển thành từng mảng theo hướng từ đầu đến đuôi con tôm, đặc biệt rõ nhất là hai bên
mang tơm [12].
Ở tơm có enzyme polypenoloxidase, enzyme này đóng vai trị quan trọng trong
q trình thay vỏ của tơm nhưng khi tơm chết nó lại gây ra sự biến đen ở tôm. Hiện
tượng biến đen sẽ làm giảm giá trị của tôm do không đáp ứng tiêu chuẩn để chế biến
các sản phẩm xuất khẩu [1].
Cơ chế của sự biến đen ở tơm Hình 1.3: