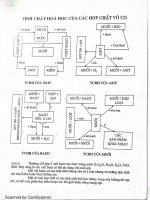
Tính chất của kim loại, dãy hoạt động hóa
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (163.4 KB, 7 trang )
Khoa học tự nhiên 9 tập 1 bài 1: Tính chất của kim loại, dãy hoạt động hóa
học của kim loại
Soạn Khoa học tự nhiên 9 bài 1
Khoa học tự nhiên 9 bài 1: Tính chất của kim loại, dãy hoạt động hóa học của kim
loại
Khoa học tự nhiên 9 tập 1 bài 1: Tính chất của kim loại, dãy hoạt động hóa học của kim loại được VnDoc sưu tầm và
đăng tải. Hy vọng sẽ giúp ích cho các bạn học sinh ôn tập cũng như soạn bài trước khi đến lớp tốt hơn. Mời các bạn
cùng tham khảo
Giải bài tập trang 19 SGK Hóa lớp 9: Một số axit quan trọng
Giải bài tập trang 14 SGK Hóa lớp 9: Tính chất hóa học của axit
Lý thuyết Hóa học lớp 9 bài 4
Lý thuyết Hóa học lớp 9 Vơ cơ
A. Hoạt động khởi động
Hãy nêu một số tính chất vật lí và tính chất hóa học của kim loại mà em biết, đồng thời đề xuất phương án thí nghiệm để kiểm
chứng các tính chất đó.
Bài làm:
* Tính chất vật lí
Tính dẻo: dùng búa đập một đoạn dây nhơm, đồng; dùng tay uốn cong một đoạn dây đồng
Tính dẫn nhiệt: đun nồi nước,
Tính ánh kim: quan sát các kim loại thấy trên bề mặt sáng lấp lánh
Tính dẫn điện:
* Tính chất hóa học:
Tác dụng với oxi ở nhiệt độ thường hoặc nhiệt độ cao: gỉ sắt
Tác dụng với axit: Cho nhơm tác dụng với axi HCl, nhơm tan, có khí bay ra
Tác dụng với dung dịch muối: cho nhơm tác dụng với CuSO4, nhơm tan có kết tủa mà đỏ
B. Hoạt động hình thành kiến thức
I. Tính chất vật lí của kim loại
Tiến hành thí nghiệm và ghi kết quả theo bảng sau:
STT Tên thí nghiệm
Hiện
tượng
Cách tiến hành
Dùng búa đập một đoạn dây đồng/nhơm
1
Nghiên cứu tính dẻo của
kim loại
2
Nghiên cứu ánh kim của Dùng giấy ráp đánh sạch một phần lá nhôm/đồng. Quan sát chỗ kim loại đã được
kim loại
đánh sạch bằng giấy ráp.
Dùng tay uốn cong một đoạn dây đồng/ sắt mảnh
Qua các thí nghiệm, em có thể kiểm chứng được tính chất vật lí nào của kim loại ?
Bài làm:
STT Tên thí nghiệm
Cách tiến hành
Hiện tượng
Đoạn dây đồng/nhôm
Dùng búa đập một đoạn dây đồng/nhôm
1
2
Nghiên cứu tính dẻo
của kim loại
Dùng tay uốn cong một đoạn dây đồng/ sắt mảnh
bị dát mỏng
Đoạn dây đồng/sắt
mảnh bị uốn cong
Nghiên cứu ánh kim Dùng giấy ráp đánh sạch một phần lá nhôm/đồng. Quan sát chỗ kim
của kim loại
loại đã được đánh sạch bằng giấy ráp.
Trên bề mặt có ánh sáng
lấp lánh
Qua các thí nghiệm trên ta kiểm chứng được tính dẻo, tính ánh kim của kim loại.
Câu hỏi:
1. Kim loại có các tính chất vật lí nào?
2. Dựa vào các tính chất vật lí khác nhau của kim loại, em hãy nêu ứng dụng của một số kim loại trong đời sống và sản xuất.
Bài làm:
1. Tính chất vật lí của kim loại:
Tính dẻo
Tính dẫn nhiệt
Tính dẫn điện
Tính ánh kim
2. Ứng dụng của kim loại:
Làm dây dẫn điện
Làm các đồ dùng nấu ăn: xoong, nồi,...
Làm đồ trang sức, các vận dụng trang trí
Nhơm là vật liệu dùng để chế tạo vỏ máy bay
II. Tính chất hóa học của kim loại
Tiến hành thí nghiệm ghi kết quả theo bảng sau:
Bài làm:
TT Tên thí nghiệm
Phản ứng của kim loại với phi kim
Hiện tượng - giải thích
Thanh sắt cháy sáng sau khi cháy thanh sắt xuất hiện gỉ màu nâu
a, Phản ứng của kim loại với oxi
3Fe+2O2→Fe3O4
1
Natri nóng chảy cháy trong khí clo với ngọn lửa sáng chói, tạo ra natri clorua
b, Phản ứng của kim loại với phi kim khác
2Na+Cl2→2NaCl
Kim loại tan dần có khí bay ra
2
Phản ứng của kim loại với dung dịch axit
Zn+2HCl→ZnCl2+H2
Đồng tan dần, có kết tủa trắng
Cu+2AgNO3→Cu(NO3)2+2Ag
3
Phản ứng của kim loại với dung dịch muối
Kẽm tan dần, có kết tủa đỏ
Zn+CuSO4→ZnSO4+Cu
Đọc thơng tin và trả lời câu hỏi (SGK KHTN 9 tập 1 trang 5)
Nêu tính chất hóa học của kim loại, mỗi tính chất viết một phương trình hóa học để minh họa.
Bài làm:
Phản ứng của kim loại với phi kim:
Tác dụng với oxi: 2Cu+O2→2CuO
Tác dụng với phi kim khác: 4Fe+3O2→2Fe2O3
Phản ứng của kim loại với dd axit: 2Al+6HCl→2AlCl3+3H2
Phản ứng của kim loại với dd muối: Zn+CuSO4→ZnSO4+Cu
Tiến hành các thí nghiệm ghi kết quả vào bảng
III. Dãy hoạt động hóa học của kim loại
1. Dãy hoạt động hóa học của kim loại được xây dựng như thế nào?
Tiến hành các thí nghiệm và ghi kết quả vào bảng
Bài làm:
*Thí nghiệm 1:
Ống nghiệm 1: kẽm tan ra, dd CuSO4 nhạt màu, có kết tủa màu đỏ
Zn+CuSO4→ZnSO4+Cu
Ống nghiệm 2: khơng hiện tương bởi vì Cu khơng tác dụng với ZnSO4
*Thí nghiệm 2:
Ống nghiệm 1: Cu tan ra, xuất hiện kết tủa trắng
Cu+2AgNO3→Cu(NO3)2+2Ag
Ống nghiệm 2: khơng hiện tượng vì Ag khơng tác dụng với CuSO4
*Thí nghiệm 3:
Ống nghiệm 1: Zn tan ra, có khí xuất hiện
Zn+2HCl→ZnCl2 + H2
Ống nghiệm 2: khơng hiện tượng vì Cu khơng tác dụng với HCl
*Thí nghiệm 4:
Ống nghiệm 1: Mẩu Na tan, có khí thốt ra, cốc chuyển sang màu hồng
2Na+2H2O→2NaOH+H2
NaOH làm Phenolphtalein chuyển sang màu hồng
Ống nghiệm 2: khơng hiện tượng
Từ thí nghiệm 1, hãy so sánh mức độ hoạt động hóa học của Zn và Cu. Từ thí nghiệm 2, hãy so sánh mực độ hoạt động hóa học
của Cu và Ag
Câu hỏi:
Từ thí nghiệm 1, hãy so sánh mức độ hoạt động hóa học của Zn và Cu.
Từ thí nghiệm 2, hãy so sánh mức độ hoạt động hóa học của Cu và Ag
Từ thí nghiệm 3, hãy so sánh mức độ hoạt động hóa học của Zn, H và Cu
Từ thí nghiệm 4, hãy so sánh mức độ hoạt động hóa học của Na và Zn
Từ đó, hãy sắp xếp theo chiều giảm dần mức độ hoạt động hóa học của Cu, Ag, Na, Zn, H
Bài làm:
Mức độ hoạt động hóa học của Zn > Cu
Mức độ hoặt động hóa học của Cu > Ag
Mức độ hoạt động hóa học của Zn > H > Cu
Mức độ hoạt động hóa học của Na > Zn
Vậy sắp xếp theo chiều giảm dần mức độ hoạt động hóa học: Na, Zn, H, Cu, Ag
Kim loại Al có tác dụng được với dung dịch CuSO4 khơng? Vì sao? Kim loại Ag có tác dụng được với dung dịch H2SO4 lỗng
khơng? Vì sao?
2. Dãy hoạt động hóa học của kim loại có ý nghĩa như thế nào?
Đọc thong tin và trả lười câu hỏi (SGK KHTN 9 tập 1 trang 7)
1. Kim loại Al có tác dụng được với dung dịch CuSO4 khơng? Vì sao?
2. Kim loại Ag có tác dụng được với dung dịch H2SO4 lỗng khơng? Vì sao?
Bài làm:
1. Kim loại Al có tác dụng được với dung dịch CuSO4. Bởi vì Al đứng trước Cu trong dãy hoạt động hóa học nên Al hoạt động
hóa học mạnh hơn Cu nên đẩy Cu ra khỏi muối.
2Al+3CuSO4→Al2(SO4)3+3Cu
2. Kim loại Ag khơng tác dụng với H2SO4 lỗng. Vì Ag đứng sau H trong dãy hoạt động hóa học, nên Ag hoạt động hóa học
kém H. Vì thế Ag không tác dụng với H2SO4.
Kim loại dẫn điện tốt nhất là? Hãy chọn từ/cụm từ thích hợp cho trong ngoặc đơn (bền; nhẹ; dây điện; đồ trang sức; nhôm; ánh
kim) điền vào chỗ trống:
C. Hoạt động luyện tập
1. Kim loại dẫn điện tốt nhất là:
A. Cu B. Al C. Au D. Ag
2.Hãy chọn từ/cụm từ thích hợp cho trong ngoặc đơn (bền; nhẹ; dây điện; đồ trang sức; nhôm; ánh kim) điền vào chỗ trống trong
các câu sau:
a, Đồng và nhôm được dùng làm .......................... là do dẫn điện tốt.
b, ....................... được dùng làm đồ dùng đun nấu (ấm, nồi...) là do bền trong khơng khí và dẫn nhiệt tốt.
c, Vàng, bạc được dùng làm .................... vì bền trong khơng khí và có .................. rất đẹp.
d, Nhơm được dùng làm vật liệu chế tạo vỏ máy bay do ............ và .................
Bài làm:
1. D
2. a, Đồng và nhôm được dùng làm dây điện là do dẫn điện tốt.
b, Nhôm được dùng làm đồ dùng đun nấu (ấm, nồi...) là do bền trong khơng khí và dẫn nhiệt tốt.
c, Vàng, bạc được dùng làm đồ trang sức vì bền trong khơng khí và có ánh kim rất đẹp.
d, Nhơm được dùng làm vật liệu chế tạo vỏ máy bay do bền và nhẹ.
Viết các PTHH theo các sơ đồ phản ứng sau đây (ghi rõ điều kiện nếu có)
3. Viết PTHH theo sơ đồ phản ứng sau đây (ghi rõ điều kiện nếu có)
a, ..........+..........
MgO
b, ..........+...........
FeS
c, Al+HCl→..........+..........
d, ..........+..........→FeSO4+Cu
e, K+H2O→..........+..........
Bài làm:
a, 2Mg+O2
b, Fe+S
2MgO
FeS
c, 2Al+6HCl→2AlCl3+3H2
d, Fe+CuSO4→FeSO4+Cu
e, 2K+2H2O→2KOH+H2
Viết PTHH của các phản ứng xảy ra (nếu có) khi lần lượt cho các kim loại: Zn, Al, Cu tác dụng với: O2; Cl2; dd H2SO4 loãng; dd
FeSO4.
4. Viết PTHH của các phản ứng xảy ra (nếu có) khi lần lượt cho các kim loại: Zn, Al, Cu tác dụng với: O2; Cl2; dd H2SO4 loãng;
dd FeSO4.
Bài làm:
a, O2
2Zn+O2
2ZnO
4Al+3O2
2Al2O3
2Cu+O2
2CuO
b, Cl2
Zn+Cl2
2Al+3Cl2
Cu+Cl2
ZnCl2
2AlCl3
CuCl2
c, Dung dịch H2SO4 loãng
Zn+H2SO4→ZnSO4+H2
2Al+3H2SO4→Al2(SO4)3+3H2
d, Dung dịch FeSO4
Zn+FeSO4→ZnSO4+Fe
2Al+3FeSO4→Al2(SO4)3+3Fe
Hãy giải thích tại sao các kim loại K, Na, Ca,... khi tác dụng với dung dịch muối lại không đẩy các kim loại đứng sau chúng ra
khỏi dung dịch muối?
5. Hãy giải thích tại sao các kim loại K, Na, Ca,... khi tác dụng với dung dịch muối lại không đẩy các kim loại đứng sau chúng ra
khỏi dung dịch muối?
Bài làm:
Bởi vì các kim loại này hoạt động rất mạnh. Khi tác dụng với dung dịch muối thì nó sẽ tác dụng với nước trước tạo thành Bazơ.
Như vậy phương trình hóa học chuyển thành bazo + muối → bazo mới + muối mới. Vì thế phản ứng không tạo ra kim loại.
Ngâm một lá kẽm trong 40 gam dung dịch CuSO4 10% cho đến khi kẽm khơng tan được nữa. Tính khối lượng kẽm đã phản
ứng với dd CuSO4 và nồng độ phần trăm của dung dịch sau phản ứng
6. Ngâm một lá kẽm trong 40 gam dung dịch CuSO4 10% cho đến khi kẽm khơng tan được nữa. Tính khối lượng kẽm đã phản
ứng với dd CuSO4 và nồng độ phần trăm của dung dịch sau phản ứng.
Bài làm:
Khối lượng Zn đã phản ứng là:
mZn = 0,025 . 65 = 1,625 (g)
Khối lượng dung dịch sau phản ứng là:
Nồng độ phần trăm của dung dịch sau phản ứng là:
7. Một hỗn hợp X ở dạng bột gồm Cu và Zn. Để xác định phần trăm khối lượng của mỗi kim loại trong X, người ta lấy 5,25 gam
X cho tác dụng với dung dịch H2SO4 lỗng dư thấy có 1,12 lít khí thốt ra (đktc). Viết PTHH của phản ứng xảy ra và tính phần
trăm khối lượng của mỗi kim loại trong hỗn hợp X ban đầu.
Bài làm:
D. Hoạt động vận dụng
1. Hãy kể tên các kim loại được dùng làm vật liệu để chế tạo các vận dụng trong gia đình em và một số vật dụng trong đời sống,
sản xuất. Tại sao chúng được sử dụng để làm các vật dụng đó?
Bài làm:
sắt: quốc, xẻng...Vì sắt rất cứng, và bền
nhơm: xoong, nồi, mâm...Vì nhơm bền trong khơng khí, dẫn nhiệt tốt
đồng: kèn...Vì đồng dễ gia công, chế tạo
2. Cần phải lưu ý gì khi cắm phích điện vào ổ điện hoặc khi thấy dây dẫn điện của các vận dụng bị hở lớp lõi kim loại phía trong?
Bài làm:
Sử dụng ổ cắm phích cắm điện phải ln đảm bảo khơ ráo.
Động tác cắm hoặc rút phích cắm cần phải rứt khốt. Đảm bảo các ổ cắm không bị phát sinh tia lửa điện khi cắm hoặc rút
phích điện khỏi ổ cắm, giảm nguy cơ cháy nổ.
Khơng nên để đầu phích cắm lỏng lẻo, bởi làm vậy sẽ dễ sinh ra tia lửa điện gây chập cháy
Vị trí đặt ổ cắm, cơng tắc điện nên đặt ở nơi cách xa nguồn nước, dễ quan sát và thuận tiện thao tác. Bảng điện và ổ cắm
phải được cố định chắc chắn vào tường và cách điện tốt, sử dụng an tồn.
Khơng dùng nhiều thiết bị có cơng suất cao chung một lỗ cắm dễ gây ra cháy ổ điện.
Không dùng nước để dập tắt lửa khi thấy ổ cắm bị chập cháy, mà khi đó nên bình tĩnh ngắt cầu dao nguồn điện.
Khơng nắm dây của phích điện để rút ra khỏi ổ cắm vì sẽ dễ làm đứt dây điện và làm hỏng đầu phích điện.
Dây điện vào ổ cắm, phích cắm phải được kiểm tra thường xuyên để phát hiện hư hỏng.
Khi thấy dây dẫn điện của các vật dụng bị hở lớp lõi kim loại phía trong thì tốt nhất là nên mua dây mới về thay cho an toàn.
E. Hoạt động tìm tịi mở rộng
Hãy tìm hiểu qua tài liệu, internet,... và cho biết kim loại nào được dùng làm dây tóc của bóng đèn sợi đốt. Tại sao?
Tại sao ngày nay người ta lại ít sử dụng bóng đèn sợi đốt mà chủ yếu dùng bóng đèn huỳnh quang?
Bài làm:
Kim loại được dùng để làm dây tóc bóng đèn là vonfram bởi vì nó có nhiệt độ nóng chảy cao 3370oC nhiệt độ này cao hơn nhiệt
độ lúc đèn sáng bình thường (2500oC)
Ngày nay người ta ít sử dụng bóng đèn sợi đốt mà chủ yếu dùng bóng đèn huỳnh quang bởi vì:
Hiệu suất phát quang lớn, gấp khoảng 5 lần so với đèn sợi đốt.
Tuổi thọ khoảng 8000 giờ, lớn hơn đèn sợi đốt nhiều lần.
Đèn sợi đốt có hiệu suất điện quang thấp chỉ có 4-5% biến đổi thành quang năng 95-96% tỏa nhiệt
Soạn bài 1: Tính chất của kim loại, dãy hoạt động hóa học của kim loại - sách VNEN khoa học tự nhiên 9 tập 1 bài 1 trang 3.
Phần trên đây sẽ hướng dẫn trả lời và giải đáp các câu hỏi trong bài học, cách làm chi tiết, dễ hiểu, hi vọng các bạn học sinh
nắm tốt kiến thức bài học
............................................
Như vậy VnDoc đã giới thiệu các bạn tài liệu Khoa học tự nhiên 9 tập 1 bài 1: Tính chất của kim loại, dãy hoạt động hóa học của
kim loại. Mời các bạn tham khảo thêm tài liệu: Hóa học lớp 9, Giải bài tập Hóa học 9, Giải sách bài tập Hóa 9, Tài liệu học tập
lớp 9, ngồi ra các bạn học sinh có thể tham khảo thêm đề học kì 1 lớp 9 và đề thi học kì 2 lớp 9 mới nhất được cập nhật.