Luận văn : BƯỚC ĐẦU XÂY DỰNG QUY TRÌNH ĐỊNH LƯỢNG CÁC SẢN PHẨM BIẾN ĐỔI GEN BẰNG PHƯƠNG PHÁP REAL-TIME PCR part 4 potx
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (642.46 KB, 13 trang )
26
thường không gây trở ngại cho việc khuếch đại DNA. Có nhiều cách khác nhau, tuy
nhiên ta sẽ tìm hiểu một phương pháp khá đơn giản. Đó là mẫu dò Taqman.
Hình 2.14: Cơ chế hoạt động của mẫu dò Taqman [43]
Phương pháp Taqman dựa trên khả năng 5‟-3‟ exonuclease của Taq DNA
Polymerase để cắt đứt một mẫu dò trong phản ứng PCR. Taqman thông thường là một
chuỗi oligonucleotide dài khoảng 20-30 base (thường nó có nhiệt độ nóng chảy cao
hơn 10
o
C so với nhiệt độ nóng chảy của mồi) có gắn thuốc nhuộm phát huỳnh quang ở
đầu 5‟ và một thuốc nhuộm hấp thu ở đầu 3‟. Do đầu 3‟ bị khóa, mẫu dò không thể
được kéo dài như một mồi. Trong phản ứng PCR, với sự hiện diện của gen đích, mẫu
dò liên kết đặc hiệu ở giữa hai mồi xuôi và ngược. Khi mẫu dò còn nguyên vẹn, thuốc
nhuộm hấp thu ở gần thuốc nhuộm phát huỳnh quang làm cho tín hiệu huỳnh quang bị
triệt tiêu chủ yếu do hiệu ứng chuyển năng lượng kiểu Forster. Khi phản ứng PCR xảy
ra, hoạt động 5‟-3‟ exonuclease của Taq DNA Polymerase sẽ phá hủy trình tự mẫu dò
khi và chỉ khi mẫu dò này liên kết với gen đích. Lúc này, thuốc nhuộm phát huỳnh
quang sẽ cách xa thuốc nhuộm hấp thu và chúng sẽ phát quang. Vì vậy, lượng DNA
được tích lũy sẽ được phát hiện qua sự gia tăng lượng tín hiệu huỳnh quang. Quá trình
này xảy ra trong mỗi chu kỳ và không gây cản trở việc khuếch đại DNA. Trong
phương pháp này, mẫu dò Taqman phóng thích chất phát quang cộng thêm vào chất
phát quang đã được phóng thích trong các chu kỳ trước đó. Vì vậy lượng tín hiệu
huỳnh quang gia tăng rất nhiều sau mỗi chu kỳ. Phương pháp này sử dụng các chương
27
trình nhiệt của một phản ứng PCR bình thường. Một yêu cầu đặc biệt đối với mẫu dò
là nó không được có base G ở đầu 5‟. Vì base G có thể triệt tiêu thuốc nhuộm phát
huỳnh quang ngay cả khi mẫu dò đã bị phá hủy [42].
Công cụ phát hiện
Việc phát hiện sự gia tăng tín hiệu huỳnh quang để định lượng DNA đòi hỏi các
công cụ khá phức tạp. Có nhiều công ty trên thế giới đã phát triển các loại phương
pháp phục vụ cho việc này. Trong khóa luận này, chúng tôi sẽ mô tả sơ lược về
nguyên lý và nguyên tắc hoạt động của máy My iQ
TM
Single Color Real-Time PCR
Detection System của công ty Bio-Rad. Đây là công cụ chính của khóa luận này và
nguyên tắc hoạt động của nó cũng tương đồng với khá nhiều hệ máy trên thế giới.
Hình 2.15: Máy Real-Time PCR [8]
Máy My iQ
TM
bao gồm hai phần:
- Máy luân nhiệt: Nằm phía dưới, có tác dụng như một máy PCR bình
thường, có 96 giếng thí nghiệm.
- Bộ phận quang học: Nằm phía trên, công dụng định lượng DNA.
Bộ phận quang học của máy chứa hệ thống kích thích và hệ thống phát hiện. Hệ
thống kích thích là một đèn halogen tungsten 50W, được làm mát bằng quạt; một bộ
lọc nhiệt (kính hấp thụ tia hồng ngoại), một kính lọc ánh sáng kích thích có màn chớp,
và một hệ thống 2 tấm kính cho phép rọi sáng đồng thời bản chứa mẫu. Hệ thống kích
thích được đặt ở góc phải phía trước của bộ phận quang học, với chiếc đèn chiếu sáng
từ phải sang trái, vuông góc với trục máy. Ánh sáng bắt nguồn từ chiếc đèn, qua bộ lọc
nhiệt và kính lọc kích thích (nếu mở) và phản chiếu lên 96 giếng trong máy luân nhiệt
28
bằng một hệ thống các tấm kính. Ánh sáng này sẽ kích thích các phân tử huỳnh quang
trong giếng [14].
Hình 2.16: Cấu tạo bộ phận quang học của máy Real-Time PCR [14]
Hệ thống phát hiện chiếm 2 phần 3 phía sau bộ phận quang học. Các phần
chính trong hệ thống phát hiện này bao gồm 1 kính lọc quang học đơn cho tín hiệu
huỳnh quang phát ra và một đầu đọc CCD (charged coupled device). Đầu đọc này có
độ phân giải 350.000 pixel cho phép định lượng riêng biệt tín hiệu huỳnh quang ở mỗi
giếng. Ánh sáng huỳnh quang phát ra từ giếng thí nghiệm sẽ đi qua tấm kính lọc và
được phát hiện bằng đầu đọc CCD [14].
Nguyên tắc định lƣợng bằng kĩ thuật Real-time PCR
Quan hệ định lƣợng
Hàm lượng GMO trong một mẫu thực phẩm được biểu diễn bằng lượng thành
phần biến đổi gen trong tổng lượng thành phần. Để xác định giá trị này, ta cần đo
lường số lượng trình tự một gen đối chiếu cũng như số lượng trình tự đặc trưng cho
GMO. Gen đối chiếu được lựa chọn phải:
- Đặc trưng cho loài
- Hiện diện với số lượng một copy trong bộ gen đơn bội
- Hiện diện ổn định trong các giống khác nhau của cùng một loài
29
- Nó có thể được khuếch đại trong phản ứng tương đương với tính trạng biến
đổi gen (mặc dù điều này phụ thuộc nhiều vào việc thiết kế primer và
probe).
Một vấn đề nữa trong việc định lượng mà ta cần chú ý. Đó là, hàm lượng GMO
(phần trăm) có thể được hiểu là trọng lượng của thành phần biến đổi gen trên tổng
trọng lượng thành phần đó (ví dụ: trọng lượng bắp biến đổi gen trên tổng trọng lượng
bắp trong mẫu thí nghiệm). Vì vậy, ta có thể tính toán phần trăm GMO bằng số lượng
trình tự DNA biến đổi gen trên số lượng trình tự gen đối chiếu. Tuy nhiên, cây trồng
biến đổi gen có một số khác biệt quan trọng, đó là:
- Mức độ bội thể của giống: Có khả năng các giống cây trồng biến đổi gen có
độ bội thể khác với giống thông thường (ví dụ: tứ bội thay vì đơn bội)
- Mức độ dị hợp của giống: Tính trạng biến đổi gen có thể là đồng hợp tử
hoặc dị hợp tử.
- Số lượng bản sao gen đơn bội của một cấu trúc nhân tạo. Gen có thể được
chèn thành một bản sao trên bộ gen đơn bội hay thành nhiều bản sao.
Vấn đề 3 có thể khắc phục bằng cách thiết kế hệ thống primer và probe trên
đường biên giữa gen chuyển nạp và trình tự bộ gen. Trình tự đường biên độc nhất giúp
ta có hai lợi thế, đó là phản ứng đặc hiệu và loại trừ việc chèn nhiều bản sao của cùng
một cấu trúc có thể gây sai lệch kết quả định lượng. Vấn đề 1 và 2 có thể khắc phục
dựa trên kinh nghiệm sử dụng những vật liệu đối chiếu tương đồng với mẫu thí nghiệm
(ví dụ: sử dụng mẫu đối chiếu là bột bắp để định lượng bột bắp). Mặc khác, việc định
lượng những mẫu chuẩn (trình tự DNA dòng hóa, hỗn hợp DNA ) khác các mẫu đối
chiếu được cấp phép có thể giúp chỉnh lý những điểm không nhất quán trong định
lượng. Một cách khác được chấp nhận rộng rãi để giải quyết vấn đề 1 và 2 đó là biểu
thị phần trăm GMO trên bộ gen đơn bội [42].
Thiết kế thí nghiệm
Một thí nghiệm Real-time PCR được thiết kế như sau:
- Một phản ứng PCR dùng phát hiện và định lượng gen đích (trình tự DNA
đặc trưng cho GMO).
30
- Phản ứng PCR thứ hai được thiết kế để phát hiện và định lượng trình tự một
gen đối chiếu, đặc trưng cho loài và thường sử dụng cho định lượng GMO.
- Đường chuẩn cho gen đích và gen đối chiếu. Trong mỗi thí nghiệm, lượng
gen đích và gen đối chiếu được xác định từ đường chuẩn này. Sau đó, lượng
gen đích được chia cho lượng gen đối chiếu để xác định phần trăm hiện
diện của GMO trong mẫu. Để đạt yêu cầu thống kê, đường chuẩn phải có từ
3 - 4 nồng độ khác nhau.
Hình 2.17: Đƣờng chuẩn cho phản ứng định lƣợng [14]
Thêm vào đó, một đối chứng âm (NTC - no template control) cần được thêm
vào trong mỗi thí nghiệm. Những đối chứng khác cũng có thể được sử dụng.
Cuối cùng, thí nghiệm định lượng gen đối chiếu và gen đích phải được thực
hiện trong cùng một lần chạy phản ứng PCR, điều này nhằm tránh những sai lệch
thống kê giữa các thí nghiệm [42].
Phân tích dữ liệu Real-time PCR
Khi phản ứng Real-time PCR hoạt động, tín hiệu huỳnh quang (Rn value) được
thu nhận để tạo ra một đồ thị các tín hiệu tương ứng với số chu kỳ (trong cùng thời
gian). Thông thường, đồ thị này có dạng bán-logarit, gồm 3 giai đoạn: Đầu tiên là pha
“lag” với những dao động nhỏ tương ứng với tín hiệu nền, giai đoạn hai là hàm mũ với
các đường biểu đồ song song, cuối cùng là giai đoạn bão hòa .
Khả năng của phản ứng Real-time PCR là nó cho phép định lượng ngay trong
giai đoạn DNA khuếch đại gia tăng theo hàm mũ, mà không ở giai đoạn cuối cùng khi
lượng DNA bão hòa. Điều này nâng cao độ chính xác của việc định lượng do có sự
31
tương quan trực tiếp giữa lượng DNA ban đầu và giai đoạn mà tại đó toàn bộ DNA
được nhân đôi sau mỗi chu kỳ.
Hình 2.18: Đồ thị phản ứng Real-time PCR [14]
Trong phản ứng Real-time PCR, chu kỳ ngưỡng (threshold cycle, C
T
) được
định nghĩa là chu kỳ mà tại đó tín hiệu huỳnh quang có giá trị cao hơn đáng kể so với
tín hiệu nền nhưng vẫn nằm trong giai đoạn log tuyến tính. Thông thường đó là giá trị
trung bình của các tín hiệu huỳnh quang từ chu kỳ 3 đến 15 cộng với 10 độ lệch chuẩn.
Lượng DNA ban đầu càng nhiều thì lượng DNA khuếch đại được phát hiện càng sớm
và giá trị C
T
càng thấp. Do vậy, C
T
được sử dụng làm công cụ để tính toán lượng DNA
ban đầu trong mỗi phản ứng. Chu kỳ ngưỡng này cần được thiết lập phía trên đường
tín hiệu nền và nằm trong pha tăng trưởng hàm mũ, tại nơi mà đồ thị khuếch đại giống
nhau nhất. Thông thường, với hệ máy của công ty Bio-Rad, giá trị chu kỳ ngưỡng do
máy tự động thiết lập, đều này giúp ta tránh những sai sót chủ quan có thể xảy ra khi ta
tự thiết lập chu kỳ. Tuy nhiên, máy vẫn cho phép ta có thể thiết lập chu kỳ ngưỡng
trong những trường hợp đặc biệt [42].
Tính toán hàm lƣợng GMO
Kết quả của phản ứng Real-time PCR là giá trị ΔRn, biểu thị sự khác biệt giữa
giá trị Rn
+
(tín hiệu huỳnh quang của tất cả các mẫu) và Rn
-
(tín hiệu nền của phản ứng
- tín hiệu huỳnh quang ban đầu hay tín hiệu của đối chứng âm).
32
Hàm lượng GMO của một mẫu có thể được tính bằng phương pháp dựng đường
chuẩn dựa trên các nồng độ khác nhau của DNA
- Đường thứ nhất dùng để định lượng gen đối chiếu
- Đường thứ hai dùng định lượng trình tự mục tiêu của GMO
Ở mỗi mẫu thí nghiệm, hàm lượng gen đối chiếu và gen mục tiêu được xác định
bằng cách nội suy trên đường cong chuẩn. Từ đó, tỷ lệ hiện diện của GMO (phần
trăm) sẽ được tính bằng thương số của lượng gen GMO trên lượng gen đối chiếu. Tuy
nhiên, một điều cần chú ý là giá trị mẫu thí nghiệm cần phải nằm trong giá trị cao nhất
và thấp nhất của cả hai đường cong chuẩn. Các giá trị nằm ngoài có thể là kết quả định
lượng sai [42].
Mức độ chuyên biệt trong phát hiện và định lƣợng cây trồng biến đổi gen
[9][44]
Dựa vào cấu trúc cơ bản của các gen chuyển vào thực vật, người ta chia thành
các mức độ chuyên biệt để phát hiện và định lượng cây trồng biến đổi gen như sau:
- Phương pháp đại trà (Screening): Phương pháp này phát hiện các đoạn trình
tự promoter hoặc terminator đặc biệt chỉ có ở cây đã được chuyển gen. Hai
đối tượng chính của phương pháp này là promoter CAMV 35S và terminator
nos do chúng hiện diện trong phần lớn cây trồng biến đổi gen trên thế
giới.Tuy nhiên, khuyết điểm của chúng là các promoter va terminator mà ta
phát hiện và định lượng có thể bắt nguồn từ virus hay vi khuẩn hiện diện
trong các loại ngũ cốc tự nhiên hay tại khu vực trồng trọt. Vì vậy, chúng có
thể gây ra hiện tượng dương tính sai khi phát hiện và định lượng chúng.
Mặc khác, một khuyết điểm nữa là phương pháp này chỉ có thể định lượng
tổng thành phần chuyển gen trong một mẫu thực phẩm hỗn hợp mà không
thể chỉ ra chính xác thành phần nguyên liệu nào đã được biến đổi gen.
- Phương pháp chuyên biệt gen (gene specific): đối tượng của phương pháp
này là đoạn trình tự nằm trong gen mục tiêu, đó là gen chuyển nạp vào thực
vật. điều này có nghĩa là, khi phát hiện được đoạn gen này thì chắc chắn đó
là cây chuyển gen, ví dụ như khuếch đại một đoạn gen Cry IA(b). Tuy
nhiên, khuyết điểm của phương pháp này là nó chỉ cho phép xác định một
33
nhóm sản phẩm biến đổi gen mà không cho phép ta xác định chính xác đó là
sản phẩm nào. Một ví dụ là: Nếu ta phát hiện có trình tự gen Cry IA (b)
trong mẫu hỗn hợp bắp và đậu nành đã chuyển gen Bt thì ta cũng không thể
xác định chính xác thành phần nào đã được chuyển gen và tỷ lệ chuyển gen
là bao nhiêu phần trăm. .
- Phương pháp chuyên biệt xây dựng (construct specific): đối tượng củ
phương pháp này là đoạn trình tự nằm giữa vùng promoter với vùng
enhancer, vùng enhancer với vùng gen mục tiêu hay giữa vùng gen mục tiêu
với vùng terminator. So với hai phương pháp trên, phương pháp này có thể
cho ta biết chính xác hơn thành phần nào đã được chuyển gen do chúng có
thể có sự kết hợp khác nhau giữa các trình tự nói trên. Tuy nhiên, trong
tương lai, nếu một cấu trúc gen chuyển nạp (gồm: promoter, enhancer, gen
và terminator) được sử dụng cho nhiều đối tượng khác nhau thì phương
pháp này cũng không còn chính xác nữa.
- Phương pháp chuyên biệt sự kiện chuyển gen (event specific). Đối tượng
của phương pháp này là đoạn trình tự giữa vùng promoter và vúng gen thực
vật hay giữa vùng terminator với vùng gen thực vật. Do đoạn trình tự này là
độc nhất cho mỗi sự kiện chuyển gen, chúng không chỉ cho phép ta xác định
chính xác thành phần nào đã được biến đổi gen trong mẫu hỗn hợp mà còn
chính xác trong từng sự kiện chuyển gen khi một cấu trúc được chuyển nạp
nhiều lần vào trong cùng một đối tượng. tuy nhiên, phương pháp này vẫn
còn trong giai đoạn phát triển và chưa được ứng dụng rộng rãi.
Trong phạm vi khóa luận này, chúng tôi sử dụng phương pháp đại trà để định
lượng promoter 35S trong mẫu bắp và thực phẩm có chứa bắp. Hạn chế của phương
pháp này là tính chuyên biệt và chính xác không cao bằng 3 phương pháp còn lại.
34
Hình 2.19: Mức độ chuyên biệt trong phát hiện và định lƣợng GMO [44]
Một số công trình nghiên cứu về phát hiện và định lƣợng GMO dựa trên
promoter 35S
Phát hiện và sàng lọc GMO dựa trên promoter 35S
- Trong nước:
Vương Nguyễn Phương Lâm, 2003. Xây dựng phương pháp chuẩn đoán đậu
nành chuyển gen và nghiên cứu hiện trạng các sản phẩm đậu nành chuyển gen nhập
khẩu vào Việt Nam. Luận văn tốt nghiệp khoa Nông học, Trường ĐH Nông Lâm Tp
Hồ Chí Minh.
Hồ Bích Liên, 2003. Xây dựng phương pháp chuẩn đoán bắp chuyển gen và
nghiên cứu hiện trạng các sản phẩm bắp chuyển gen nhập khẩu vào Việt Nam. Luận
văn tốt nghiệp khoa Nông học, Trường ĐH Nông Lâm Tp Hồ Chí Minh.
Trương Minh Mẫn, 2005. Bước đầu thiết lập quy trình phát hiện sản phẩm có
nguồn gốc từ cây trồng biến đổi gen dựa vào promoter 35S và terminator nos. Luận
văn tốt nghiệp khoa Công Nghệ Sinh Học, Trường ĐH Khoa Học Tự Nhiên Tp Hồ
Chí Minh.
Nguyễn Hồng Minh Ngọc, 2004. Hoàn thiện phương pháp chuẩn đoán nông
sản chuyển gen dựa trên kỹ thuật PCR. Luận văn tốt nghiệp khoa Nông học, Trường
ĐH Nông Lâm Tp Hồ Chí Minh.
35
- Ngoài nước:
Brunnert Hans-Josef , Spener Friedrich and Börchers Torsten, 2001 . PCR-
ELISA for the CaMV-35S promoter as a screening method for genetically modified
Roundup Ready soybeans. Eur Food Res Technol (2001) 213:366–371.
Fukuta Shiro, Mizukami Yuko , et al., 2004. Real-time loop-mediated
isothermal amplification for the CaMV-35S promoter as a screening method for
genetically modified organisms. Eur Food Res Technol (2004) 218:496–500.
Định lƣợng GMO đựa trên promoter 35S
M. Hardegger 7 P. Brodmann 7 A. Herrmann, 1999. Quantitative detection of
the 35S promoter and the NOS terminator using quantitative competitive PCR. Eur
Food Res Technol (1999) 209 :83–87.
36
36
PHẦN III: VẬT LIỆU VÀ PHƢƠNG PHÁP TIẾN HÀNH
1. Nội dung nghiên cứu
Trong phạm vi khóa luận này, các nội dung nghiên cứu của chúng tôi bao gồm
các mục sau:
- Xác định quy trình ly trích tốt nhất trong điều kiện thí nghiệm cho mẫu bắp
và thực phẩm có chứa bắp.
- So sánh phương pháp sàng lọc sản phẩm biến đổi gen bằng Real-Time PCR
với phương pháp PCR truyền thống.
- Xác định phương pháp định lượng bằng kĩ thuật Real-Time PCR với hóa
chất là thuốc nhuộm SYBR Green I hay mẫu dò Taqman.
- Đánh giá khả năng định lượng của phương pháp Real-Time PCR.
- Định lượng promoter 35S trên một số sản phẩm bắp và thực phẩm có chứa
bắp hiện diện trên thị trường.
Các vấn đề nghiên cứu này sẽ giúp chúng tôi xây dựng được một quy trình định
lượng bắp biến đổi gen dựa trên trình tự promoter 35S và mở rộng sang các đối tượng
khác.
2. Điều kiện tiến hành thí nghiệm
Địa điểm thực hiện thí nghiệm
Các thí nghiệm được thực hiện tại Phòng thí nghiệm Công nghệ Sinh học Phân
tử (Lab B), Khoa Sinh học, Trường Đại học Khoa học Tự nhiên, Đại học Quốc gia
Thành phố Hồ Chí Minh, 227 Nguyễn Văn Cừ, Quận 5, Thành phố Hồ Chí Minh.
Thời gian thực hiện
Thời gian thực hiện từ tháng 3/2005 đến tháng 8/2005.
3. Tiến trình thí nghiệm:
Trong khóa luận này, các thí nghiệm được tiến hành theo tiến trình như sau:
37
37
4. Vật liệu thí nghiệm
Vật liệu thí nghiệm trong khóa luận này được chọn như sau:
- Đối chứng dương: bắp chuyển gen Bt 176 với hàm lượng thành phần chuyển
gen là 1% cấp bởi GeneScan.
- Đối chứng âm: nước siêu sạch.
Các mẫu thí nghiệm được chọn lọc và mua ngẫu nhiên trên thị trường Tp Hồ
Chí Minh và Đồng Nai:
Phƣơng pháp 1:
Định lượng bằng Real-Time PCR
với thuốc nhuộm SYBR Green
Thí nghiệm 2:
Sàng lọc sản phẩm biến đổi gen
Kiểm tra sự hiện diện của promoter 35S
Phƣơng pháp 2:
Real-Time PCR với thuốc nhuộm
SYBR Green
Thí nghiệm 1:
Khảo sát các quy trình ly trích
DNA
Phƣơng pháp 1:
PCR truyền thống
Quy trình ly trích đề nghị
Thí nghiệm 3:
Xác định phƣơng pháp định lƣợng GMO
Thử nghiệm các phương pháp định lượng
Kết luận
Phương pháp định lượng đề nghị
Thí nghiệm 4:
Đánh giá khả năng định lƣợng
Các chỉ tiêu định lượng
Thí nghiệm 5:
Ứng dụng phƣơng pháp định lƣợng
khảo sát một số mẫu thị trƣờng
Phương pháp sàng lọc đề nghị
Phƣơng pháp 2:
Định lượng bằng Real-Time
PCR với mẫu dò Taqman
38
38
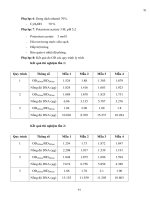
Bảng 3.1: Mẫu thí nghiệm
STT
Tên và đặc điểm của mẫu
Kí hiệu
1
2
3
4
5
6
7
8
9
10
11
12
Bắp giống 1
Bắp giống 2
Bắp giống 3
Bắp giống 4
Bắp giống 5
Bắp trái ăn tươi
Bột bắp nguyên liệu làm thức ăn gia súc
Bánh bắp
Thức ăn gia súc 1
Thức ăn gia súc 2
Bột ngũ cốc dinh dưỡng 1
Bột ngũ cốc dinh dưỡng 2
B1
B2
B3
B4
B5
B6
B7
B8
B9
B10
B11
B12
5. Thí nghiệm 1: Khảo sát các quy trình ly trích DNA
Mục tiêu
Thông qua việc so sánh các bước thực hiện, hóa chất sử dụng để xác định một
quy trình ly trích DNA tốt nhất phục vụ cho các thí nghiệm sau.
Vật liệu
Hạt bắp giống (B1).
Phƣơng pháp thực hiện
Dựa vào các tài liệu trong và ngoài nước chúng tôi tiến hành khảo sát 3 quy
trình ly trích DNA như sau:
- Qui trình 1: Tách chiết DNA bằng phương pháp đơn giản [36].
- Qui trình 2: Tách chiết DNA bằng phương pháp CTAB [38].