bài giảng hóa học 11 bài 9 axit nitric và muối nitrat
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (412.38 KB, 16 trang )
BÀI GIẢNG HÓA HỌC LỚP 11
BÀI 9:
+5
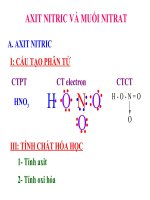
A. AXIT NITRIC
I. Cấu tạo phân tử
•
Công thức phân tử: HNO
3
•
Công thức cấu tạo :
O
H-O-N
O
Trong phân tử HNO
3
, Nitơ có hóa trị là IV và số oxi hóa
là +5
II. Tính chất vật lí :
•
HNO
3
tinh khiết là chất lỏng không màu, sôi ở
86
0
C, tan vô hạn trong nước
•
HNO
3
không bền, có thể bị phân hủy một ít ở
điều kiện thường
III. Tính chất hóa học
1) Tính axit
HNO
3
là chất điện li mạnh, dung dịch có tính chất của H
+
–
Dung dịch HNO
3
làm quỳ tím hóa đỏ
–
Td với oxit bazơ và bazơ tạo muối và nước
– Td với muối của axit yếu
3 3 2 2
3 3 3 3 2
2 ( )
3 ( ) ( ) 3
HNO CuO Cu NO H O
HNO Al OH Al NO H O
+ → +
+ → +
↑++→+
223323
22 COOHKNOCOKHNO
2) Tính oxi hóa
HNO
3
có tính oxi hóa rất mạnh có thể oxi hóa được hầu hết các kim
loại ( trừ Au và Pt ), phi kim và các hợp chất có tính khử
a. với kim loại:
+ dung dịch HNO
3
đặc
KL + HNO
3
(đ)→ NO
2
0 5 2 4
3 3 2 2 2
4 ( ) ( ) 2 2Cu HNOđ Cu NO N O H O
+ + +
+ → + ↑ +
3
HNO
Cu
+ dung dịch HNO
3
loãng
KL có tính khử yếu +
KL có tính khử mạnh +
0 5 3 1
2
3 3 3 2
0 5 2 3
3 3 2 4 3 2
8 30 ( ) 8 ( ) 3 15
4 10 ( ) 4 ( ) 3
Al HNO l Al NO N O H O
Zn HNO l Zn NO N H NO H O
+ + +
+ + −
+ → + +
+ → + +
OHONNOCulHNOCu
2
2
23
25
3
0
42)(3)(83
+↑+→+
+++
0
+1 -3
(Cu, Ag…)
(Al, Mg,….)
HNO
3
loãng
→ NO
HNO
3
loãng
→ NO, N
2
, N
2
O, NH
4
NO
3
+2
Chú ý : Al, Fe bị thụ động hóa trong HNO
3
đặc, nguội
vì tạo nên một màng oxit bền trên bề mặt các kim loại
này
b. với phi kim
c. với hợp chất có tính khử
OHONNOAlđNOHAl
t
22
4
33
35
3
0
33)()(6
0
++→+
+++
OHONPOHđHNOP
OHONOCđHNOC
t
t
22
45
43
5
3
0
22
4
2
45
3
0
25)(5
24)(4
0
0
+↑+→+
+↑+↑→+
+++
+++
OHONNOFelHNOFeO
2
2
33
35
3
2
5)(3)(103
++→+
++++
IV. Ứng dụng :
Sản xuất phân bón, thuốc nổ, thuốc nhuộm , dược
phẩm……
V. Điều chế :
1) Trong phòng thí nghiệm
2) Trong công nghiệp
Oxi hóa khí amoniac bằng oxi không khí
Oxi hóa NO thành NO
2
Chuyển hóa NO
2
thành HNO
3
43423
0
)()( NaHSOHNOđSOHrNaNO
t
+→+
OHNOONH
Ptt
2
,
23
6454
0
+ →+
22
2NOONO
→+
3222
424 HNOOOHNO
→++
B. MUỐI NITRAT
I. Tính chất của muối Nitrat
1) Tính chất vật lí:
Đều tan trong nước và điện li hoàn toàn ra
ion
2) Tính chất hóa học
a. Phản ứng nhiệt phân
–
Muối nitrat của K, Na, Ca… muối nitrit + O
2
–
Muối nitrat của Mg, Zn, Cu…. Oxit + NO
2
+ O
2
–
Muối nitrat của Ag, Hg kim loại + NO
2
+ O
2
→
0
t
→
0
t
→
0
t
22223
223
)()(
22
0
0
ONOCaNOCa
ONaNONaNO
t
t
+→
+→
2223
2223
42)(2
42)(2
0
0
ONOCuONOCu
ONOMgONOMg
t
t
++→
++→
2223
223
2)(
222
0
0
ONOH gNOHg
ONOAgAgNO
t
t
++→
++→
II. Ứng dụng
-
Làm phân bón trong công nghiệp
-
Điều chế thuốc nổ đen
C. CHU TRÌNH CỦA NITƠ TRONG
TỰ NHIÊN
Là một chu trình khép kín
Nitơ trong
Không khí
Nitơ trong đất
Nitơ của thực vật và động vật
BÀI TẬP CỦNG CỐ
Bài 1 :
Hợp chất nào sau đây của nitơ không được
tạo ra khi cho HNO
3
tác dụng với kim loại ?
A. NO
B. NH
4
NO
3
C. NO
2
D. N
2
O
5
Bài 2 :
Kim loại bị thụ động trong HNO
3
đặc, nguội là:
A. Al, Fe
B. Ag, Fe
C. Pb, Ag
D. Pt, Au
Bài 3:
Cho 5,6g Fe tác dụng với dung dịch HNO
3
20%. Khối lượng dung dịch HNO
3
cần dùng là:
A. 63g B. 12,6g C. 126g D. số khác
DẶN DÒ
Làm các bài tập trong SGK