Bài 12: axit nitric và muối nitrat
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (350.47 KB, 22 trang )
Chào m ng ừ
quý th y cô ầ
t i d gi !ớ ự ờ
Sinh viên: Nguyễn thị Hòa
Lớp: K30 A- hóa
Trường: ĐHSP Hà Nội 2
Bài 12 (2tiết)
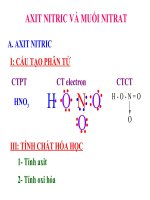
A. Axit nitric
I.Cấu tạo phân tử
CTPT : HNO
3
CT electron: H : O : N : : O
..
O
CTCT : H - O - N = O
↓
o
o
Xác định số oxi hóa của Nitơ? Nhận xét?
•
CTPT : HNO
3
N có số oxi hóa là +5
Nhận xét: đây là số oxi hóa cao nhất của N
II. TÍNH CHẤT VẬT LÝ
Là chất lỏng không màu, “bốc khói” mạnh trong
không khí ẩm.
D= 1,53g/cm
3
, t
0
s
= 86
0
C
Axit HNO
3
không bền, (ngay ở nhiệt độ thường khi
có ánh sáng) phân hủy →NO
2
↑(mầu nâu đỏ)
Tan trong nước theo bất kì tỉ lệ nào.
III. TÍNH CHẤT HÓA HỌC
HNO
3
→ H
+
+ NO
3
-
1. TÍNH AXIT MẠNH
Làm quỳ tím chuyển sang màu đỏ
Tác dụng với bazơ, oxit bazơ, muối, kim loại.
VD: 3HNO
3
+ Fe(OH)
3
→ Fe(NO
3
)
3
+ 3H
2
O
2HNO
3
+ CuO → Cu(NO
3
)
2
+ H
2
O
2HNO
3
+ MgCO
3
→ Mg(NO
3
)
2
+ CO
2
↑ + H
2
O
HNO
3
+Cu → ?
Thí nghiệm
2. TÍNH OXI HÓA.
HNO
3
(N
+5
) là chất oxi hóa mạnh
a. Với kim loại
Cu + 4HNO
3
(đ)
→ Cu(NO
3
)
2
+ 2NO
2
↑ + 2H
2
O
(nâu đỏ)
3Cu + 8HNO
3
(l) → 3Cu(NO
3
)
2
+ 2NO↑ + 4H
2
O
0 +5
+2
+4
0
+5 +2 +2