Giáo án hóa 11 bài 3 bai 9 axit nitric va muoi nitrat
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (91.4 KB, 5 trang )
Ngày soạn:………..
Ngày giảng: Lớp:…………….
Lớp:……………
Tiết 18 - Bài 12:
AXIT NITRIC VÀ MUỐI NITRAT
I.MỤC TIÊU BÀI HỌC:
Sauk hi học xong bài này, học sinh có khả năng:
1. Về kiến thức:
HS trình bày được:
- Cấu tạo phân tử,tính chất vật lí của, ứng dụng axit nitric.
HS giải thích được:
- HNO3 là một trong những axit mạnh.
- HNO3 có tính oxi hoá rất mạnh( tuỳ thuộc vào nồng độ của axit và nồng độ chất
khử): oxi hoá hầu hết các kim loại (trừ Au, Pt), một số phi kim, nhiều hợp chất hữu cơ
và vô cơ.
2. Về kĩ năng:
- HS dự đoán tính chất hoá học, kiểm tra dự đoán bằng thí nghiệm và kết luận.
- HS thực hiện được cách tiến hành thí nghiệm, quan sát thí nghiệm, hình ảnh…rút ra
được nhận xét về tính chất của HNO3.
- Viết được PTHH minh hoạ tính chất hoá học của HNO3 đặc và loãng.
- Giải được một số bài tập liên quan: Xác định CTPT, tính thể tích khí, tính nồng độ
axit...
3. Về thái độ:
- Hình thành thói quen say mê nghiên cứu khoa học.
- Hình thành ý thức thận trọng khi sử dụng hóa chất, giữ gìn an toàn cho bản thân và
người khác, ý thức tiết kiệm hoá chất, bảo vệ cơ sở vật chất khi sử dụng.
Trọng tâm: Tính chất hoá học của HNO3: Tính axit mạnh và tính oxi hoá rất mạnh.
II. CHUẨN BỊ ĐỒ DÙNG VÀ PHƯƠNG TIỆN DẠY HỌC:
1. Chuẩn bị của giáo viên:
- Tài liệu giảng dạy và các tài liệu tham khảo
- Chuẩn bị thiết bị, dụng cụ, hoá chất:
+ 4 bộ dụng cụ thí nghiệm: ống nghiệm,giá ống nghiệm, kẹp, đèn cồn...
+ Axit HNO3 đặc và loãng, Cu.
-1-
2. Chuẩn bị của học sinh:
- Chuẩn bị kiến thức: Ôn tập lại tính chất của axit, cách cân bằng phản ứng oxi hoá –
khử.
- Chuẩn bị tài liệu học tập, thí nghiệm, dụng cụ học tập, đọc trước bài ở nhà.
III. CÁC HOẠT ĐỘNG DẠY HỌC
1.Ổn định tổ chức:
- Kiểm tra sĩ số:
- Nhắc nhở HS một số lưu ý( nếu cần)
2. Kiểm tra bài cũ
Câu 1: Vì sao theo lý thuyết nitơ hoạt động hóa học mạnh hơn photpho nhưng trong
thực tế lại ngược lại?
Câu 2: Vì sao cấu tạo của NH3 tương tự PH3 nhưng NH3 thì bền còn PH3 dễ phân
hủy ?
Đáp án:
Câu 1: Trong tự nhiên nitơ ở dạng phân tử N2 nên rất bền,nhìn chung là trơ về mặt hóa
học,chỉ khi có hồ quang điện trong dk 3k độ c thì mới phản ứng thôi.Còn photpho thì
trong tự nhiên có 2 dạng photpho đỏ và trắng nhưng chúng đều ở dạng đơn chất nên
phản ứng ngay ngoài không khí.
Câu 2: Công thức NH3 và PH3 giống nhau nhưng cấu tạo thì khác nhau. NH3 cấu tạo
hình chóp tam giác nên rất bền .còn PH3 cấu tạo hình sao, nên nó không bền.
3. Thực hiện bài học
a. Đặt vấn đề: Axit nitric là một trong những nguyên nhân gây ra hiện tượng mưa
axit. Để tìm hiểu xem axit nitric có cấu tạo như thế nào? Có những tính chất gì mà có
thể gây nên hiện tượng nguy hiểm như vậy, chúng ta cùng tìm hiểu qua bài học hôm
nay.
b. Tiến trình bài học
Hoạt động 1: Cấu tạo phân tử
Mục tiêu: HS biết được cấu tạo của phân tử HNO3
Hoạt động của GV và HS
Nội dung kiến thức
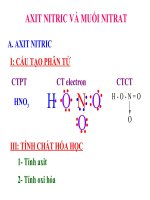
GV: Yếu cầu HS nêu CTPT của axit nitric I. Cấu tạo phân tử
GV: Trình bày CTCT (chiếu slide), giải
- CTPT: HNO3
thích các liên kết
- CTCT:
O
GV: Theo các em trong phân tử HNO3
→
H–O–N O
nguyên tử nitơ có số oxi hoá, hoá trị là
- N có số oxi hoá cao nhất là +5, và có
bao nhiêu?
-2-
HS: Trả lời
hoá trị là 4.
GV: Chốt kiến thức
Hoạt động 2: Tính chất vật lí
Mục tiêu: HS biết được tính chất vật lí của HNO3
Hoạt động của GV và HS
Nội dung kiến thức
GV: Cho HS quan sát mẫu HNO3 (chiếu II. Tính chất vật lí
slide), yêu cầu HS tham khảo SGK trình (SGK)
Chú ý: HNO3 không bền, bị phân huỷ tạo
bày tính chất vật lí của HNO3
NO2
HS: Trình bày
4HNO3 → 4 NO2 + O2 + 2H2O
GV: Axit HNO3 để lâu ngày có màu vàng
=> Dung dịch axit có màu vàng nhạt..
do bị phân huỷ tạo thành NO2
Hoạt động 3: Tính chất hoá học
Mục tiêu: HS hiểu được:HNO3 là một axit có tính axit mạnh và tính oxi hoá mạnh.
Hoạt động của GV và HS
Nội dung kiến thức
GV: chiếu slide hình ảnh cấu tạo HNO 3, II. Tính chất hoá học
yêu cầu HS quan sát, dự đoán tính chất 1.Tính axit
của HNO3?
Làm quỳ tím hoá đỏ
HS: Trình bày
Tác dụng oxit bazơ
GV: Chốt kiến thức
Al2O3 + 6HNO3 2Al(NO3)3 + 3H2O
GV: yêu cầu HS lấy ví dụ về tính axit của Tác dụng với bazơ
axit nitric, viết phương trình hoá Al(OH)3 + 3HNO3 Al(NO3)3 + 3H2O
học( Hoàn thành vào bảng phụ, trình Tác dụng với muối
bày).
Na2CO3 +2HNO3 2NaNO3+CO2+H2O
Bảng phụ 1:(slide và bảng phụ)
Làm quì tím chuyển sang màu…
Tác dụng oxit bazơ
Fe2O3 + HNO3 ..............
Tác dụng với bazơ
Ca(OH)2 + HNO3 ..............
Tác dụng với muối
Na2CO3 + HNO3 ..............
Tác dụng với kim loại:
Fe + HNO3 ..............
GV Chú ý: Do NO3 – có tính oxi hoá
2.Tính oxi hoá
a. Tác dụng với kim loại
Axit HNO3 oxi hoá được hầu hết các kim
loại( trừ Au, Pt), đưa kim loại lên số oxi
hoá cao nhất
-3-
mạnh nên trong các phản ứng với kim
loại, sản phẩm tạo ra không phải là H2 mà
là một sản phẩm khử khác
GV: Axit HNO3 có tính oxi hoá mạnh,
oxi hoá được hầu hết các kim loại( trừ
Au, Pt ). Khi đó kim loại bị oxi hoá đến
mức oxi hoá cao nhất và tạo ra muối
nitrat.
GV: Lấy ví dụ với Cu, yêu cầu các nhóm
làm TN, quan sát, viết PTHH.
HS: Làm TN theo nhóm, trình bày vào
bảng phụ.
Bảng phụ 2:
M (trừ Pt, Au) + HNO3 à
M(NO3)n + SP khử + H2O
+ Đối với KL có tính khử yếu,HNO 3đặc
tạo ra...; HNO3 loãng tạo ra...
+ Đối với KL có tính khử mạnh,
HNO3đặc tạo ra...;HNO3 loãng có thể
tạo ra....
VD:
Cu + HNO3(đ) … + … + H2O
Cu + HNO3(l) … + ... + H2O
Al + HNO3(l) ...+ N2O + H2O
Zn + HNO3 (l) ...+ NH4NO3 + H2O
GV: Khi đun nóng, axit nitric đặc có thể
oxi hoá được nhiều phi kim như C, S, P...
GV:biểu diễn thí nghiệm lưu huỳnh tác
dụng với axit nitric đặc, yêu cầu HS quan
sát, dự đoán hiện tượng, viết PTHH
HS: Quan sát, dự đoán, viết PTHH
GV: Axit nitric có thể oxi hoá được nhiều
hợp chất như H2S, HI, SO2, FeO, muối
sắt (II)...Yêu cầu HS hoàn thành các phản
M+HNO3 M(NO3)n + SP khử +H2O
(trừ Pt, Au) ; n là hoá trị cao nhất của M
+ Khi tác dụng với kim loại có tính khử
yếu HNO3 đặc bị khử đến NO2 còn HNO3
loãng bị khử đến NO.
VD:
Cu + 4HNO3(đ) Cu(NO3)2
+ 2NO2 + 2H2O
3Cu + 8HNO3(l) 3Cu(NO3)2
+ 2NO + 4H2O
+ KL có tính khử mạnh, HNO3 loãng có
thể tạo ra N2, N2O, NH4NO3
8Al + 30HNO3(l)
8Al(NO3)3 + 3N2O +
15H2O
4Zn + 10HNO3 (l)
4Zn(NO3)2 + NH4NO3 +
3H2O
Chú ý: Al, Fe, Cr bị thụ động hoá trong
dung dịch HNO3 đặc nguội.
b. Với phi kim:
VD:
S + 6HNO3 (đ) H2SO4 + 6NO2 + 2H2O
C + 4HNO3 (đ) CO2+ 4NO2 +2H2O
c. Với hợp chất:
VD:
3H2S + 2HNO3(l) 3S + 2NO + 4H2O
-4-
ứng
3H2S + 2HNO3(l) …….
FeO + HNO3 (l) …….
3FeO + 10HNO3 (l)
3Fe(NO3)3 + NO + 5H2O
4. Củng cố:
- Dùng sơ đồ tư duy để củng cố: cấu tạo và tính chất hoá học của axit nitric
- Bài tập củng cố: (Chiếu slide BT củng cố)
Câu 1: Cho dãy các chất: Fe, FeO, Fe(OH) 2, FeSO4, Fe3O4, Fe2(SO4)3, Fe2O3. Số chất
trong dãy bị oxi hóa khi tác dụng với dung dịch HNO3 đặc, nóng là:
A. 3
B. 5
C. 4
D. 6
Câu 2: Cho 9,6g Cu tác dụng hoàn toàn với dung dịch HNO3 dư tạo ra V lít khí NO
(đktc). Xác định V?
A. 2,24
B. 3,36
C. 1,12
D. 4,48
Câu 3: Sản phẩm nào không được tạo ra khi cho kim loại tác dụng với HNO3?
B. NO2
C. N2O
D. N2O5
A. NO
Câu 4: Cho 3,024 gam một kim loại M tan hết trong dung dịch HNO 3 loãng, thu được
940,8 ml khí NxOy (sản phẩm khử duy nhất, ở đktc) có tỉ khối đối với H 2 bằng 22. Khí
NxOy và kim loại M là
A. NO và Mg.
B. NO2 và Al.
C. N2O và Al.
D. N2O và Fe.
5. Hướng dẫn học bài
- Ôn lại các kiến thức đã học về cấu tạo và tính chất của HNO3
- Làm các BT: 1,2,4,6,7 SGK
- Đọc trước phần còn lại của bài
IV. TỰ RÚT KINH NGHIỆM:
…………………………………………………………………………………………
…………………………………………………………………………………………
…………………………………………………………………………………………
-5-