Đề kiểm tra học kì 1 môn hoá lớp 9
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (58.69 KB, 7 trang )
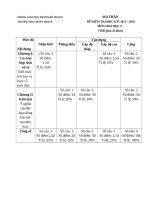
MA TRẬN
PHÒNG GIÁO DỤC HUYỆN BỐ TRẠCH
ĐỀ KIỂM TRAHỌC KỲI 2011 – 2012
MÔN HOÁ HỌC 9
(Thời gian 45 phút)
TRƯƠNGTHCS HOÀN TRẠCH
Mức độ
Nhận biết
Thông hiểu
Nội dung
Chương I: ) Số câu: 1
Các loại
Số điểm:
hợp chất
2,5đ
vô cơ
Tỉ lệ: 25%
Tính chất
hóa học m
loại; (5
tính chất
Chương II
Kim loại
Ý nghĩa
của dãy
hoạt động
hóa học
của kim
loại.
Tổng số
Vận dụng
Cấp độ
Cấp độ cao
thấp
Số câu: 1
Số điểm: 2,5đ
Tỉ lệ: 25%
Số câu: 1
Số câu: 1
Số điểm: 2đ Số điểm: 3đ
Tỉ lệ: 20%
Tỉ lệ: 30%
Số câu: 1
Số điểm 2,5đ
Tỉ lệ: 25%
Số câu: 1
Số điểm: 2đ
Tỉ lệ: 20%
Số câu: 1
Số điểm: 3đ
Tỉ lệ: 30%
Cộng
Số câu: 2
Số điểm: 5đ
Tỉ lệ: 50%
Số câu: 2
Số điểm: 5đ
Tỉ lệ: 50%
Số câu: 1
Số điểm: 2,5đ
Tỉ lệ: 25%
Số câu: 4
Số điểm: 10đ
Tỉ lệ: 100%
ĐỀ KIỂM TRAHỌC KỲI 2011 – 2012
MÔN HOÁ HỌC 9
(Thời gian 45 phút )
PHÒNG GIÁO DỤC HUYỆN BỐ TRẠCH
TRƯƠNGTHCS HOÀN TRẠCH
ĐỀ I
Câu 1 (2,5 điểm): Nêu tính chất hóa học của axit. Viết phương trình hóa học minh
họa.
Câu 2 (2,5 điểm):
a. Hãy nêu ý nghĩa của dãy hoạt động hóa học của kim loại ?
b. Hãy sắp xếp các kim loại sau theo chiều hoạt động hóa học giảm dần
Na, Al, Pb, Fe, Zn, Ag, Cu.
Câu 3 (2 điểm): Thực hiện chuỗi chuyển hóa sau, ghi rõ điều kiện phản ứng nếu có.
(3 điểm)
Al
Al2O3
AlCl3
Al(OH)3
Al2O3
Câu 4 (3 điểm): Dẫn từ từ 1,568 lít khí CO 2 (đktc) vào một dung dịch có hòa tan 6,4
gam NaOH, sản phẩm là muối Na2CO3.
a. Viết phương trình phản ứng.
b.Chất nào còn dư, khối lượng là bao nhiêu ? (lít hoặc gam)
c. Xác định muối thu được sau phản ứng.
Biết Na = 23; C = 12; O = 16; H = 1
HẾT.
ĐỀ KIỂM TRAHỌC KỲI 2011 – 2012
MÔN HOÁ HỌC 9
(Thời gian 45 phút )
PHÒNG GIÁO DỤC HUYỆN BỐ TRẠCH
TRƯƠNG THCS HOÀN TRẠCH
ĐỀ II
Câu 1 (2,5 điểm): Nêu tính chất hóa học của bagiơ. Viết phương trình hóa học minh
họa.
Câu 2 (2,5 điểm):
a. Hãy nêu ý nghĩa của dãy hoạt động hóa học của kim loại ?
b. Hãy sắp xếp các kim loại sau theo chiều hoạt động hóa học giảm dần
K, Mg, Pb, Fe, Zn, Hg, Cu.
Câu 3 (2 điểm): Thực hiện chuỗi chuyển hóa sau, ghi rõ điều kiện phản ứng nếu có.
(3 điểm)
Fe
Fe2O3
FeCl3
Fe(OH)3
Fe2O3
Câu 4 (3 điểm): Dẫn từ từ 3,136 lít khí SO 2 (đktc) vào một dung dịch có hòa tan 12,8
gam NaOH, sản phẩm là muối Na2SO3.
a. Viết phương trình phản ứng.
b.Chất nào còn dư, khối lượng là bao nhiêu ? (lít hoặc gam)
c. Xác định khối lượng muối thu được sau phản ứng.
Biết Na = 23; S = 32; O = 16; H = 1
HẾT.
ĐÁP ÁN - BIỂU ĐIỂM
ĐỀ KIỂM TRA HỌC KỲI 2011 – 2012
MÔN HOÁ HỌC 9
(Thời gian 45 phút )
PHÒNG GIÁO DỤC HUYỆN BỐ TRẠCH
TRƯƠNGTHCS HOÀN TRẠCH
ĐỀ I
Nội dung
Câu
Câu 1
Điểm
Tính chất hóa học của axit:
2,5đ
- Làm đổi màu chất chỉ thị màu: quỳ tím chuyển sang màu đỏ
0.5đ
- Tác dụng với oxit bazơ:2HCl + CaO → CaCl2 + H2O
0.5đ
- Tác dụng với dung dịch bazơ:Ca(OH)2 + 2HCl →CaCl2 +2H2O
0.5đ
- Tác dụng với kim loại: Fe + 2HCl → FeCl2 + H2
0.5đ
- Tác dụng với dung dịch muối: H2SO4 + BaCl2→BaSO4 + 2HCl
0.5đ
Câu 2
2,5đ
Câu 3
a. Ý nghĩa dãy HĐHH của KL
- Dãy HĐHH của KL được sắp xếp theo chiều giảm dần
- KL trước Mg t/d với nước ở điều kiện thường tạo thành kiềm
và giải phóng H2
- KL đứng trước H phản ứng với một số dd axit (HCl, H2SO4
loãng…) giải phóng khí H2
- KL đứng trước (trừ Na, K…) đẩy KL đứng sau ra khỏi dung
dịch muối.
b. Sắp xếp : Na, Al, Zn, Fe, Pb, Cu, Ag
Thực hiện chuổi chuyển hóa:
1. 4Al + 3O2 →
2Al2O3
2. Al2O3 + 6HCl → 2AlCl3 + 3H2O
3. AlCl3 + 3KOH → Al(OH)3 + 3KCl
4. 2Al(OH)3 → Al2O3 + 3H2O
Câu 4
0.5đ
0.5đ
0.5đ
0.5đ
O,5đ
2đ
0.5đ
0.5đ
0.5đ
0.5đ
3đ
a. Phương trình hóa học:
2NaOH + CO2
→ Na2CO3 + H2O
b. Xác định chất dư:
- Số mol CO2 = 1,568/ 22,4 = 0,07
- Số mol NaOH = 6,4/40 = 0,16 (mol)
- Số mol NaOH > số mol CO2 nên NaOH dư sau phản ứng
- Khối lượng NaOH dư = (0,16 – 0,14) x 40 = 0,8 gam
0,5đ
0,5
0,5
0,5
c. Khối lượng muối tạo thành:
- Theo PTHH, Số mol Na2CO3= số mol CO2 = 0,07 (mol)
- Khối lượng Na2CO3 = 0,07 x 106 = 7,42 (gam)
ĐỀ II
Câu 1
Nội dung
Tính chất hóa học của bagiơ:
- Làm đổi màu chất chỉ thị màu: quỳ tím chuyển sang màu xanh
- Tác dụng với oxit axit: Ca(OH)2 + CO2 → Ca(HCO3)2
2CO2 + Ca(OH)2 → CaCO3 + H2O
- Tác dụng với axit:
Ca(OH)2 + 2HCl →CaCl2 + 2H2O
- Tác dụng với muối:
2KOH + FeCl2 → Fe(OH)2 + 2KCl
- ba giơ không tan phân huỷ Cu(OH)2 → CuO + H2O
Câu 2
Câu 3
O,5
0,5
Điểm
2,5đ
0.5đ
0.5đ
0.5đ
0.5đ
0.5đ
2,5đ
a. Ý nghĩa dãy HĐHH của KL
- Dãy HĐHH của KL được sắp xếp theo chiều giảm dần
- KL trước Mg t/d với nước ở điều kiện thường tạo thành kiềm
và giải phóng H2
- KL đứng trước H phản ứng với một số dd axit (HCl, H2SO4
loãng…) giải phóng khí H2
- KL đứng trước (trừ Na, K…) đẩy KL đứng sau ra khỏi dung
dịch muối.
b. Sắp xếp : K, Mg, Zn, Fe, Cu, Hg.
Thực hiện chuổi chuyển hóa:
1. 4Fe +3O2
t0
2Fe2O3
2. Fe2O3 + 6HC
2FeCl3 + 3H2O
3. FeCl3 + 3KOH
Fe(OH)3 + 3KCl
0
4. 2Fe(OH)3 t
Fe2O3 + 3H2O
Câu 4
0.5đ
0.5đ
0.5đ
0.5đ
O,5đ
2đ
0.5đ
0.5đ
0.5đ
0.5đ
3đ
a. Phương trình hóa học:
2NaOH + SO2
→ Na2SO3 + H2O
b. Xác định chất dư:
- Số mol CO2 = 3,136/ 22,4 = 0,14(mol)
- Số mol NaOH = 12,8/40 = 0,32 (mol)
- Số mol NaOH > số mol CO2 nên NaOH dư sau phản ứng
0,5đ
0,5
0,5
- Khối lượng NaOH dư = (0,32 – 0,28) x 40 = 0,16 gam
c. Khối lượng muối tạo thành:
- Theo PTHH, Số mol Na2SO3= số mol SO2 = 0,14 (mol)
- Khối lượng Na2SO3 = 0,14 x 126 = 17,64 (gam)
Duyệt của BGH
Duyệt của tổ chuyên môn
0,5
0,5
0,5
Giáo viên ra đề