Đề kiểm tra học kì 1 môn hoá lớp 9
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (73.01 KB, 6 trang )
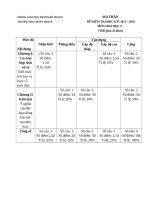
Ma trận đề kiểm tra
Môn hóa học 9
Nội dung kiến
thức
Nhận
biết
1.Phân biệt các loại
chất vô cơ
1câu
1
điểm
10%
2. Tính chất hóa
học của các loại hợp
chất vô cơ
Thông
hiểu
1câu
1
điểm
10%
3. Tớnh cht húa hc ca
kim loi
Tổng số câu
Tổng số điểm
Tỉ lệ %
Vận
dụng
Vận
dụng ở
mức độ
cao
2 câu
5 điểm
50%
1 cõu
1 cõu
1,75 im 1,25 im
17,5%
12,5%
1 câu
1
điểm
10 %
1 câu
1
điểm
10 %
3 câu
6,75
điểm
67,5%
1 câu
1,25
điểm
12,5%
Cộng
1 câu
1
điểm
10%
2 câu
6
điểm
60 %
1 câu
3
điểm
30%
4 câu
10
điểm
100%
Kiểm tra chất lợng học kỳ i
môn hóa học 9
Đề 1:
Câu 1:(1 điểm) Viết công thức hóa học của 2 oxit, 2 axit
Câu 2 (3 điểm) Cho các chất có công thức hoá học
sau:Ca;CaO;Ca(OH)2;CaCl2;CaCO3.
a.Hãy sắp xếp chúng thành chuổi phản ứng hợp lí với 4 biến
đổi?
b.Bằng các phơng trình hoá học hảy hoàn thành chuổi
phản ứng đó?
Câu3:(3 điểm) Chỉ dùng dung dịch H 2SO4 loãng. Hãy nhận biết
các dung dịch: Ba(OH)2;Na2SO4;HCl đựng riêng biệt trong các lọ bị
mất nhản.Viết phơng trình hoá học của phản ứng nếu có
Câu 4:(3 điểm) Cho kim loại sắt tác dụng vừa đủ với 100 ml dung
dịch CuSO45 M. Phản ứng xảy ra hoàn toàn
a.Lập PTHH của phản ứng.
b.Tính khối lợng kim loại Fe đã tham gia phản ứng
c.Tính khối lợng kim loại Cu đã sinh ra sau phản ứng
d.Tính nồng độ phần trăm dung dịch mụối thu đợc sau phản
ứng.Biết rằng khối lợng riêng của dung dịch CuSO45 M là 1,80g/ml
Biết Fe= 56 , Cu = 64 , S = 32 , O = 16
Đáp án và biểu điểm đề 1 - hoá 9:
Câu
Câu 1
Câu 2
Câu 3
Đáp án
a.Sắp xếp hợp lí mỗi trờng hợp đúng 0,25
điểm
Ca(1)>CaO(2)->Ca(OH)2-(3)-->CaCl2-(4)->CaCO3
Lập đúng mỗi PTHH 0,5 đ
1.2Ca
+ O2
2CaO
2.CaO
+
H 2O
Ca(OH)2
3. 2HCl
+ CaO
CaCl2
+ H2O
4. CaCl2
+ Na2CO3
CaCO3
+ 2NaCl
-Lấy mẩu thử và đánh số thứ tự tơng ứng
-Cho H2SO4 vào các mẩu thử .Nếu:
+Có kết tủa trắng là BaCl2.Vì:
Ba(OH)2
+ H2SO4
BaSO 4 +
2H2O
+ Không có hiện tợng gì là:Na2SO4 và HCl
-Dùng Ba(OH)2 vừa nhận đợc cho vào 2 mẩu
thử còn lại.
+ Nếu có kết tủa trắng là:Na2SO4 .Vì:
Ba(OH)2
+ Na2SO4
BaSO4
+ 2NaOH
+ Không có hiện tợng gì là HCl
Điểm
1đ
0,5
0,5
0,5
0,5
đ
đ
đ
đ
0,5 đ
0,25 đ
0,25 đ
0,5 đ
0,25 đ
0,25đ
0,25 đ
0,5 đ
0,25 đ
0,5 đ
0,25 đ
0,25đ
0,25 đ
0,25 đ
0,25 đ
0,25 đ
0,25 đ
0,25đ
0,25 đ
a.PTHH: Fe +
CuSO 4
FeSO 4
+ Cu
nCuSO4 = 5: 100/1000 = 0,5( mol)
0,25 đ
b.Theo PT: nFe = nCuSO4 = 0,5 mol
Vậy mFe = 0,5 . 56 = 28(g)
c.Theo PTHH: nCu = nFe = 0,5 mol
Vây mCu = 0,5 . 64 = 32 (g)
d.Tho PTHH nFeSO4 = nFe = 0,5 mol
Vây mFeSO4 = 0,5 . 152 = 76 (g)
mdd CuSO4 5M = ,80 . 100 = 180 (g)
Khối lợng dung dịch sau phản ứng:
28 + 180 32 = 176 (g)
C% FeSO4 = 76 . 100 / 176 = 43,18%
Kiểm tra chất lợng học kỳ i
môn hóa học 9
Đề 2:
Câu 1:(1 điểm) Viết công thức hóa học của 2 baz, 2 mui
Câu2 (3 điểm) Cho các chất có công thức hoá học
sau:Ba;BaO;Ba(OH)2;BaCl2;BaCO3.
a.Hãy sắp xếp chúng thành chuổi phản ứng hợp lí với 4 biến
đổi?
b.Bằng các phơng trình hoá học hy hoàn thành chuổi
phản ứng đó?
Câu3:(3 điểm) Chỉ dùng dung dịch Na2SO4. Hãy nhận biết các
dung dịch: Ba(OH)2;H2SO4 loãng;HCl đựng riêng biệt trong các lọ bị
mất nhản.Viết phơng trình hoá học của phản ứng nếu có
Câu 4:(3 điểm) Cho kim loại km tác dụng vừa đủ với 100 ml dung
dịch CuSO45 M. Phản ứng xảy ra hoàn toàn
a.Lập PTHH của phản ứng.
b.Tính khối lợng kim loại Zn đã tham gia phản ứng
c.Tính khối lợng kim loại Cu đã sinh ra sau phản ứng
d.Tính nồng độ phần trăm dung dịch mụối thu đợc sau phản
ứng.Biết rằng khối lợng riêng của dung dịch CuSO45 M là 1,80g/ml
Biết Zn= 65 , Cu = 64 , S = 32 , O = 16
Đáp án và biểu điểm đề 2 - hoá 9:
Câu
Câu 1
Câu 2
Câu 3
Đáp án
a.Sắp xếp hợp lí mỗi trờng hợp đúng 0,25
điểm
Ba(1)>BaO(2)->Ba(OH)2-(3)-->BaCl2-(4)->BaCO3
Lập đúng mỗi PTHH 0,5 đ
1.2Ba
+ O2
2BaO
2.BaO
+
H2O
Ba(OH)2
3. 2HCl
+ BaO
BaCl 2
+ H2 O
4. BaCl2
+ Na2CO3
BaCO3
+ 2NaCl
-Lấy mẩu thử và đánh số thứ tự tơng ứng
-Cho Na2SO4 vào các mẩu thử .Nếu:
+Có kết tủa trắng là BaCl2.Vì:
Ba(OH)2
+
Na 2SO4
BaSO4
+ 2NaOH
+ Không có hiện tợng gì là:H2SO4 và HCl
-Dùng Ba(OH)2 vừa nhận đợc cho vào 2 mẩu
thử còn lại.
+ Nếu có kết tủa trắng là:H2SO4 .Vì:
Ba(OH)2
+ H2SO4
BaSO4 +
2H2O
+ Không có hiện tợng gì là HCl
a.PTHH: Zn + CuSO4
ZnSO 4
+ Cu
nCuSO4 = 5: 100/1000 = 0,5( mol)
b.Theo PT: nZn = nCuSO4 = 0,5 mol
Vậy mZn = 0,5 . 65 = 32,5(g)
c.Theo PTHH: nCu = nZn = 0,5 mol
Vây mCu = 0,5 . 64 = 32 (g)
Điểm
1đ
0,5
0,5
0,5
0,5
đ
đ
đ
đ
0,5 đ
0,25 đ
0,25 đ
0,5 đ
0,25 đ
0,25đ
0,25 đ
0,5 đ
0,25 đ
0,5 đ
0,25 đ
0,25đ
0,25 đ
0,25 đ
0,25 đ
0,25 đ
0,25 đ
0,25đ
0,25 đ
0,25 đ
d.Theo PTHH nZnSO4 = nFe = 0,5 mol
Vây mZnSO4 = 0,5 . 161 = 80,5 (g)
mdd CuSO4 5M = 1,80 . 100 = 280 (g)
Khối lợng dung dịch sau phản ứng:
32,5 + 180 32 = 80,5 (g)
C% FeSO4 = 80,5 . 100 / 180,5 = 44,6%
Hải Trạch, ngày 5/12/2011
Giáo viên
thực hiện
Lê
Thị Hoài
Hải trạch, ngày 08 tháng 12 năm
2011
P. Hiệu trởng - P/T CM
(Đã kiểm tra)
Phạm Thị Điệp