Tự chọn (6,). Luyện tập: Axit nitric và muối nitrat
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (141.57 KB, 10 trang )
BÀI TỰ CHỌN (Tiết 6,7)
LUYỆN TẬP AXIT NITRIC,
MUỐI NITRAT
NỘI DUNG
KIẾN THỨC CƠ BẢN
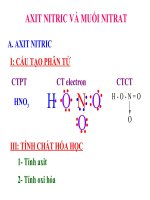
A. AXIT NITRIC
I. Cấu tạo phân tử
II. Tính chất hóa học
III. Điều chế
B. MUỐI NITRAT
Tính chất hóa học của muối nitrat
I. CẤU TẠO PHÂN TỬ
H
O
+5
N
O
O
II. Tính chất hóa học
H
O
+5
HNO3 loãng NO
O
Tác
dụng
với
kim
loại
N
O
Quì tím đỏ
HNO3
Oxit bazơ
Bazơ
Tính
axit
Muối
Chất không có tính khử
Tính
oxi
hoá
HNO3 đặc NO2
Muối nitrat KL
có số oxh cao
Al, Fe, Cr bị thụ
động hóa trong
HNO3 đặc nguội
Tác
dụng
với
phi
kim
C CO2
P H3PO4
S H2SO4
Tác dụng với hợp chất có tính khử
III. Điều chế
a) Trong phòng thí nghiệm:
NaNO3 (r) + H2SO4 (đặc, nóng) → HNO3 + NaHSO4
b) Trong công nghiệp:
+ O2
NH3
+ O2
4NO
+H2O, O2
NO2
HNO3
Tính chất hóa học của muối nitrat
Dễ bị phân hủy thành muối nitrit và oxi.
+ Muối của KL mạnh:
2KNO3 → 2KNO2 + O2.
+ Muối nitrat của KL trung bình, yếu bị phân hủy
thành oxit kim loại tương ứng, NO2 và O2.
2Cu(NO3)2 → 2CuO + 4NO2 + O2.
(Muối nitrat của bạc, vàng, thủy ngân,... bị phân
hủy thành kim loại tương ứng, khí NO2 và O2:
2AgNO3 → 2Ag + 2NO2 + O2)
*) Nhận biết ion nitrat:
Để nhận ra ion NO3-, người ta đun nóng nhẹ dd chứa
NO3- với Cu và H2SO4 loãng:
Câu 1. Cân bằng các phản ứng sau theo phương pháp
thăng bằng electron:
a) Al + HNO3 → ? + N2O + ?.
b) FeO + HNO3 → ? + NO + ?.
c) Fe(OH)2 + HNO3 → ? + NO + ?.
d) Fe3O4 + HNO3 đ → ? + NO2 + ?.
e) Cu + HNO3 đ → ? + NO2 + ?.
f) Mg + HNO3 → ? + N2 + ?.
g) Al + HNO3 → ? + NH4NO3 + ?.
h) Fe3O4 + HNO3 → ? + NO + ?.
Câu 2.
2 Zn phản ứng với dung dịch HNO3 đặc tạo
ra khí NO2. Tổng các hệ số các chất tham gia
trong phương trình phản ứng này bằng
A. 10
B. 5
C. 6
D. 8
Zn + 4 HNO3 đặc Zn(NO3)2 +2NO2 + 2H2O
Câu 3. Cho 6,5g Zn tác dụng hết với dung dịch
HNO3 đặc tạo ra khí NO2 duy nhất. Thể tích khí
NO2 thu được là
A. 1,12 lít
B. 5,6 lít
C. 2,24 lít
D. 4,48 lít
Câu 4.
Cho 8,1g Al tác dụng hoàn toàn với dung dịch
HNO3 dư tạo ra V lít khí NO (đktc). Xác định V?
A. 6,72
B. 3,36
C. 1,12
D. 4,48
Câu 5. Cho 3,024 gam một kim loại M tan hết trong
dung dịch HNO3 loãng, thu được 940,8 ml khí NxOy
(sản phẩm khử duy nhất, ở đktc) có tỉ khối đối với
H2 bằng 22. Khí NxOy và kim loại M là
A. NO và Mg.
B. NO2 và Al.
C. N2O và Al.
D. N2O và Fe.
Câu 6.
Nhận biết dung dịch các chất sau bằng phương
pháp hóa học:
a. NH3, Na2SO4, NH4Cl, (NH4)2SO4.
b. NH4NO3, NaNO3, FeCl3, Na2SO4.
c. NH4NO3, NaCl, FeCl3, (NH4)2SO4.
d. NH4NO3, NH4Cl, (NH4)2SO4, (NH4)2CO3.
e. Na2SO4, NaNO3, (NH4)2SO4, NH4Cl (chỉ dùng
một thuốc thử)
f. Na3PO4, (NH4)3PO4, NaNO3.
g. H3PO4, BaCl2, Na2CO3, (NH4)2SO4 (chỉ dùng
dung dịch HCl)