ẢNH HƯỞNG của PHÂN SINH học và DỊCH lên MEN của VI KHUẨN đến SINH TRƯỞNG và NĂNG SUẤT KHÓM QUEEN (ananas comosus l merr)
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (4.08 MB, 57 trang )
BỘ GIÁO DỤC VÀ ĐÀO TẠO
TRƯỜNG ĐẠI HỌC CẦN THƠ
VÕ THỊ DIỄM TRINH
ẢNH HƯỞNG CỦA PHÂN SINH HỌC VÀ DỊCH
LÊN MEN CỦA VI KHUẨN ĐẾN SINH
TRƯỞNG VÀ NĂNG SUẤT KHÓM
QUEEN (Ananas comosus L. Merr)
LUẬN VĂN TỐT NGHIỆP KỸ SƯ
Ngành NÔNG HỌC
Cần Thơ, 2010
BỘ GIÁO DỤC VÀ ĐÀO TẠO
TRƯỜNG ĐẠI HỌC CẦN THƠ
LUẬN VĂN TỐT NGHIỆP KỸ SƯ
ẢNH HƯỞNG CỦA PHÂN SINH HỌC VÀ DỊCH
LÊN MEN CỦA VI KHUẨN ĐẾN SINH
TRƯỞNG VÀ NĂNG SUẤT KHÓM
QUEEN (Ananas Comosus L. Merr)
Người hướng dẫn khoa học
Sinh viên thực hiện
VÕ THỊ DIỄM TRINH
(3061029)
Lớp Nông Học K32
TS. LÊ VĂN BÉ
Cần Thơ, 2010
BỘ GIÁO DỤC VÀ ĐÀO TẠO
TRƯỜNG ĐẠI HỌC CẦN THƠ
Chứng nhận luận văn tốt nghiệp với đề tài: “ẢNH HƯỞNG CỦA PHÂN SINH
HỌC VÀ DỊCH LÊN MEN CỦA VI KHUẨN ĐẾN NĂNG SUẤT VÀ PHẨM
CHẤT KHÓM QUEEN (Ananas Comosus L. Merr)”. Do sinh viên Võ Thị
Diễm Trinh thực hiện và đề nạp.
Kính trình Hội đồng chấm luận văn tốt nghiệp.
Cần Thơ, ngày
tháng
năm 2010
Cán bộ hướng dẫn
(Ký tên)
TS. Lê Văn Bé
i
BỘ GIÁO DỤC VÀ ĐÀO TẠO
TRƯỜNG ĐẠI HỌC CẦN THƠ
Hội đồng chấm luận văn tốt nghiệp đã chấp thuận luận văn đính kèm với đề tài:
“ẢNH HƯỞNG CỦA PHÂN SINH HỌC VÀ DỊCH LÊN MEN CỦA VI
KHUẨN ĐẾN NĂNG SUẤT VÀ PHẨM CHẤT KHÓM QUEEN (Ananas
Comosus L. Merr)”. Do sinh viên Võ Thị Diễm Trinh thực hiện, bảo vệ trước Hội
đồng và đã được Hội đồng thông qua.
Luận văn đã được đánh giá ở mức………......
Ý kiến của Hội đồng:
………………………………………………………………………………………
………………………………………………………………………………………
…….…………………………………………………………………………………
Phản biện 1
(ký tên)
----------------------
Phản biện 2
(ký tên)
Ủy viên
(ký tên)
----------------------
---------------------
Cần Thơ, ngày tháng năm 2010
Chủ tịch Hội đồng
DUYỆT CỦA KHOA
Chủ nhiệm
ii
LÝ LỊCH
I/ SƠ LƯỢC:
Họ và tên: Võ Thị Diễm Trinh
Giới tính: Nữ
Ngày sinh: 01/11/1988
Dân tộc: Kinh
Nơi sinh: xã Bình Hòa, huyện Châu Thành, tỉnh An Giang.
Thường trú tại: P17-C12, Ký túc xá Sinh viên An Giang, Khu II Đường 3/2, quận
Ninh Kiều, Thành phố Cần Thơ.
Con Ông: Võ Tấn Đức
và Bà: Huỳnh Thị Sương
Sinh năm: 1953
Sinh năm: 1954
Nghề nghiệp: Mua bán
Tel: 0129.3909318
E-mail:
II/ QUÁ TRÌNH HỌC TẬP:
+ 1994 - 1999: học Trường Tiểu học A Bình Hòa.
Địa chỉ: ấp Phú Hòa I, xã Bình Hòa, huyện Châu Thành, tỉnh An Giang.
+ 1999 - 2003: học Trường Trung học Cơ sở Quản Cơ Thành.
Địa chỉ: ấp Phú Hòa I, xã Bình Hòa, huyện Châu Thành, tỉnh An Giang.
+ 2003 - 2006: học Trường Trung học Phổ thông Chuyên Thoại Ngọc Hầu.
Địa chỉ: 5B Tôn Đức Thắng, Thành phố Long Xuyên, tỉnh An Giang.
Tốt nghiệp Trung học Phổ thông năm 2006 và vào Trường Đại học Cần Thơ theo
học ngành Nông học, khóa 32 (2006 - 2010) thuộc khoa Nông nghiệp & Sinh học
Ứng dụng đến nay.
iii
LỜI CẢM TẠ
Kính dâng lên Mẹ, Ba và cậu Út
Suốt đời tận tụy, hy sinh vì tương lai và sự nghiệp của con cháu.
Đã nuôi nấng, dạy dỗ con khôn lớn thành người.
Xin tỏ lòng tri ân sâu sắc đến
Thầy Lê Văn Bé Bộ môn Sinh lý - Sinh hóa, khoa Nông nghiệp & Sinh học Ứng
dụng, Đại học Cần Thơ đã tận tình hướng dẫn, giúp đỡ về vật chất và tinh thần cũng
như cung cấp kiến thức và kinh nghiệm quý báu cho em trong suốt quá trình thực
hiện luận văn này.
Xin gửi lời cảm ơn chân thành
Anh Nguyễn Văn Kha đã nhiệt tình giúp đỡ, đóng góp ý kiến tạo điều kiện cho
em hoàn thành tốt đề tài.
Các bạn Võ Văn Nhiều, Hồ Thị Linh, Nguyễn Thị Thúy Hằng, Nguyễn An
Suyên, Tống Hồ Nam, Lê Thị Băng Tuyền và Nguyễn Minh Thuận đã giúp mình
thu hoạch và ghi chép số liệu trong vụ khóm vừa qua.
Xin khắc ghi công ơn của các thầy cô Đại học Cần Thơ đã giảng dạy và truyền
thụ kiến thức cho em trong suốt 4 năm qua. Đó là động lực và hành trang trong sự
nghiệp của em sau này.
Kính gửi đến Cô Cố vấn Học tập đã dìu dắt, dạy bảo chúng em vượt qua những
trở ngại khó khăn trong học tập suốt khóa học. Chúng em mong cô luôn được nhiều
sức khỏe làm việc và công tác tốt.
Các anh (chị) và các bạn đã giúp đỡ cho em trong suốt khóa học.
Thân gửi đến tập thể lớp Nông học K32 những tình cảm và lời chúc tốt đẹp nhất.
Võ Thị Diễm Trinh
iv
LỜI CAM ĐOAN
Tôi xin cam đoan đây là công trình nghiên cứu của bản thân. Tất cả các số liệu,
kết quả trình bày trong luận văn tốt nghiệp là trung thực và chưa từng được ai công
bố ở bất kỳ công trình luận văn nào trước đây.
Tác giả luận văn
(Ký tên)
Võ Thị Diễm Trinh
v
Võ Thị Diễm Trinh. 2010. Ảnh hưởng của phân sinh học và dịch trích vi khuẩn đến
năng suất và phẩm chất khóm Queen (Ananas Comosus L. Merr). Luận văn tốt
nghiệp kỹ sư Nông học, Khoa Nông Nghiệp và Sinh Học Ứng Dụng, Đại học Cần
Thơ.
TÓM LƯỢC
Vi khuẩn Gluconacetobacter diazotrophicus và Pseudomonas stutzeri có khả
năng cố định nitơ, tổng hợp IAA và hòa tan lân sống nội sinh được sử dụng trong
thí nghiệm nhằm so sánh sinh trưởng, phát triển và năng suất của cây khóm Queen
‘Cầu Đúc’ khi sử dụng các dạng chế phẩm phân sinh học và dịch lên men vi khuẩn
này với phân vô cơ trên vùng đất phèn. Kết quả cho thấy, bón phân vi sinh và dịch
trích vi khuẩn lên men kết hợp với phân vô cơ làm tăng chiều cao cây và chiều dài
lá D cao hơn so với bón phân vô cơ thuần. Nghiệm thức bón đủ phân vô cơ cho chỉ
số SPAD, trọng lượng trái, số chồi và trọng lượng chồi cuống tương đương với
nghiệm thức 90 N + 45 P2O5 + 100 kg phân sinh học + 500 lít dịch vi khuẩn lên
men. Số lá, dài lá D, thể tích rễ, tỷ lệ nước/xơ và độ brix không khác biệt giữa các
nghiệm thức. Tuy nhiên, ở các nghiệm thức có bón phân vi sinh và dịch trích vi
khuẩn lên men có xu hướng gia tăng số lá, dài lá D, thể tích rễ, tỷ lệ nước/xơ và độ
brix so với nghiệm thức đối chứng (chỉ bón kali) và nghiệm thức bón đủ đạm-lânkali.
vi
MỤC LỤC
Tựa
1.1
1.2
1.2.1
1.2.2
1.2.3
1.2.4
1.2.5
1.2.6
1.3
1.3.1
1.3.2
1.3.3
2.1
2.1.1
2.1.2
2.1.3
2.2
2.2.1
2.2.2
2.2.2.1
2.2.2.2
2.2.2.3
2.2.3
2.2.3.1
Trang
Tóm lược
Danh sách hình
Danh sách bảng
Mở đầu
vii
x
xi
1
CHƯƠNG 1. LƯỢC KHẢO TÀI LIỆU
2
Phân loại
Đặc điểm thực vật cây khóm
Thân
Lá
Rễ
Chồi
Hoa
Trái
Phân vi sinh
Định nghĩa
Vai trò vi sinh vật đối với đất trồng
Một số vi sinh vật có khả năng cố định đạm và hòa tan lân
Vi khuẩn cố định đạm
Vi khuẩn hòa tan lân
2
2
2
2
3
4
4
5
5
5
5
6
6
7
CHƯƠNG 2. PHƯƠNG TIỆN VÀ PHƯƠNG PHÁP
11
Phương tiện
Thời gian và địa điểm thí nghiệm
Đối tượng nghiên cứu
Vật liệu thí nghiệm
Phương pháp
Mục tiêu thí nghiệm
Phương pháp tiến hành
Bố trí thí nghiệm
Địa điểm thí nghiệm
Kỹ thuật canh tác
Các chỉ tiêu theo dõi
Sinh trưởng của cây khóm
11
11
11
11
12
12
12
12
12
13
14
14
2.2.3.2 Năng suất và chất lượng của trái khóm
CHƯƠNG 3. KẾT QUẢ VÀ THẢO LUẬN
vii
14
15
3.1.1
Ảnh hưởng của các công thức phân lên quá trình sinh trưởng và năng
suất của cây khóm ở điểm thí nghiệm thứ nhất tại hộ Bà Chiêm Thị
Lũy
Sinh trưởng và phát triển của cây
3.1.2
3.1.3
3.1.4
3.1.5
Một vài thông số của lá D
Thể tích rễ
Chỉ số SPAD
Năng suất và phẩm chất trái
3.2
3.2.1
3.2.2
Ảnh hưởng của các công thức phân lên quá trình sinh trưởng và năng
suất của cây khóm ở điểm thí nghiệm thứ hai tại hộ Ông Võ Văn Sạng
Sinh trưởng và phát triển của cây
Một vài thông số của lá D
3.2.3
3.2.4
Thể tích rễ
Năng suất và phẩm chất trái
27
27
KẾT LUẬN VÀ ĐỀ NGHỊ
32
TÀI LIỆU THAM KHẢO
33
3.1
15
15
16
18
18
20
PHỤ CHƯƠNG
viii
24
24
25
DANH SÁCH HÌNH
Tựa
Trang
Hình 1.1
Vi khuẩn Gluconacetobacter diazotrophicus
7
Hình 1.2
Các dạng khuẩn lạc của vi khuẩn Pseudomonas stutzeri
10
Hình 2.1
Chồi khóm Queen 'Cầu Đúc' được sử dụng làm vật liệu trồng
11
Hình 3.1
Ảnh hưởng của các công thức phân bón khác nhau đến chỉ số SPAD
20
Hình 3.2
Trái khóm vào thời điểm thu hoạch tại hộ Bà Chiêm Thị Lũy
22
Hình 3.3
Trái khóm vào thời điểm thu hoạch tại hộ Ông Võ Văn Sạng
29
ix
DANH SÁCH BẢNG
Tựa
Trang
Bảng 3.1
Ảnh hưởng của các công thức phân bón đến sự phát triển thân và
lá cây khóm Queen
15
Bảng 3.2
Ảnh hưởng của các công thức phân bón đến sự phát triển lá D cây
khóm Queen
17
Bảng 3.3
Ảnh hưởng của các công thức phân bón đến sự phát triển rễ của
cây khóm Queen
18
Bảng 3.4
Ảnh hưởng của các công thức phân bón đến chỉ số SPAD
19
Bảng 3.5
Ảnh hưởng của các công thức phân bón đến các thông số trọng
lượng trái, số chồi cuống và trọng lượng chồi cuống
21
Bảng 3.6
Ảnh hưởng của các công thức phân bón đến độ Brix và hàm lượng
nước/xơ
23
Bảng 3.7
Ảnh hưởng của các công thức phân bón đến sự phát triển của cây
khóm Queen vào thời điểm thu hoạch
24
Bảng 3.8
Ảnh hưởng của các công thức phân bón đến sự phát triển lá D cây
khóm Queen
26
Bảng 3.9
Ảnh hưởng của các công thức phân bón đến sự phát triển rễ của
cây khóm Queen
27
Bảng 3.10
Ảnh hưởng của các công thức phân bón đến các thông số trọng
lượng trái, số chồi cuống và trọng lượng chồi cuống
28
Bảng 3.11
Ảnh hưởng của các công thức phân bón đến độ Brix và hàm lượng
nước/xơ
30
x
MỞ ĐẦU
Khóm là một trong những loại cây ăn trái quan trọng ở nước ta, là loại cây chủ lực
trên vùng đất phèn. Hậu Giang là tỉnh có diện tích đất trồng khóm lớn ở đồng bằng
sông Cửu Long, nổi tiếng với thương hiệu khóm Cầu Đúc (xã Hỏa Tiến, thị xã Vị
Thanh). Hiện nay, lợi nhuận từ cây khóm mang lại chưa cao do chi phí đầu tư về giống
và phân bón (chủ yếu là phân hóa học) còn rất cao. Nghiên cứu ứng dụng một số loài
vi khuẩn có khả năng cố định đạm và lân để thay thế hoặc giảm lượng phân hóa học
cho cây trồng, giảm giá thành sản xuất và tăng lợi nhuận là xu hướng hiện nay.
Theo Cao Ngọc Điệp (2007), dòng vi khuẩn Gluconacetobacter diazotrophicus và
Pseudomonas stutzeri được thử nghiệm trên nhiều loại cây trồng ở hai dạng chất mang
và dạng dịch trích vi khuẩn lên men đem lại hiệu quả cao, thay thế 50% lượng phân
hóa học ở cây đậu nành mà năng suất không thay đổi. Ngoài ra, dòng P. stutzeri có khả
năng tổng hợp IAA (Indole – 3 – acetic acid) cao (trung bình 26,118 µg/ml) giúp tăng
khả năng sinh trưởng của cây trồng.
Trên đất phèn, hàm lượng hữu cơ cao nhưng mật số vi sinh thấp nên không thể
khoáng hóa chất hữu cơ để cung cấp dinh dưỡng cho cây trồng (Ngô Thị Đào và Vũ
Hữu Yêm, 2005). Trên thực tế, việc nghiên cứu hướng cải thiện tính chất đất bằng
những vi khuẩn có khả năng cố định đạm, hòa tan lân và tổng hợp kích thích tố cung
cấp cho cây trồng trên vùng đất phèn nhằm giảm chi phí lượng phân hóa học bón cho
cây khóm là điều rất cần thiết. Vì vậy đề tài: “Ảnh hưởng của phân vi sinh và dịch
vi khuẩn lên men đến sinh trưởng và năng suất khóm Queen (Ananas comosus L.
Merr.)” được thực hiện để đáp ứng mục tiêu trên.
1
CHƯƠNG 1
LƯỢC KHẢO TÀI LIỆU
1.1 PHÂN LOẠI
Theo Luther và Sieff (1998), cây khóm thuộc họ Bromeliaceae, chi Ananas. Các
giống khóm đang được trồng trọt hiện nay thuộc loài Ananas comosus (Linn.) Merr.
Đường Hồng Dật (2000), cho rằng loài này được chia thành 7 nhóm, trong đó có 3
nhóm chính là: Cayen, Queen và Spanish.
Khóm Cầu Đúc thuộc giống Queen, nguồn gốc Thái Lan. Theo Bộ Nông nghiệp
và Phát triển Nông thôn, khóm Cầu Đúc của Hậu Giang thuộc tiểu nhóm “Queen cổ
điển”. Nét riêng của giống khóm này là trái có hình dáng thanh nhã, cuống ngắn, lõi
nhỏ, mắt lồi, hố mắt hơi sâu, thịt màu vàng đậm, ít xơ, ít nước, ăn giòn, ngọt. Đặc
biệt, trái khóm Cầu Đúc có thể dự trữ khoảng 10 - 15 ngày mà không bị thối (báo Cần
Thơ, số 1619 ).
1.2 ĐẶC ĐIỂM THỰC VẬT CÂY KHÓM
1.2.1 Thân
Theo Trần Thế Tục và Vũ Mạnh Hải (2000), thân cây khóm gồm phần thân trên
mặt đất và thân dưới mặt đất. Phần thân trên mặt đất bị các lá bao quanh nên khó nhìn
thấy. Trên mỗi đốt của thân cây có những mầm ngủ, các mầm ngủ này sẽ phát triển
khi cây khóm đã phát triển đến mức độ nhất định. Thân cây khóm trưởng thành dài 20
- 30 cm, đường kính 3 - 7 cm, trọng lượng 200 - 400 g.
1.2.2 Lá
Đỗ Huy Bích và ctv., (2004), cho rằng số lá cực đại đến khi ra hoa từ 50 - 80 lá.
Các giống khóm khác nhau có số lá không giống nhau như Cayen có 60 - 70 lá,
Philippine có 40 - 50 lá, Spanish có 50 - 60 lá và giống Đài Loan có 30 - 40 lá (Trần
Thế Tục và Vũ Mạnh Hải, 2000).
Theo Monnerat et al., (2004), khóm Queen được trồng trong điều kiện đầy đủ
dưỡng chất cho số lá trung bình là 55,2 lá và trọng lượng tươi lá D trung bình 47,9 g.
Khi khuyết dưỡng lân thì số lá và trọng lượng lá có xu hướng giảm nhưng khác biệt
không ý nghĩa so với bón đầy đủ dưỡng chất. Tuy nhiên, khi khuyết chất đạm thì số lá
trung bình giảm còn 48 lá và trọng lượng lá D trung bình 27,1g (khác biệt có ý nghĩa
ở mức 5%).
Trần Thế Tục và Vũ Mạnh Hải (2000), cho rằng độ lớn nhỏ của lá tùy thuộc vào
giống và điều kiện ngoại cảnh. Nhiệt độ và ẩm độ cao như ở vùng xích đạo kết hợp
với dinh dưỡng cung cấp cân đối đạm-lân-kali, thì lá khóm sinh trưởng mạnh, số lá
nhiều, lá to và rộng.
2
Lá giữ vai trò quan trọng trong quá trình quang hợp, vì vậy kích thước và màu sắc
lá phản ánh rõ tình trạng sinh lý của cây. Màu xanh của lá được quyết định bởi hàm
lượng các sắc tố, chủ yếu là diệp lục tố, diệp lục tố cần thiết cho sự quang hợp của cây
trồng. Khi lượng đạm trong lá cao, thì lượng diệp lục tố cao và lá trở nên xanh đậm,
và ngược lại nếu lượng đạm trong lá thấp thì lá xanh nhạt (Trương Thị Minh Giang,
2006).
Đinh Vũ Thanh và Đoàn Doãn Tuấn (2006), cho rằng cây khóm có thể sống qua
khỏi thời gian dài khô cạn do khả năng giữ nước của nó trong lá, tuy nhiên cây khóm
nhạy cảm với sự thiếu nước, đặc biệt trong thời gian sinh trưởng sinh dưỡng, khi kích
thước và đặc điểm quả được xác định.
Sideris và Krauss (1936), đã định nghĩa lá D là lá dài nhất so với các lá còn lại,
việc phân tích lá D sẽ cho kết quả chính xác về mức độ sinh trưởng và tình trạng dinh
dưỡng cây trồng.
Sự phát triển của lá D có liên quan chặt đến sự tăng trưởng của khóm, trọng lượng
lá D cao biểu hiện cho sự tăng trưởng tốt và đạt năng suất cao (Phạm Gia Tân, 1984).
Bhugaloo (1998), cho rằng các liều lượng phân đạm có ảnh hưởng đến chiều dài
lá, khi không bón đạm thì lá vẫn dài trung bình 80 cm, khi lượng đạm tăng thì chiều
dài lá khác biệt có ý nghĩa so với không bón đạm và khi lượng phân đạm cao hơn 560
kg urea/ha (tương đương với 18,67 g N/cây) thì chiều dài lá giảm ở mức ý nghĩa 5%.
Bên cạnh đó các chỉ tiêu về chiều rộng và trọng lượng lá thì không khác biệt.
Theo Monnerat et al. (2004), chiều dài lá trung bình là 68cm và chiều rộng trung
bình là 5,27 cm khi cây được bón phân đầy đủ. Khi bón khuyết phân đạm thì chiều
dài lá trung bình giảm còn 56,5 cm và chiều rộng trung bình giảm còn 4,02 cm.
Theo Trương Thị Minh Giang (2006), chỉ số SPAD (Soil Plant Analysis
Development) thể hiện khả năng hấp thu và tích lũy đạm trên lá, chỉ số SPAD cao
tương ứng với màu xanh đậm của lá.
1.2.3 Rễ
Nguyễn Bảo Vệ và Lê Thanh Phong (2004), cho rằng rễ khóm có 3 nhóm: rễ sơ
cấp, rễ phụ và rễ thứ cấp. Rễ sơ cấp phát sinh từ phôi của hột, rễ phụ mọc trên thân,
phát sinh từ hệ thống mạch giữa vỏ và trung trụ, là loại rễ quan trọng nhất của cây. Rễ
thứ cấp (rễ nhánh) là những rễ nhỏ mọc ra từ rễ phụ.
Rễ khóm thuộc loài ăn nông, khóm được nhân giống bằng chồi cho nên phần lớn
rễ mọc ra từ thân. Rễ khóm nhỏ và phân nhánh nhiều, hệ thống rễ khóm thường tập
trung ở tầng đất mặt 10 - 26 cm và lan rộng ra chung quanh đến 1 m. Rễ khóm thuộc
loại háo khí, ưa đất xốp và thoáng (Đường Hồng Dật, 2000; Đinh Vũ Thanh và Đoàn
Doãn Tuấn, 2006).
3
Theo Phạm Duy Tiễn (2009), thì có sự tương quan về chiều dài của rễ và trọng
lượng rễ, nghĩa là khi chiều dài rễ ngắn dẫn đến trọng lượng rễ thấp. Yếu tố độ xốp và
tầng canh tác là nguyên nhân chính làm ảnh hưởng phát triển chiều dài của rễ.
Rễ khóm rất mẫn cảm với điều kiện ngập nước, trên liếp thấp cây khóm cho năng
suất cao hơn so với trên liếp cao (Samson, 1986 trích dẫn bởi Lê Quang Trí và ctv.,
1997).
1.2.4 Chồi
Theo Đỗ Huy Bích và ctv. (2004), khóm có 3 loại chồi: chồi ngọn, chồi cuống và
chồi nách.
- Chồi ngọn là chồi đồng đều nhất, loại chồi này mọc khỏe, lớn nhanh nhưng lâu ra
quả hơn so với chồi nách.
- Chồi cuống thường ít, kích thước không đều, mọc chậm, thường phải nuôi trong
vườn ươm đến một thời gian cho đạt kích thước cần thiết mới đem trồng.
- Chồi nách chỉ phát sinh sau khi cây khóm ra hoa, chồi nách được coi là con
giống tốt nhất vì to, nặng, dự trữ nhiều chất dinh dưỡng, lâu thối, có thể để được trong
5 tháng để chờ cho đủ số lượng cần thiết rồi mới trồng. Cây trồng từ chồi nách ra hoa
tương đối sớm. Tuy nhiên số lượng chồi nách thường ít, sau khi thu hoạch quả phải
chăm sóc cây một thời gian cho chồi nách phát triển đủ lớn mới có thể thu chồi.
Phạm Kim Hồng Phúc và Nguyễn Văn A (2000), cho rằng chồi ngọn cho trái to
nhưng thời gian trồng lâu, chồi nách cho trái nhanh nhưng trái nhỏ và chồi cuống ở
gốc thì trồng lâu mới có trái.
1.2.5 Hoa
Hoa khóm là hoa lưỡng tính, theo Nguyễn Bảo Vệ và Lê Thanh Phong (2004), hoa
gồm có 1 lá bắc, 3 lá đài mập, 3 cánh hoa có màu tím nối liền thành một ống, 6 nhị
đực và 1 vòi nhụy cái. Bầu noãn chia thành ba ngăn với vách ngăn dày. Trên trái, hoa
xếp theo hai vòng xoắn ốc. Vòng xoắn theo chiều dốc nhiều chứa khoảng 8 - 10 hàng,
chiều dốc ít thì chứa khoảng 11 - 13 hàng. Hoa thường nở vào buổi sáng, khoảng 8 10 hoa mỗi ngày nên mất 15 - 20 ngày mới nở hết hoa trên trái. Hoa trong cùng một
giống trồng thì không thụ phấn được, trừ khi lai với giống khác (nếu thụ phấn, mỗi
trái khóm có thể cho đến 3000 hột). Có khoảng 100 - 200 hoa trên mỗi trái.
1.2.6 Trái
Trái khóm là loại quả kép do 100 - 150 quả nhỏ hợp lại. Các giống khác nhau thì
hình dạng quả và mắt quả (quả nhỏ) cũng khác nhau như dưa tây có hình bầu dục và
mắt lồi, khóm ta hình ống và mắt quả to (Trần Thế Tục và Vũ Mạnh Hải, 2000).
4
Theo Đinh Vũ Thanh và Đoàn Doãn Tuấn (2006), quả khóm chứa 80 - 85 % lượng
nước và 10 - 14 % đường. Lượng nước tưới có ảnh hưởng đến tỷ lệ đường/acid trong
quả, nhất là trong thời gian trước khi thu hoạch, tưới nhiều lần sẽ làm giảm lượng
đường, đồng thời tăng nguy cơ nấm bệnh phát triển.
Bhugaloo (1998), nghiên cứu thấy rằng quả khóm có trọng lượng trái trung bình là
647 g khi không bón phân đạm, khi bón phân đạm từ 140 - 560 kg urea/ha cho trọng
lượng trái cao nhất và khác biệt có ý nghĩa so với đối chứng (không bón đạm). Khi
tăng lượng phân đạm lên mức 700 và 840 kg urea/ha cho trọng lượng trái không khác
biệt so với không bón phân đạm. Bên cạnh đó, độ Brix không khác biệt giữa các
nghiệm thức có bón phân và không bón phân đạm, độ Brix trung bình dao động trong
khoảng 15,1 - 16,0%.
1.3 PHÂN VI SINH
1.3.1 Định nghĩa
Herren (2006), cho rằng muốn tạo được một sản phẩm nông nghiệp hữu cơ thì nhất
thiết phải có phân hữu cơ sinh học.
Theo Nguyễn Thế Đặng và ctv., (2008) phân hữu cơ vi sinh là loại sản phẩm phân
bón được tạo thành thông qua quá trình lên men vi sinh vật. Dưới tác động của vi sinh
vật các hợp chất hữu cơ trong đất sẽ được chuyển hóa thành các thành phần dinh
dưỡng cho cây. Vi sinh vật có khả năng thúc đẩy nhanh quá trình chuyển hóa rác thải
hữu cơ thành phân bón như Aspergillus ninger, Trichoderma reeser, Penicilium sp.,
Paeceilomyses…
1.3.2 Vai trò vi sinh vật đối với đất trồng
Hàng năm có khoảng 120 - 160 triệu tấn nitơ khí quyển được cố định và chuyển
hóa thành phân nhờ các vi sinh vật có khả năng cố định đạm sinh học trong tự nhiên
(Alan Gibson, 1995) gấp 2 lần lượng phân sản xuất từ nhà máy trên thế giới. Cố định
đạm sinh học là quá trình được thực hiện bởi vi khuẩn, trong đó nitơ phân tử được
biến đổi thành dạng nguyên tử, sau đó thành dạng đạm vô cơ phân tử amonia, tiếp đó
vi khuẩn sẽ chuyển hóa tiếp một phần thành dạng acid amin hữu cơ để sử dụng cho
bản thân vi khuẩn.
Theo Võ Thị Gương (2002), vi sinh vật chuyển hóa chất hữu cơ và cải thiện cấu
trúc lý hóa của đất, bản thân vi sinh vật khi chết đi cũng là nguồn chất hữu cơ và được
phân hủy để cung cấp dinh dưỡng cho cây trồng.
Thành phần dinh dưỡng của phân hữu cơ vi sinh phụ thuộc vào nguồn gốc chất hữu
cơ ban đầu, vi sinh vật và điều kiện cho vi sinh vật phân giải chất hữu cơ (Decoteau,
2005).
5
Thông qua hoạt động của vi sinh vật, các chất hữu cơ phân hủy biến thành mùn,
mùn sẽ liên kết các hạt đất phân tán làm cho đất có cấu trúc tốt, thoáng khí, tăng độ
xốp, tăng hoạt động cho vi sinh vật, giữ phân và giữ nước tốt (Lê Văn Khoa và ctv.,
1999; Nguyễn Thành Nguyện, 2008).
Phân vi sinh chỉ hoạt động tốt trong môi trường trung tính và có nhiều thức ăn phù
hợp. Trong môi trường biến động, vi sinh vật giảm hoạt động và giảm mật số. Vì thế,
khi sử dụng phân vi sinh trên đất phèn cần trung hòa độ chua, tạo điều kiện cho vi
sinh vật phát triển, thúc đẩy sự chuyển hóa khoáng trong đất (Ngô Thị Đào và Vũ
Hữu Yêm, 2005).
Theo Nguyễn Đặng Nghĩa (2005), bón phân hữu cơ vi sinh chỉ có thể thay thế tối
đa 30% lượng phân vô cơ, nếu lượng phân vô cơ bị giảm đến 50% sẽ không tạo ra sự
khác biệt so với trọng lượng hạt bắp so với đối chứng là bón đầy đủ.
1.3.3 Một số vi sinh vật có khả năng cố định đạm và hòa tan lân
Vi sinh vật có khả năng sản xuất enzyme phân hủy các hợp chất hữu cơ như
cellulase, lignase, xylase, chitinase, protease, lipase… đồng thời có khả năng tổng hợp
các chất kích thích sinh trưởng như auxin, gibberellin acid, cytokinin (Trần Thượng
Tuấn, 2004).
Nguyễn Kim Anh và ctv. (2008), nghiên cứu trên loại đất canh tác khác nhau (trồng
lúa, trồng màu, đất bỏ hoang) tại Hòa Quý, Ngũ Hành Sơn, thành phố Đà Nẵng đã
phân lập được 8 chủng vi khuẩn có khả năng cố định nitơ và chất điều hòa sinh trưởng
thuộc chi Azotobacter. Trong đó, chủng BK-6 có khả năng cố định nitơ mạnh nhất
(3,28 mg/ml), chủng BK-5 có khả năng tổng hợp IAA mạnh (4,313 µg/ml).
* Vi khuẩn cố định đạm
Gluconacetobacter diazotrophicus là một vi khuẩn nội sinh được tìm thấy đầu tiên
ở cây mía, loài vi khuẩn này thường hiện diện ở những vùng đất có bón lượng phân
đạm thấp. Vi khuẩn G. diazotrophicus có khả năng cố định đạm và tổng hợp IAA
(Lee et al., 2004).
Theo Kennedy (2002) vi khuẩn G. diazotrophicus sống nội sinh, cố định nitơ để
cung cấp cho cây, đồng thời G. diazotrophicus có khả năng tổng hợp IAA (acid acetic
indole) cung cấp cho cây.
G. diazotrophicus là vi khuẩn Gram âm, sống nôi sinh trong những cây giàu đường,
có khả năng cố định lượng lớn nitơ từ khí quyển (Prabudoss and Stella, 2009).
Mart’inez-Fleites et al., (2005) cho biết vi khuẩn G. diazotrophicus có khả năng cố
định nitơ hiệu quả được biết đến trên hầu hết các loại cây trồng giàu đường và cố định
đáng kể lượng lớn khí nitơ trong khí quyển. Hiện nay đã phân lập được 7 dòng G.
6
diazotrophicus trên cây mía (rễ, thân, chồi và lá), khoai lang, khóm và mía hoang dại
được ký hiệu theo thứ tự là GdSR, GdSS, GdSB, GdSL, GdSP, GdPA và GdWC.
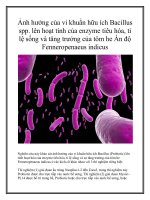
Hình 1.1 Vi khuẩn Gluconacetobacter diazotrophicus PAl 5 (Theo Lee et al., 2004)
* Vi khuẩn hòa tan lân
Đối với vi khuẩn có khả năng hoà tan lân, người ta đã xác định được khoảng 857
loài (Kyuma et al., 1976). Yahya và Azawi (1989) nhận thấy những vi khuẩn có khả
năng hoà tan lân là nhờ các enzyme và acid hữu cơ hoà tan các hợp chất khó tan như:
acid gluconic, acid oxalic, acid citric, acid butyric, acid monolic, và acid 2ketogluconic. Trong đất vi khuẩn hoà tan lân hiện diện với số lượng khác nhau (Khan
và Bhatnagar, 1997).
Một lượng lớn vi khuẩn hoà tan lân sống trong vùng rễ và ảnh hưởng đến sự phát
triển của cây (Sperber, 1958; Glick, 1995). Vi khuẩn hoà tan lân được phân lập ở các
vùng rễ của nhiều loài thực vật khả năng hoạt động cao hơn các vùng khác. Trong
trường hợp đất thiếu lân, người ta sử dụng nhóm vi sinh vật hoà tan lân làm phân sinh
học để bón cho cây trồng.
Cơ chế của quá trình phân giải phosphate của vi sinh vật đến nay vẫn chưa được
hiểu đầy đủ và còn nhiều tranh cãi. Sản sinh acid hữu cơ có thể là nguyên nhân chủ
yếu, song CO2, H2S, acid, kiềm cũng là các yếu tố được nhiều nhà nghiên cứu đề cập
đến. Trong môi trường nuôi cấy mô nhân tạo, người ta thấy rằng khi vi sinh vật phát
7
triển thì pH môi trường bị giảm, do acid acetic, lactic, formic, gluconic, oxalic,
succinic, malic, citric... có trong môi trường do vi sinh vật tạo ra.
Phân vi sinh phân giải lân được nghiên cứu và đưa vào ứng dụng ở Việt Nam ngay
từ những năm 90 thế kỷ XX, trong đó vi sinh vật phân giải lân sau khi tạo sinh khối,
được tẩm nhiễm vào chất mang, tạo chế phẩm vi sinh phân giải lân hoặc phối trộn với
cơ chất hữu cơ tạo thành phân lân hữu cơ vi sinh vật. Hiệu lực của vi sinh vật trong
việc cung cấp dinh dưỡng lân cho cà phê trên cơ sở sử dụng đồng vị đánh dấu 32P, xác
định tương đương bằng 34,3 kg P/ha.
Kết quả khảo nghiệm ở nhiều nơi cho thấy, vi sinh vật phân giải phosphate khó tan
có thể nâng cao hiệu quả sử dụng phân lân khoáng 20 - 30% so với đối chứng; giúp
nâng cao năng suất cây trồng từ 5 - 15% tùy loại đất và cây trồng. (Nguyễn Minh
Hưng, 2007).
Vi khuẩn hoà tan lân Pseudomonas stutzeri
Vi khuẩn Pseudomonas stutzeri được phân lập lần đầu tiên bởi Burri và Stutzer
(1895), có tên gọi là Bacillus denitrificans II, sau đó được Allen và Niel (1952) đổi
tên thành P. stutzeri. Mặc dù có những điểm khác biệt với đặc tính điển hình của
giống nhưng lại có sự tương đồng về trình tự của rRNAs, điều này đã được chứng
minh bằng cách lai DNA-rRNA, đã xác thực rằng Pseudomonas stutzeri thuộc giống
Pseudomonas. Pseudomonas stutzeri là nhóm I của nhóm tương đồng DNA-rRNA
bên dưới ngành Protobacteria. Pseudomonas stutzeri. Bây giờ được nhận diện thuộc
lớp Gamma protobacteria (Lalucat et al., 2006).
P. stutzeri là vi khuẩn gram âm, hình que, dài 1 - 3µm, rộng 0,5µm (Guasp et al.,
2000). Chúng là loài có khả năng chuyển động, di chuyển bằng chiên mao đỉnh. Trong
những điều kiện xác định, một hoặc hai roi bên được hình thành tạo ra làn sóng ngắn.
Đây là loài cho kết quả dương tính với các kiểm tra catalase và oxidase và có sự trao
đổi chất một cách nghiêm ngặt. Thêm vào đó, các dòng P. stutzeri được định nghĩa
như các loài có khả năng khử nitrate không sắc tố, khử nitrate thành khí nitơ, có khả
năng tạo amylase, không có khả năng tạo gelatinase, và có thể tăng trưởng trong
maltose và tinh bột (Bennasar et al., 1998; Sikorski et al., 1999) và có phản ứng âm
tính trong các kiểm tra arginine dihydrolase và sự thủy phân glycogen. Hàm lượng G
+ C có trong DNA của hệ gene (genome) của chúng có khoảng 60 - 66% mol. Kết quả
lai DNA-DNA cho thấy có ít nhất 17 nhóm hệ gene đã được phân biệt (Lalucat et al.,
2006).
P. stutzeri là loài vi khuẩn không có sắc tố huỳnh quang. Đây là đặc điểm phân biệt
P. stutzeri với những thành viên khác của giống Pseudomonas. P. stutzeri thường dễ
bị nhầm lẫn nhất với các loài Pseudomonas khác (P. mendocina, P.
pseudoalcaligenes, P. putida) hoặc thậm chí với những giống khác (chẳng hạn Delftia
8
acidovorans và Ralstonia pickettii) hoặc thậm chí với vi khuẩn tạo mùi Alcaligenes
hoặc Achromobacter. Loài có quan hệ gần gũi nhất với P. stutzeri là P. balearica
(Lalucat et al., 2006). Các dòng P. stutzeri được nhận định là giống Pseudomonas spp
nhất, có thể tăng trưởng trong môi trường khoáng, hoá chất xác định, với ion
ammonium hoặc nitrate và phân tử hữu cơ đơn giản. Một vài dòng P. stutzeri có thể
tăng trưởng nội sinh. Không có dòng nào có thể chịu đựng được điều kiện acid: không
thể sinh trưởng ở pH = 4,5. P. stutzeri có sự trao đổi chất riêng và oxy là chất nhận
điện tử quyết định. Tuy nhiên, tất cả dòng có thể sử dụng nitrate như chất nhận điện tử
xen kẽ và bỏ qua sự khử nitrate ức chế oxy. Sự khử nitrate có thể được trì hoãn hoặc
có thể chỉ hiện diện sau khi cấy vào môi trường nitrate dưới điều kiện vi hiếu khí.
Khuẩn lạc của P. stutzeri (Hình 1.2) được mô tả là không thông thường và có tính
kiên định. Các dòng được phân lập có khuẩn lạc nhăn nheo, hơi đỏ, nâu, không vàng.
Đặc tính điển hình là cứng, khô và dính chặt (Rius et al., 2001). Khuẩn lạc của chúng
dễ dàng bị di chuyển một cách nguyên vẹn từ một bề mặt rắn. Nói chung có thể hình
dung khuẩn lạc của P. stutzeri tương tự như miệng núi lửa với chóp gợn sóng nhô cao
và thường đâm nhánh, dính liền nhau.
Hình dạng khuẩn lạc của vi khuẩn P. stutzeri không đồng nhất và không ổn định:
chúng thay đổi diện mạo theo thời gian. Sau nhiều lần cấy chuyền trong môi trường
phòng thí nghiệm, các khuẩn lạc trở nên trơn, láng và màu tái đi (Lalucat et al., 2006).
P. stutzeri có môi trường phân bố rất rộng, nó có thể sống được trong những điều
kiện sinh thái khác nhau, chúng được tìm thấy trong đất, nước và các mẫu bệnh lý. Vi
khuẩn P. stutzeri có giới hạn nhiệt độ rất rộng, từ 4 0C đến 450C, tùy thuộc vào đặc
tính riêng của từng dòng (Lalucat et al., 2006).
Theo Illmer và Schinner (1992), sự hoà tan Ca-Ps bởi Pseudomonas sp. và P.
aurantiogriseum bằng cách tiết ra proton H+. Các proton H+ này được sinh ra từ quá
trình đồng hoá-hoán vị NH4+ (Beever và Burns, 1980) hoặc từ sản phẩm hô hấp
H2CO3 (Jurinak et al., 1986).
Khi sử dụng vi khuẩn Pseudomonas spp. để hoà tan lân khó tan và tổng hợp IAA
cho hiệu quả tích cực trên cây đậu nành (Nguyễn Hữu Hiệp và Cao Ngọc Điệp, 2004).
Hơn nữa, vi khuẩn này có hiệu quả trên cây lúa cao sản (Cao Ngọc Điệp, 2005).
9
Hình 1.2 Các dạng khuẩn lạc của vi khuẩn Pseudomonas stutzeri (Theo Lalucat et
al., 2006)
10
CHƯƠNG 2
PHƯƠNG TIỆN VÀ PHƯƠNG PHÁP
2.1 PHƯƠNG TIỆN
2.1.1 Thời gian và địa điểm thí nghiệm
- Thời gian thực hiện: tháng 1 năm 2008 đến tháng 1 năm 2009.
- Địa điểm thực hiện: thí nghiệm được tiến hành tại 2 ruộng khóm thuộc xã Hỏa
Tiến, thị xã Vị Thanh, tỉnh Hậu Giang.
+ Điểm 1: hộ bà Chiêm Thị Lũy, diện tích đất thí nghiệm 1000 m2 (bao gồm cả
phần mương, tỷ lệ mương:liếp là 1:1)
+ Điểm 2: hộ ông Võ Văn Sạng, diện tích đất thí nghiệm 1000 m2 (bao gồm cả phần
mương, tỷ lệ mương:liếp là 1:1)
+ Các chỉ tiêu về năng suất và chất lượng trái được thực hiện tại phòng thí nghiệm
Sinh lý thực vật, bộ môn Sinh lý - Sinh hóa.
2.1.2 Đối tượng nghiên cứu: cây khóm Queen ‘Cầu Đúc’
2.1.3 Vật liệu thí nghiệm
- Chồi nách khóm Queen Cầu Đúc thu từ cây cấy mô sạch bệnh do khoa Nông
nghiệp & Sinh học Ứng dụng, trường Đại học Cần Thơ cung cấp. Trung bình trọng
lượng chồi khoảng 250 – 300 g, chiều cao khoảng 31 – 39 cm.
Hình 2.1 Chồi khóm Queen 'Cầu Đúc' được sử dụng làm vật liệu trồng
11
- Phân bón vi sinh có chứa vi khuẩn Gluconacetobacter diazotrophicus và dịch trích
vi khuẩn Pseudomonas stutzeri lên men do Viện Công nghệ Sinh học, trường Đại học
Cần Thơ cung cấp.
- Phân hóa học: Urea (chứa 46% N), Super lân (chứa 13% P2O5) và Kali clorua
(chứa 60% K2O).
- Dung dịch xử lý ra hoa: ethrel 39,5% ethephon
- Thiết bị phục vụ thí nghiệm:
+ Cân, máy đo pH, máy đo chỉ số SPAD hiệu Minolta, Brix kế hiệu ATAGADO.
+ Dụng cụ ép lấy nước ép khóm.
+ Máy ảnh kỹ thuật số để ghi hình và tập viết ghi chép số liệu.
2.2 PHƯƠNG PHÁP
2.2.1 Mục tiêu thí nghiệm
Ứng dụng chế phẩm phân sinh học của vi khuẩn Gluconacetobacter diazotrophicus
và dịch lên men vi khuẩn Pseudomonas stutzeri để thay thế hoặc giảm lượng phân hóa
học bón cho cây khóm Queen Cầu Đúc.
2.2.2 Phương pháp tiến hành
2.2.2.1 Bố trí thí nghiệm
Thí nghiệm được bố trí ở ngoài đồng theo thể thức khối hoàn toàn ngẫu nhiên, 6
nghiệm thức và 4 lần lặp lại. Mỗi lặp lại là một liếp với diện tích khoảng 100 m2, được
chia thành 6 lô nhỏ, diện tích mỗi lô là 16 m 2, khoảng cách giữa các lô trong cùng một
liếp là 1 m 2. Bón lót 45 kgK2O/ha cho tất cả các lô cộng với 20 kg/ha Regent 0.3G
trước khi trồng. Mỗi nghiệm thức là một công thức phân bón, gồm 6 nghiệm thức sau:
1. Đối chứng (không bón phân đạm và lân)
2. 180 kg N/ha + 90 kg P2O5/ha
3. 90 kg N/ha + 45 kg P2O5/ha + 100 kg/ha phân sinh học
4. 90 kg N/ha + 45 kg P2O5/ha +100 kg/ha phân sinh học/ha + 500 lít/ha dịch vi
khuẩn lên men
5. 45 kg N/ha + 22.5 kg P2O5/ha + 100 kg/ha phân sinh học
6. 45 kg N/ha + 22,5 kg P2O5/ha +100 kg/ha phân sinh học/ha + 500 lít/ha dịch vi
khuẩn lên men
2.2.2.2 Địa điểm thí nghiệm
Thí nghiệm được tiến hành tại hai điểm là:
12
Điểm 1: tại đất của bà Chiêm Thị Lũy, ấp Thạnh Thắng, xã Hỏa Tiến, thị xã Vị
Thanh, diện tích 1.000 m2.
Điểm 2: tại đất của ông Võ Văn Sạng, ấp Thạnh Thắng, xã Hỏa Tiến, thị xã Vị
Thanh, diện tích 1.000 m2.
Hai điểm thí nghiệm có cùng nghiệm thức và kỹ thuật canh tác hòan toàn giống
nhau.
Sơ đồ các nghiệm thức được bố trí như sau
Lặp lại 1
Lặp lại 2
Lặp lại 3
Lặp lại 4
4.1
3.2
3.3
2.4
6.1
1.2
5.3
6.4
5.1
2.2
2.3
3.4
3.1
4.2
1.3
5.4
2.1
5.2
4.3
1.4g
1.1
6.2
6.3
4.4
2.2.2.3 Kỹ thuật canh tác
- Chuẩn bị đất trồng: tiến hành vệ sinh lớp thực bì của vụ trước, xốc đất lên phơi
nắng khoảng 2 tháng trước khi bố trí thí nghiệm. Ở cả 2 điểm thí nghiệm được trồng
bằng chồi nách của cây khóm Queen 'Cầu Đúc' cấy mô sạch bệnh do trường Đại học
Cần Thơ cung cấp. Khoảng cách trồng chồi x chồi là 50x50 cm. Bón lót 50 % kali (45
kg K2O/ha) và 2 kg Regent/1.000 m2 trước khi trồng để diệt rệp sáp và kiến.
- Thời điểm bón phân tuỳ thuộc vào từng loại phân, được chia cụ thể như sau:
+ Đối với phân hóa học: liều lượng trong từng công thức được chia đều làm 4 lần
bón từ 1, 2, 4 và 6 tháng sau khi trồng. Trong khi đó kali được bón vào thời điểm 6 và
8 tháng sau trồng ở tất cả các nghiệm thức.
+ Đối với phân sinh học: chỉ bón 1 lần vào lúc 5 ngày sau khi trồng.
+ Dịch trích vi khuẩn lên men tưới định kỳ liên tục 1 tháng/lần trong 5 tháng đầu
sau khi trồng.
- Xử lý ra hoa: cây khóm được xử lý ra hoa vào thời điểm cây được 9 tháng tuổi với
dung dịch ethrel 39.5% ethephon. Mỗi cây được xử lý với 50 ml ethrel nồng độ 500
ppm.
13