AXIT NITRIC và MU i NITRAT hoa 11
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (60.4 KB, 5 trang )
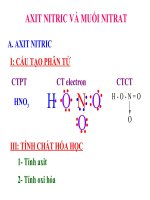
AXIT NITRIC VÀ MUỐI NITRAT
A. A XIT NITRIC__CTHH:…….M=…….
I.
Cấu tạo phân tử
II.
Tính chất vật lí
_Là một chất lỏng không màu, bốc khói trong không khí ẩm
4HNO3 → 4NO2 ↑ + O2 ↑ + 2H2O
Dd HNO3 → hóa vàng ( NO2)
Tan vô hạn trong nước.
Dd HNO3 đậm đặc có C% = 68 %
III.
Tính chất hóa học
1) Tính axit
Dd HNO3 là axit mạnh, điện ly hoàn toàn thành ion :………………………………………….
_Làm quỳ tím………………………………
_Tác dụng với oxit bazơ →.............+……..
VD1: ……………………………………………………………………………………………………….
2:……………………………………………………………………………………………………………
3:……………………………………………………………………………………………………………
_T/d với muối của axit yếu hơn → …….+………
VD1: ………………………………………………. ………………………………………………………
2:…………………………………………………………………………………………………………….
3:…………………………………………………………………………………………………………….
_T/d với bazơ → ………..+……….
VD1: ………………………………………………. ……………………………………………………….
2:…………………………………………………………………………………………………………….
3:……………………………………………………………………………………………………………..
2.Tính oxi hóa mạnh
a) T/d với kim loại ( trừ Au, Pt)
_Oxi hóa kim loại tới số oxi hóa cao nhất
(Fe → Fe3+ ; Cu → Cu2+ )
_Tạo muối nitrat không giải phóng H2.
HNO3 đặc + KL → Muối NO3− + NO2 + H2O
VD :
Vậy :
Al +
Cu +
Ag +
HNO3 đặc to→ ………….....................................................................
HNO3 đặc to→ ………….....................................................................
HNO3 đặc to→ ………….....................................................................
…..M + ……HNO3 đ → …….M(NO3)n +………NO2↑+………H2O
Lưu ý : Al, Fe không tác dụng với HNO3 đặc nguội
NH4NO3
NO
HNO3 loãng + KL → Muối NO3− +
N2O
+ H2O
Kim loại có tính khử yếu (đứng sau H như Cu, Ag,….) → thu được NO
Vd:
Cu +
HNO3 loãng to→ ………….....................................................................
Al
HNO3 loãng to→ ………….....................................................................
Vậy :
+
……….M + …….…HNO3 → ………..M(NO3)n +……..……NO↑+……….…H2O
(……….) M + ( ………..…) HNO3 → ( …….…...…) M(NO3)n +( ……...…) NaOb↑+( ……......…) H2O
b) T/d với phi kim :
HNO3 oxi hóa một số phi kim ( C,S,P,……) tới số oxi hóa cao nhất ( C → CO2 ; S → H2SO4 ; P → H3PO4 )
S +
6 HNO3 đặc to→ ………….....................................................................
C +
4 HNO3 đặc to→ ………….....................................................................
c) T/d với hợp chất ( có tính khử ) :
FeO + …..HNO3 → …………………………………………………………………
Fe3O4 + …..HNO3 → ……………..……+………NO +………………………………
Fe3O4 + …..HNO3 → …………………..+………NO2 +………………………………
IV) Ứng dụng :
_Sản xuất phân đạm, thuốc nổ….
V) Điều chế
1) Trong phòng thí nghiệm :
.............................................................................................................................................................................................
.........................................................................................................................................................
2) Trong công nghiệp :
Gồm ba giai đoạn :
_Oxi hóa khí ammoniac :…………………………………………………………………..
_Oxi hóa NO thành NO2:……………………………………………………………………
_ Chuyển hóa NO2 thành HNO3 :…………………………………………………………..
B. MUỐI NITRAT ___M(NO3)n ( M là kim loại hóa trị n)
I.
Tính chất của muối nitrat :
1) Tính tan :
_Tất cả các muối nitrat đều dễ tan và là những chất điện ly mạnh . Ion NO 3− , không màu, không bị thủy phân.
2) Phản ứng trao đổi ion : tác dụng với axit, bazơ, muối
_T/d với A → ………….+ ………………
+ Vd :
AgNO3 +
HCl → …….........+………………….
→pt ion thu gọn :…………………………………………………………………………
_T/d với B →…………….+……………….
+ Vd :
Cu(NO3)2 +
NaOH → …….........+………………………
→pt ion thu gọn :………………………………………………………………………………
_T/d với M →……………………+…………………….
+ Vd :
Ba(NO3)2 + Na2SO4
→ …….........+………………………
→pt ion thu gọn :………………………………………………………………………………
3) Phản ứng nhiệt phân :
_Muối nitrat dễ bị nhiệt phân, giải phóng O 2 → ở nhiệt độ cao, muối nitrat có tính oxi hóa mạnh
Với kim loại mạnh : ( K, Na, Ca, Ba ) Muối nitrit + O2
......M(NO3)n ……M(NO2)n +…….O2
Vd: Viết phản ứng nhiệt phân muối Ba(NO 3)2 ; KNO3
.............................................................................................................................................................................................
.........................................................................................................................................................
Với kim loại trung bình (Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn,Pb, Cu ) oxit kim loại + NO2 + O2
......M(NO3)n ……M2On +…….NO2+……….O2
Vd: Viết phản ứng nhiệt phân muối Cu(NO 3)2 ; Al(NO3)3 ; Zn(NO3)2 ;Mg(NO3)2
.............................................................................................................................................................................................
.........................................................................................................................................................
.............................................................................................................................................................................................
.........................................................................................................................................................
Với kim loại yếu (Ag, Hg,Pt,Au) Kim loại + NO2 + O2
......M(NO3)n ……M +…….NO2+……….O2
Vd: Viết phản ứng nhiệt phân muối AgNO 3
...........................................................................................................................................................................
4) Nhận biết ion NO3¯
Muối nitrat + H+ + bột Cu NO ( khí không màu, hóa nâu trong không khí)
…….Cu + ….. NO3¯ + ……H+ ……….Cu2+ + …….NO+…….H2O
dd xanh
……NO + ……..O2 ……..NO2
(không màu)
(màu nâu đỏ)
II, Ứng dụng
_Làm phân bón (phân đạm ), điều chế thuốc nổ .
C. Chu trình của nito trong tự nhiên
BÀI TẬP :
1. Viết phương trình phản ứng của Fe, Mg, Ag, C, FeO với HNO 3 dặc nóng của Al, Zn, Cu với HNO3 loãng (thu được NO):
.............................................................................................................................................................................................
......................................................................................................................................................... ...................................
.............................................................................................................................................................................................
..................................................................................................................... .......................................................................
.............................................................................................................................................................................................
.................................................................................. ..........................................................................................................
.............................................................................................................................................................................................
...............................................
2. Viết phản ứng nhiệt phân muối KNO3; Ba(NO3)2, Fe(NO3)3,AgNO3, Hg(NO3)2.
.............................................................................................................................................................................................
......................................................................................................................................................... ...................................
.............................................................................................................................................................................................
...................................................................................................................... ......................................................................
.............................................................................................................................................................................................
...................................................................................
3. Thực hiện sơ dồ chuyển hóa :
NaNO3 HNO3 Cu(NO3)2 CuO Cu CuCl2
.............................................................................................................................................................................................
......................................................................................................................................................... ...................................
.............................................................................................................................................................................................
...................................................................................................................... ......................................................................
.............................................................................................................................................................................................
...................................................................................
NH4NO3 NH3 NO NO2 HNO3Al(NO3)3 Al2O3
.............................................................................................................................................................................................
......................................................................................................................................................... ...................................
.............................................................................................................................................................................................
...................................................................................................................... ......................................................................
.....................................................................................................