XÂY DỰNG QUY TRÌNH ĐỊNH TÍNH VÀ ĐỊNH LƯỢNG VIRÚT GÂY BỆNH RỐI LOẠN SINH SẢN VÀ HÔ HẤP CHỦNG BẮC MỸ TRÊN HEO ( PRRSV ) BẰNG KỸ THUẬT REALTIME RTPCR SỬ DỤNG MẪU DÒ TAQMAN
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (1.86 MB, 50 trang )
BỘ GIÁO DỤC VÀ ĐÀO TẠO
TRƯỜNG ĐẠI HỌC NÔNG LÂM TP.HỒ CHÍ MINH
BỘ MÔN CÔNG NGHỆ SINH HỌC
KHÓA LUẬN TỐT NGHIỆP
XÂY DỰNG QUY TRÌNH ĐỊNH TÍNH VÀ ĐỊNH LƯỢNG
VI-RÚT GÂY BỆNH RỐI LOẠN SINH SẢN VÀ HÔ HẤP
CHỦNG BẮC MỸ TRÊN HEO (PRRSV) BẰNG
KỸ THUẬT REAL-TIME RT-PCR
SỬ DỤNG MẪU DÒ TAQMAN
Ngành học
: CÔNG NGHỆ SINH HỌC
Sinh viên thực hiện
: LÊ THỊ THƠM
Niên khoá
: 2007 – 2011
Tháng 7 năm 2011
ii
BỘ GIÁO DỤC VÀ ĐÀO TẠO
TRƯỜNG ĐẠI HỌC NÔNG LÂM TP.HỒ CHÍ MINH
BỘ MÔN CÔNG NGHỆ SINH HỌC
KHÓA LUẬN TỐT NGHIỆP
XÂY DỰNG QUY TRÌNH ĐỊNH TÍNH VÀ ĐỊNH LƯỢNG
VI-RÚT GÂY BỆNH RỐI LOẠN SINH SẢN VÀ HÔ HẤP
CHỦNG BẮC MỸ TRÊN HEO (PRRSV) BẰNG
KỸ THUẬT REAL-TIME RT-PCR
SỬ DỤNG MẪU DÒ TAQMAN
Hướng dẫn khoa học
Sinh viên thực hiện
PGS.TS. NGUYỄN NGỌC HẢI
KS. VÕ KHÁNH HƯNG
LÊ THỊ THƠM
Tháng 7 năm 2011
iii
LỜI CẢM ƠN
Trước tiên, con xin gửi lời cám ơn gia đình luôn quan tâm động viên con trong suốt
quá trình học tập.
Em xin chân thành cảm ơn:
Ban giám hiệu trường Đại học Nông Lâm Thành phố Hồ Chí Minh, Ban chủ
nhiệm Bộ Môn Công nghệ Sinh học, cùng tất cả quý thầy cô đã truyền đạt những
kiến thức hay và phong cách làm việc tốt cho em trong suốt 4 năm học.
Tập thể cán bộ và quý Thầy - Cô Viện công nghệ sinh học và môi trường, Đại
học Nông Lâm Thành phố Hồ Chí Minh đã tạo điều kiện và giúp đỡ em trong suốt
thời gian thực tập.
Thầy PGS.TS Nguyễn Ngọc Hải và KS.Võ Khánh Hưng đã tận tình hướng dẫn
và tạo mọi điều kiện cho em trong suốt quá trình thực hiện đề tài tốt nghiệp.
Thầy Phạm Hùng Vân, chị Thùy Trang và các anh chị trong phòng thí nghiệm
công ty Nam Khoa đã giúp đỡ em nhiều trong quá trình làm thí nghiệm.
Các bạn cùng nhóm nghiên cứu, các bạn lớp DH07SH. Chân thành cảm ơn bạn
Nguyễn Văn Chí và KS. Nguyễn Phan Thành đã giúp đỡ em trong quá trình thực
hiện đề tài.
i
TÓM TẮT
Bệnh do vi-rút PRRS gây ra trên heo đang xảy ra, gây nhiều thiệt hại kinh tế
cho ngành chăn nuôi thế giới và Việt Nam. Tình hình dịch bệnh diễn biến phức tạp
khi xuất hiện biến chủng PRRSV Bắc Mỹ độc lực cao tại Trung Quốc, gọi tắt là
HV-PRRS (highly virulent PRRS). Các chủng PRRSV phát hiện tại Việt Nam đã
được xác định phần lớn thuộc dòng PRRSV Bắc Mỹ trong đó có cả PRRSV độc lực
cao. Do vậy, việc xây dựng quy trình định tính và định lượng PRRSV dòng Bắc Mỹ
là cần thiết cho công tác phòng chống bệnh. Real-time RT-PCR sử dụng mẫu dò
Taqman là phương pháp có độ nhạy và độ đặc hiệu cao trong định tính và định
lượng vi-rút PRRS nhiễm trên heo. Vì những yêu cầu trên, đề tài “ Xây dựng quy
trình định tính và định lượng vi-rút gây bệnh rối loạn sinh sản và hô hấp chủng Bắc
Mỹ trên heo (PRRSV) bằng kỹ thuật real-time RT-PCR sử dụng mẫu dò Taqman”
đã được thực hiện tại Viện Công nghệ sinh học và Môi trường và Công ty Nam
Khoa.
Kết quả đạt được gồm xây dựng thành công quy trình định tính và định
lượng PRRSV; ứng dụng quy trình real-time PCR chẩn đoán 20 mẫu thực địa, kết
quả 11/20 mẫu dương tính với PRRSV dòng Bắc Mỹ (tỷ lệ 55%).
ii
SUMMARY
The reproductive and respiratory syndrome has been spreading and causing
severe economic devastations for the international and Vietnam livestock. The
situation has become complexly when the highly virulent virus in China mutated
from North American PRRSV appears. In Vietnam, PRRSV is determined to be
North America PRRSV and even HV-PRRSV. Therefore, establishing the
procedure for detecting and quantifying PRRSV is necessary. Taqman based real
time RT-PCR is the sensitive and specific method to detect and quantify PRRSV.
For all these reasons, the thesis: “To establish the procedure to detect and quantify
reproductive and respiratory syndrome virus by using the Taqman based real time
RT-PCR” is performed at the Institute Research of Biotechnology and Environment
and Nam Khoa company.
The result achieves: The research established successfully the procedure to detect
and quantify NA PRRSV. The procedure was applied to test 20 samples which 11
samples are positive with the NA PRRSV (55%).
iii
MỤC LỤC
LỜI CẢM ƠN .......................................................................................................................................i
TÓM TẮT .............................................................................................................................................ii
SUMMARY ........................................................................................................................................iii
DANH SÁCH CÁC CHỮ VIẾT TẮT .........................................................................................vi
DANH SÁCH CÁC BẢNG ...........................................................................................................vii
DANH SÁCH CÁC HÌNH............................................................................................................ viii
Chương 1 MỞ ĐẦU ...........................................................................................................................1
1.1. Đặt vấn đề .........................................................................................................1
1.2. Yêu cầu .............................................................................................................2
1.3. Nội dung thực hiện ............................................................................................2
Chương 2 TỔNG QUAN TÀI LIỆU .............................................................................................3
2.1. Hội chứng rối loạn sinh sản và hô hấp ở heo......................................................3
2.2. Vi-rút gây hội chứng rối loạn sinh sản và hô hấp ở heo......................................3
2.2.2. Biến chủng PRRSV độc lực cao tại Trung Quốc ............................................4
2.2.3. Cấu trúc vi-rút PRRS .....................................................................................6
2.3. Chẩn đoán vi-rút PRRS .....................................................................................7
2.3.1. Phương pháp nuôi cấy tế bào .........................................................................7
2.3.2. Phương pháp phát hiện kháng thể...................................................................7
2.3.3. Phương pháp RT-PCR ...................................................................................7
2.3.4. Phương pháp nested RT-PCR.........................................................................8
2.4. Kỹ thuật real-time PCR chẩn đoán PRRSV........................................................8
2.4.1. Kỹ thuật real-time PCR..................................................................................8
2.4.2. Các chất phát huỳnh quang sử dụng trong real-time PCR...............................8
2.4.3. Nguyên lý hoạt động real-time sử dụng mẫu dò Taqman.............................. 10
iv
2.4.4. Thành phần phản ứng real-time PCR dùng mẫu dò Taqman......................... 11
2.4.5. Tiêu chuẩn của một phản ứng PCR định lượng tối ưu ..................................11
2.4.6. Thiết kế mồi và mẫu dò cho phản ứng real-time PCR ..................................13
2.5. Một số nghiên cứu trong và ngoài nước về PRRSV .........................................14
2.5.1. Nghiên cứu trên thế giới............................................................................... 14
2.5.2. Một số nghiên cứu tại Việt Nam ..................................................................14
Chương 3 VẬT LIỆU VÀ PHƯƠNG PHÁP NGHIÊN CỨU...................................................... 16
3.1. Thời gian và địa điểm nghiên cứu....................................................................16
3.2. Vật liệu............................................................................................................ 16
3.3. Hóa chất và thiết bị.......................................................................................... 16
3.4. Phương pháp tiến hành .................................................................................... 17
3.4.1. Thu nhận mẫu .............................................................................................. 17
3.4.2. Ly trích RNA từ dịch vi-rút và huyết thanh .................................................. 19
3.4.3. Thiết kế mồi và mẫu dò real-time PCR đặc hiệu PRRSV dòng Bắc Mỹ. ......20
3.4.4. Kiểm tra khả năng hoạt động của cặp mồi F7-R7VN ...................................20
3.4.5. Phản ứng Onestep Taqman real-time RT-PCR trên mẫu thực địa. ................ 21
Chương 4 KẾT QUẢ VÀ THẢO LUẬN .................................................................................. 22
4.1. Thiết kế cặp mồi và mẫu dò cho phản ứng real-time PCR................................ 22
4.2. Kiểm tra sự hoạt động của cặp mồi F7-R7VN.................................................. 24
4.3. Phản ứng Onestep Taqman real-time RT-PCR với mồi F7-R7VN và mẫu dò P7 .....24
4.4. Xây dựng đường chuẩn cho định lượng PRRSV. ............................................ 25
4.5. Xác định độ đặc hiệu của phản ứng .................................................................26
4.6. Ứng dụng quy trình Onestep Taqman Real-time RT-PCR trên mẫu thực địa ...27
Chương 5 KẾT LUẬN VÀ ĐỀ NGHỊ ....................................................................................... 31
5.1. Kết luận ........................................................................................................... 31
5.2. Đề nghị............................................................................................................ 31
TÀI LIỆU THAM KHẢO ............................................................................................................. 32
PHỤ LỤC
v
DANH SÁCH CÁC CHỮ VIẾT TẮT
aa
Amino acid
cDNA
Complementary deoxyribonucleotide acid
Ct
Threshold cycle
DNA
Deoxyribonucleotide acid
dNTP
Deoxyribonucleoside triphosphate
EDTA
Ethylene diamine tetra acetic acid
EU
European
FAO
Food and Agriculture Organization
HV-PRRS
Highly virulent PRRS
LOD
Limit of detection
NA
North American
nt
Nucleotide
NTC
No template control
ORF
Open reading frame
PAMs
Porcine alveolar macrophage
PRRS
Porcine reproductive and respiratory syndrome virus
RNA
Ribonucleic acid
RT-PCR
Reverse transcriptase polymerase chain reaction
TBE
Tris borate EDTA
TE
Tris EDTA
vi
DANH SÁCH CÁC BẢNG
Bảng 2.1 Một số cặp chất phát và hấp thụ huỳnh quang thường sử dụng .....................9
Bảng 3.1 Mẫu sử dụng trong quy trình phát hiện PRRSV bằng Taqman real-time PCR...18
Bảng 3.2. Cặp mồi và mẫu dò thiết kế cho phản ứng real-time ..................................20
Bảng 3.3 Thành phần và nồng độ hóa chất trong phản ứng RT-PCR ......................... 20
Bảng 3.4 Quy trình nhiệt phản ứng RT-PCR ............................................................. 21
Bảng 3.5 Thành phần phản ứng Onestep Taqman real-time PCR............................... 21
Bảng 3.6 Chu trình nhiệt phản ứng Onestep Taqman real-time PCR ......................... 21
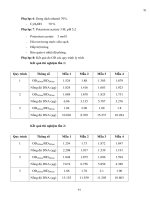
Bảng 4.1 Kết quả chạy mẫu thực địa .........................................................................28
vii
DANH SÁCH CÁC HÌNH
Hình 2.1 Sự phân bố vi-rút PRRS khu vực Đông Nam Á từ 2007 - 2010 ............. 5
Hình 2.2 Cấu trúc bộ gen vi-rút PRRS ................................................................. 6
Hình 2.3 Cấu tạo của mẫu dò Taqman.................................................................. 9
Hình 2.4 Cơ chế phát quang của Taqman trong phản ứng real-time PCR ............10
Hình 2.5 Biểu đồ thể hiện các giai đoạn của tín hiệu huỳnh quang ......................11
Hình 2.6 Đường chuẩn cho phản ứng định lượng ................................................13
Hình 4.1 Vị trí bắt cặp của mồi xuôi F7 trên ORF7 PRRSV dòng Bắc Mỹ..........22
Hình 4.2 Vị trí bắt cặp của mồi R7VN trên PRRSV dòng Bắc Mỹ ......................23
Hình 4.3 Vị trí Taqman bắt cặp vào DNA PRRSVdòng Bắc Mỹ.........................23
Hình 4.4 Chạy RT-PCR với dịch pha loãng dịch vi-rút và mẫu huyết thanh ........24
Hình 4.5 Phản ứng định tính Taqman real-time PCR...........................................25
Hình 4.6 Biểu đồ khuếch đại các độ pha loãng dịch vi-rút từ 100 đến 10-5 ...........25
Hình 4.7 Đường chuẩn độ pha loãng dịch vi-rút từ 100 đến 10-5 ..........................26
Hình 4.8 Đánh giá độ đặc hiệu cặp mồi F7-R7VN ..............................................27
Hình 4.9 Đường phát tín hiệu huỳnh quang của mẫu thuyết thanh thực địa .........29
Hình 4.10 Hàm lượng vi-rút PRRSV của mẫu H2 và H14 trên đường chuẩn.......29
Hình 4.11 Tương quan giữa dịch vi-rút từ Navetco và vacxin IngelVac ..............30
viii
Chương 1 MỞ ĐẦU
1.1. Đặt vấn đề
Ngành chăn nuôi heo có vị trí quan trọng trong nền kinh tế toàn cầu. Hàng năm,
37,7% số lượng thịt được cung cấp trên thế giới là thịt heo (Tổ chức Nông lương thế
giới – FAO, 2009). Riêng ở Việt Nam, chăn nuôi heo chiếm 58% GDP nông nghiệp
hàng năm (FAO, 2011). Hiện nay, ngành chăn nuôi heo đang đối mặt với nhiều dịch
bệnh nguy hiểm, một trong số đó là hội chứng rối loạn sinh sản và hô hấp trên heo
(PRRS: porcine reproductive and respiratory syndrome) hay bệnh heo tai xanh. Bệnh
do một loại vi-rút gọi là PRRS gây ra, có thể xảy ra ở mọi lứa tuổi của heo, nhưng tập
trung chủ yếu ở heo nái mang thai và heo con theo mẹ. Hội chứng này đã trở thành
dịch địa phương ở nhiều nước trên thế giới (Trung Quốc 80%, Đài Loan là 94,7 96,4%, Philippine là 90%, Thái Lan là 97%...) và gây tổn thất lớn cho người chăn nuôi
hàng trăm triệu đô la.
PRRS bùng nổ tại Việt Nam năm 2007. Qua nghiên cứu giải mã gen vi-rút này
tại Mỹ và Trung Quốc cho thấy, các mẫu vi-rút gây dịch PRRS tại Việt Nam có mức
tương đồng về amino axit rất cao, lên tới 99 - 99,7% so với dòng vi-rút PRRS thể độc
lực cao của Trung Quốc. Điều này cho thấy, dòng vi-rút PRRS ở nước ta hiện nay
thuộc dòng Bắc Mỹ, có độc lực cao giống vi-rút PRRS Trung Quốc (Viện chăn nuôi,
bộ Nông nghiệp và Phát triển nông thôn). Hiện dịch bệnh đã có mặt tại nhiều tỉnh của
Việt Nam và diễn biến phức tạp, vì vậy phát hiện vi-rút PRRS dòng Bắc Mỹ là vấn đề
cần thiết phải được thực hiện.
Real-time PCR là một kỹ thuật mới, đã được áp dụng rộng rãi nhờ một số tính ưu
việt: phát hiện nhanh, tính đặc hiệu cao, định lượng chính xác. Real-time PCR sử dụng
mẫu dò Taqman có độ đặc hiệu rất cao, cho phép phát hiện và định lượng vi-rút nhiễm
trên heo ở mức độ thấp, giúp xác định chính xác PRRSV dòng Bắc Mỹ, hỗ trợ việc sử
dụng vacxin hiệu quả và công tác phòng chống bệnh. Được sự hướng dẫn của PGS.TS
Nguyễn Ngọc Hải và KS. Võ Khánh Hưng, tôi thực hiện đề tài “Xây dựng quy trình định
tính và định lượng vi-rút gây bệnh rối loạn sinh sản và hô hấp dòng Bắc Mỹ trên heo
(PRRSV) bằng kỹ thuật Real-time RT-PCR sử dụng mẫu dò Taqman”.
1
1.2. Yêu cầu
Xây dựng và ứng dụng quy trình Real-time RT-PCR sử dụng mẫu dò Taqman
để định tính và định lượng vi-rút PRRS dòng Bắc Mỹ trên heo nhằm phục vụ công tác
nghiên cứu.
1.3. Nội dung thực hiện
Thiết kế mồi, mẫu dò đặc hiệu dòng PRRSV Bắc Mỹ cho phản ứng Taqman
real-time RT-PCR.
Tiến hành quy trình real-time RT-PCR định tính và định lượng PRRSV dòng
Bắc Mỹ trên mẫu thực địa.
2
Chương 2 TỔNG QUAN TÀI LIỆU
2.1. Hội chứng rối loạn sinh sản và hô hấp ở heo
Hội chứng rối loạn sinh sản và hô hấp (PRRS) là bệnh gây sảy thai ở heo nái và
rối loạn đường hô hấp trên heo sơ sinh và heo choai (Christianson và ctv, 1992). Bệnh
được phát hiện lần đầu tại Bắc Mỹ và Canada năm 1987, sau đó lan sang châu Âu và
châu Á vào những năm 1990 (Murakami và ctv, 1994). Ban đầu, bệnh có nhiều tên
khác nhau nhưng đến năm 1992, tổ chức Dịch tễ thế giới (OIE) công nhận tên chính
thức của bệnh là PRRS (porcine reproductive and respiratory syndrome).
Bệnh do vi-rút PRRS gây ra và lây lan tới hầu hết các nước trên thế giới. Ở Việt
Nam, bệnh được phát hiện vào năm 1997 trên đàn heo nhập từ Mỹ (10/51 con có huyết
thanh dương tính). Các nghiên cứu về bệnh trên những trại heo giống tại các tỉnh phía
Nam cho thấy tỷ lệ heo có huyết thanh dương tính với bệnh rất khác nhau, từ 1,3% cho
tới 68,29%. Ở các nước khác, tỷ lệ đàn trong vùng bệnh có huyết thanh dương tính rất
cao, như ở Anh là 60 - 75%, Mỹ là 36% (Phòng Dịch Tễ – Cục Thú y, 2007).
Bệnh PRRS gây thiệt hại kinh tế lớn do làm tỷ lệ sinh giảm 10 - 15%, giảm số
lượng con sống sót sau sinh, tăng lượng con chết khi sinh, heo hậu bị có thể sinh sản
kém, đẻ sớm, tăng tỷ lệ sảy thai (2 - 3%), bỏ ăn giai đoạn sinh con.
Heo ốm có triệu chứng điển hình như sốt cao trên 40oC – 42oC, viêm phổi nặng,
đặc biệt là ở heo con cai sữa. Bệnh có tốc độ lây lan nhanh, trong vòng 3 - 5 ngày cả
đàn có thể bị nhiễm bệnh. Thời gian nung bệnh khoảng 5 - 20 ngày. Heo bệnh thường
bị bội nhiễm bởi những bệnh kế phát khác như: dịch tả heo, phó thương hàn, tụ huyết
trùng, E. coli, Streptococcus, Mycoplasma spp., Salmonella...
2.2. Vi-rút gây hội chứng rối loạn sinh sản và hô hấp ở heo
Vi-rút PRRS thuộc giống Arterivirus, họ Arteriviridae, bộ Nidovirades, có cấu
trúc vỏ bọc dạng chuỗi đơn RNA. Arterivirus gần với equine arteritis virus (EAV),
Lactic Dehydrogenase virus (LDHV) và simian hemorrhagic fever virus (SHFV) (Dea
và ctv, 2000).
3
2.2.1. Các dòng vi-rút PRRS và sự phân bố của chúng
Hiện nay đã xác định được hai kiểu gen vi-rút chính: dòng châu Âu (vi-rút
Lelystad hay type EU) và dòng Bắc Mỹ (VR–2332 hay type NA). Type EU chiếm ưu
thế tại châu Âu trong khi type NA được tìm thấy ở châu Mỹ (cả miền Bắc và Nam) và
châu Á (FAO, 2011). Tuy nhiên, bên trong mỗi dòng lại có sự khác nhau về chuỗi hợp
chất hữu cơ của protein vi-rút.
2.2.2. Biến chủng PRRSV độc lực cao tại Trung Quốc
Thông thường, các dòng vi-rút này gây chết với tỷ lệ thấp, nhưng tháng 7/2006,
Trung Quốc đã bùng nổ đợt dịch PRRS và phát hiện biến chủng vi-rút Bắc Mỹ gọi tắt
là HV-PRRS có độc lực cao, tốc độ lây lan và khả năng gây chết cho heo nhanh hơn,
chứng tỏ vi-rút đã có sự biến đổi phức tạp. Biến chủng vi-rút này có thể gây chết đến
20% heo bệnh, kể cả heo trưởng thành. Các loại mầm bệnh này đã làm hàng triệu heo
bị ốm, chết và phải tiêu hủy. Từ 1/1/2007 đến 22/8/2007, Trung Quốc đã có 826 đợt
dịch trên 26 tỉnh thành, làm 257.000 con heo nhiễm bệnh, 68.000 heo bị chết và
175.000 con bị tiêu hủy (FAO, 2011). Các tỉnh Anhui, Hunan, Guangdong, Shandong,
Liaoning, Jilin và một số tỉnh khác bị ảnh hưởng nặng buộc Trung Quốc phải tiêu hủy
tới 20 triệu heo để ngăn chặn dịch lây (Cục Thú y). Sự biến đổi của vi-rút được giải
thích do áp lực chọn lọc và sự thay đổi tập quán chăn nuôi, sự liên kết dịch tễ của một
số lượng lớn động vật và điều kiện môi trường như nhiệt độ, độ ẩm…tại Trung Quốc
(FAO, 2011).
Xiaofang Hao (2011) đã nghiên cứu vùng gen ORF7 và Nsp2 của bảy trình tự
gen PRRSV phân lập được từ Trung Quốc và so sánh với 93 trình tự trên ngân hàng
gen trong đó có 91 trình tự đã phân lập từ Trung Quốc, 1 trình tự Bắc Mỹ VR-2332 và
một trình tự vi-rút vacxin nhược độc RespPRRS MLV thì thấy có sự mất một số amino
axit trên protein Nsp2 của 75/100 trình tự Trung Quốc này. Ngoài trình tự HB2sh bị
mất mười hai amino axit tại vị trí 470 - 481, 74 trình tự còn lại có bốn kiểu đột biến
khác nhau. Sáu mươi bốn trình tự từ ngân hàng gen và sáu trình tự phân lập được
(07N, 128, PC, TS, XIN, và XB) bị mất ba mươi amino axit trong đó 1 ở vị trí 482 và
29 amino axit khác tại vị trí 533 - 561 của Nsp2. Trong khi trình tự CG và GDQY2 bị
mất 36 và 29 amino axit tại vị trí 471 - 506 và 533 – 561 thì trình tự YN9 bị mất lần
lượt 25 và 29 amino axit tại vị trí 478 - 502 và 533 - 561. Riêng trình tự Em2007 bị
mất amino axit vị trí 499 - 566. Trình tự nt (nucleotide) của 98 trình tự PRRS Trung
4
Quốc trên tương đồng với nhau tới 90,9 - 100% và 88,6 - 100% trình tự amino axit, tất cả
đều thuộc dòng Bắc Mỹ. Những dòng này có độ tương đồng tới 91,4 - 100% nt và 91,1
- 100% amino axit so với dòng VR-2332 and vacxin RespPRRS MLV còn so với dòng
châu Âu là 67,8 - 71,1% nucleotide và 62,5 - 65,8% amino axit.
Hình 2.1 Sự phân bố vi-rút PRRS khu vực Đông Nam Á từ 2007 đến giữa năm 2010
(FAO, 2011).
Hiện nay, dòng HV-PRRS đã lây sang vùng Đông Nam Á. Trong năm 2007, Việt
Nam và Philipin đều phát hiện sự có mặt của dòng vi-rút này. Thái Lan tìm thấy dòng
vi-rút độc lực cao năm 2008 nhưng tình hình dịch bệnh bùng phát chậm, năm 2008
phát hiện 25 trường hợp đến 2009 tăng nhẹ lên thành 33. Kết quả nghiên cứu của
Youjun Feng và ctv (2007) đã khẳng định dòng vi-rút PRRS tại Việt Nam và Trung
Quốc tương đồng với nhau, đều là dòng độc lực cao và bị mất 30 axit amin trong vùng
5
Nsp2. Tại Việt Nam, đồng bằng Sông Hồng và các tỉnh miền Nam là nơi có sự hiện
diện của vi-rút PRRS cao nhất (FAO, 2011).
2.2.3. Cấu trúc vi-rút PRRS
Vi-rút PRRS là vi-rút RNA sợi đơn, thẳng, có vỏ bọc với đường kính 50 – 60 nm,
bề mặt khá nhẵn và có lõi nucleocapsid hình khối với đường kính 25 – 35 nm
(Cavanagh, 1997; Cho và Dee, 2006).
Bộ gen vi-rút dài khoảng 1,5kb, gồm chín khung đọc mở (ORFs-open reading
frames) gồm ORF1a, ORF1b, ORF2a, ORF2b, ORF3, ORF4, ORF5, ORF6 và ORF7
mã hóa cho những thành phần khác nhau của vi-rút. Vùng ORF1a và ORF1b dài
1,2kb, chiếm gần 75% bộ gen, mã hóa cho 12 protein không cấu trúc (Nsp - nonstructural
protein), từ Nsp1 đến Nsp12, bản chất là các enzyme polymerase giúp cho việc nhân
lên của vi-rút, trong đó vùng gen mã hóa Nsp2 có sự biến đổi di truyền chủ yếu trong
sự nhân bản vi-rút (Roongtham Kedkovid, 2010).
Hình 2.2 Cấu trúc bộ gen vi-rút PRRS. ORF1a, ORF1b: Protein không
cấu trúc, ORF2a, ORF3, ORF4 (GP2, GP3, GP4): Protein màng, ORF5 (E):
Protein vỏ ngoài, ORF6 (M): Protein gian màng, ORF7 (N): Protein Capsid
(www.porcilis-prrs.com/images/genome.jpg).
Các khung đọc mở khác gồm ORF2a, ORF2b và các ORF từ 3-7 mã hóa các
protein cấu trúc GP2a, GP2b, GP3, GP4, GP5, M và N một cách chuyên biệt
(Xiaofang Hao và ctv, 2011) nhưng chỉ có ba khung ORFs có ý nghĩa quan trọng trong
tổng hợp vi-rút, đó là ORF5, ORF6 và ORF7. Sản phẩm GP2a (mã hóa bởi ORF 2a),
GP2b (ORF2b), GP3 (ORF 3), GP4 (ORF 4), và GP5 (ORF5) là những protein được
6
glycosyl hóa. Trong khi ORF6 mã hóa protein màng (M) thì nucleocapsid (N) được
mã hóa tại vùng ORF7, có vai trò gây đáp ứng kháng thể sớm nhất (Plana-Duran và
ctv, 1997). Đa số các xét nghiệm chẩn đoán bệnh PRRS chủ yếu là phát hiện kháng thể
chống lại protein nhân (Mateu và Diaz, 2008).
2.3. Chẩn đoán vi-rút PRRS
2.3.1. Phương pháp nuôi cấy tế bào
Phương pháp nuôi cấy vi-rút được thực hiện trên môi trường đại thực bào túi
phôi heo (PAMs: pulmonary alveolar macrophage) và dòng tế bào thận khỉ châu Phi
(MARC-145, CL2621). Han-Kook Chung và ctv (2002) cho rằng vi-rút PRRS dòng
Bắc Mỹ phát triển tốt hơn trên MARC-145, còn dòng châu Âu phát triển nhanh hơn
trên PAM. Phương pháp này cho độ chính xác cao nhưng tốn kém, phức tạp và thời
gian xét nghiệm lâu.
2.3.2. Phương pháp phát hiện kháng thể
Phương pháp xét nghiệm kháng thể trong huyết thanh như phản ứng kháng thể
huỳnh quang trực tiếp (IFA), phản ứng trung hòa huyết thanh (SNV - serum virus
neutralization), và ELISA (enzyme – linked immunosorbent assay) đều được sử dụng cho
việc phát hiện kháng thể đặc hiệu với vi-rút PRRS. Yoon và ctv (1995) cho rằng IFA có
độ đặc hiệu cao đến 99,5% nhưng độ nhạy khác nhau giữa các cá thể, phụ thuộc vào
thao tác xét nghiệm, sự khác biệt giữa kháng nguyên và kháng thể trên cơ thể heo. IFA
có thể phát hiện kháng thể vi-rút PRRS trên heo đã nhiễm từ 2- 3 tháng, nhưng không
thể phát hiện kháng thể vi-rút PRRS ở heo bị nhiễm sau 5 tháng. ELISA có độ nhạy và
đặc hiệu cao, có thể phát hiện kháng thể hoặc kháng kháng thể một cách nhanh chóng,
đơn giản nhưng tỷ lệ dương tính giả cao. Các kỹ thuật phát hiện kháng thể vi-rút có
chung nhược điểm: chỉ cho biết heo bị nhiễm vi-rút từ vacxin hay thực địa chứ không
chứng minh được vi-rút hiện có tồn tại trong cơ thể heo hay không.
2.3.3. Phương pháp RT-PCR
Kỹ thuật RT-PCR được sử dụng rộng rãi để chẩn đoán phân biệt hai dòng vi-rút
PRRS NA và EU trên vùng gen ORF7 của hai dòng này. Đây là vùng có tính bảo tồn
cao và có sự khác biệt lớn giữa hai dòng PRRSV (Egli và ctv, 2001). Hai dòng này có
độ tương đồng về gen khoảng 52 đến 81 %. Dựa trên cở sở đó nhiều cặp mồi đã được
thiết kế đề phát hiện PRRSV nói chung và để phân biệt dòng PRRSV Bắc Mỹ với châu
7
Âu (Nguyễn Ngọc Hải, 2007). Tuy nhiên, RT-PCR khó phát hiện vi-rút PRRS dòng Châu
Âu và không đủ nhạy để phát hiện vi-rút PRRS ở mức nhiễm thấp (Huỳnh Thị Thu
Hương, 2009).
2.3.4. Phương pháp nested RT-PCR
Phương pháp nested RT-PCR (nRT-PCR) giúp tăng độ nhạy của PCR và phát
hiện vi-rút ở hàm lượng thấp nhưng nguy cơ ngoại nhiễm cao do phải mở nắp ống
PCR lần hai (phản ứng inner) để cho sản phẩm PCR lần một vào (sản phẩm phản ứng outer).
2.4. Kỹ thuật real-time PCR chẩn đoán PRRSV
2.4.1. Kỹ thuật real-time PCR
Khác với các kỹ thuật PCR truyền thống, định tính bằng cách điện di trên gel
agarose sau khi phản ứng kết thúc, real-time PCR cho phép phát hiện và định lượng sự
tích lũy DNA khuếch đại ngay khi phản ứng đang xảy ra. Khả năng này được thực
hiện nhờ bổ sung vào phản ứng những phân tử phát huỳnh quang báo hiệu sự gia tăng
lượng DNA tỉ lệ với sự gia tăng tín hiệu huỳnh quang. Chất phát huỳnh quang bao
gồm thuốc nhuộm liên kết DNA và những trình tự gắn huỳnh quang liên kết đặc hiệu
với mồi gọi là mẫu dò. Kết quả được thiết bị gọi là máy luân nhiệt gắn bộ phận thu
nhận huỳnh quang thu nhận, cho phép kiểm soát tín hiệu huỳnh quang khi phản ứng
xảy ra. Tín hiệu huỳnh quang thu nhận được phản ánh lượng sản phẩm khuếch đại
trong mỗi chu kỳ (Bio-Rad).
2.4.2. Các chất phát huỳnh quang sử dụng trong real-time PCR
Có nhiều loại chất phát huỳnh quang được sử dụng nhưng thông dụng nhất là
SYBR Green (thuốc nhuộm gắn vào DNA) và mẫu dò Taqman.
2.4.2.1. SYBR Green
SYBR Green chỉ phóng thích một lượng nhỏ tín hiệu huỳnh quang khi nó ở dạng
tự do trong dung dịch nhưng khi liên kết với mạch đôi DNA, tín hiệu huỳnh quang sẽ
tăng lên một ngàn lần. Ưu điểm của SYBR Green là thiết kế phản ứng đơn giản (chỉ
cần hai mồi, không cần mẫu dò), kiểm tra được nhiều gen nhanh chóng, chi phí ban
đầu thấp nhưng đặc tính liên kết với bất cứ DNA mạch đôi nào cũng chính là trở ngại
lớn nhất của real-time PCR sử dụng SYBR Green. Khi có sự hiện diện của các sản
phẩm không đặc hiệu có thể làm tăng tín hiệu huỳnh quang tổng và ảnh hưởng đến độ
chính xác của kết quả định lượng. Hơn nữa, không thể sử dụng thuốc nhuộm liên kết
8
DNA cho phản ứng mutilplex bởi không thể phân biệt được tín hiệu huỳnh quang từ
các sản phẩm khác nhau. Chính vì vậy thường phân tích đường cong nóng chảy (melt-curve)
để nhận diện các sản phẩm phản ứng khác nhau trong phản ứng với SYBR Green (Bio-Rad).
2.4.2.2. Mẫu dò phân hủy (Taqman probe)
Mẫu dò Taqman là những trình tự oligonucleotide bổ sung đặc hiệu với DNA
đích, dài khoảng 24 đến 30 base với đầu 5’gắn chất phát huỳnh quang (reporter) và
đầu 3’ gắn chất hấp thụ tương ứng (quencher) để hấp phụ ánh sáng huỳnh quang được
phát ra từ reporter.
Hình 2.3 Cấu tạo của mẫu dò Taqman.
( />
Bảng 2.1 Một số cặp chất phát và hấp thụ huỳnh quang thường sử dụng
Chất phát
huỳnh quang
Chất hấp phụ huỳnh
quang
Bước sóng
kích thích
(nm)
495
Bước sóng
phát ra
(nm)
520
FAM
BHQ1,DABCYL,TAMRA
TET
BHQ1,DABCYL
521
536
HEX
BHQ1, BHQ2,DABCYL,
535
556
TAMRA
BHQ2,DABCYL
557
583
Texas Red
BHQ2, BHQ3, DABCYL
590
610
ROX
BHQ2, BHQ3, DABCYL
586
610
Cy5
BHQ2, BHQ3
647
667
(Bio-Rad Laboratories, Inc. Real-Time PCR-kỹ thuật và ứng dụng).
Việc chọn reporter phù hợp với quencher rất quan trọng, cần chính xác và hiệu
quả. Có nhiều loại chất phát huỳnh quang nhưng thường sử dụng cặp chất phát và hấp
thụ huỳnh quang fluorescein (FAM, chất phát màu xanh) và Black Hole Quencher 1.
Ưu điểm của mẫu dò Taqman là rất đặc hiệu, tỉ lệ huỳnh quang phát cao, có khả năng
thực hiện các phản ứng đa mồi (Bio-Rad).
9
2.4.3. Nguyên lý hoạt động real-time sử dụng mẫu dò Taqman
2.4.3.1. Cơ chế khuếch đại của real-time PCR sử dụng mẫu dò Taqman
Điểm khác biệt quan trọng nhất của real-time PCR so với các kỹ thuật PCR khác
là sử dụng enzyme có hoạt tính 5’-3’ exonuclease. Chính nhờ đặc tính này mà enzyme
có thể cắt đứt đầu gắn chất huỳnh quang khi nó tiếp xúc trong quá trình kéo dài
Hình 2.4 Cơ chế phát quang của Taqman trong phản ứng real-time PCR. 1.mồi và
probe gắn đặc hiệu vào DNA bắt đầu quá trình kéo dài, 2. enzyme kéo dài DNA, tiếp xúc với
đầu 5’ của probe, 3.enzyme cắt đứt đầu 5’ của probe nhờ hoạt tính 5’-3’ exonuclease, tín hiệu
huỳnh quang bắt đầu phát, 4.quá trình kéo dài kết thúc, probe bị tách hoàn toàn khỏi DNA
( />
Khi mẫu dò còn nguyên vẹn, tín hiệu huỳnh quang bị hấp thụ do chúng nằm gần
chất hấp thụ. Trong giai đoạn kết hợp bắt cặp và kéo dài DNA của phản ứng khuếch
đại, mẫu dò liên kết với trình tự đích và hoạt động 5’-3’ exonuclease đặc hiệu cho
DNA mạch đôi của enzyme Taq DNA Polymerase hay Tth DNA Polymerase sẽ cắt
đầu 5’ của mẫu dò và phóng thích chất phát huỳnh quang ra ngoài môi trường. Kết quả
là, chất phát huỳnh quang phát ra tỷ lệ với lượng sản phẩm khuếch đại trong mẫu (hình
2.3) (Bio-rad).
2.4.3.2. Đồ thị khuếch đại tín hiệu huỳnh quang trong phản ứng real-time
Nguyên lý hoạt động của real-time PCR được thể hiện trên đồ thị hình 2.4
với mối tương quan giữa trục hoành là số chu kỳ phản ứng còn trục tung là mức
huỳnh quang phát ra của từng phản ứng. Đồ thị khuếch đại thể hiện hai giai đoạn:
giai đoạn hàm mũ và giai đoạn bão hòa. Ban đầu tín hiệu ở mức tín hiệu nền không
10
thể phát hiện sự gia tăng tín hiệu mặc dù sản phẩm khuếch đại đã tăng theo hàm mũ.
Đến thời điểm xác định, tín hiệu huỳnh quang đạt ngưỡng phát hiện của máy, hay
chu kỳ ngưỡng Ct (threshold cycle), tín hiệu huỳnh quang sẽ liên tục nhân lên theo
hàm mũ logarit. Do chu kỳ ngưỡng được đo lường trong giai đoạn hàm mũ khi các
thành phần phản ứng chưa cạn kiệt nên real-time PCR có thể được sử dụng để tính
toán một cách chính xác và tin cậy lượng khuôn mẫu ban đầu hiện diện trong phản
ứng. Khi các thành phần phản ứng trở nên cạn kiệt, phản ứng sẽ bị chậm lại tiến tới
giai đoạn bão hòa (chu kỳ 28-40).
Hình 2.5 Biểu đồ thể hiện các giai đoạn của tín hiệu huỳnh quang trong
phản ứng real-time PCR (Phạm Hùng Vân, 2009).
2.4.4. Thành phần phản ứng real-time PCR dùng mẫu dò Taqman
Phản ứng real-time PCR sử dụng Taqman gồm các thành phần:
- PCR master mix
- Mẫu
- Mồi
- Mẫu dò
2.4.5. Tiêu chuẩn của một phản ứng PCR định lượng tối ưu
PCR định lượng dựa vào mối tương quan giữa mẫu ban đầu và giá trị chu kỳ
ngưỡng Ct thu được từ phản ứng khuếch đại, do vậy tối ưu phản ứng real-time PCR rất
cần thiết cho việc định lượng chính xác và lặp lại thí nghiệm. Các tiêu chuẩn của phản
ứng real-time PCR tối ưu bao gồm :
- Đường chuẩn tuyến tính (R2 = 0,980 hay r > |-0,990|).
11
- Hiệu quả khuếch đại cao: E (efficiency) = 90-105%.
- Mức đồng nhất qua các phản ứng lặp lại.
Cách đánh giá hiệu quả mức độ tối ưu của phản ứng real-time PCR là chạy một
loạt các độ pha loãng bằng nhau và lấy kết quả đó xây dựng đường chuẩn. Mẫu thí
nghiệm có thể đã biết trước nồng độ hoặc chưa biết nồng độ (ví dụ cDNA). Đường
chuẩn được xây dựng bằng cách vẽ đồ thị giá trị logarit lượng mẫu ban đầu hay hệ số
pha loãng của mẫu chưa biết nồng độ với giá trị ngưỡng thu được trong phản ứng
khuếch đại của từng độ pha loãng. Phương trình hồi quy tuyến tính với hệ số tương
quan Pearson r hay hệ số tương quan R2 (correlation coefficient) được sử dụng để đánh
giá mức độ tối ưu của phản ứng real-time PCR (Bio-rad).
Giá trị r hay R2 của đường chuẩn biểu thị sự phù hợp giữa dữ liệu thu nhận và
đường hồi quy, hay chính là mức độ tuyến tính của dữ liệu. Mức độ tuyến tính cho
phép đo lường sự biến thiên giữa các lần lặp lại và hiệu quả khuếch đại trên các mẫu
có lượng ban đầu khác nhau. Sự khác biệt lớn của giá trị chu kỳ ngưỡng qua các lần
lặp lại sẽ làm giảm giá trị r hay R2.
Đường chuẩn được dựng từ 7 chuẩn ở hình 2.6 với trục tung: chu kỳ ngưỡng – Ct
và trục hoành: giá trị logarit của số lượng bản sao ban đầu (Log Starting Quantity) có
đơn vị là số bản sao (copy number). Đường chuẩn thể hiện mối quan hệ giữa log số
bản sao ban đầu (X) và chu kỳ ngưỡng (Y). Thông qua chu kỳ ngưỡng được thể hiện
qua hình 2.4, giá trị log số bản sao ban đầu được xác định theo phương trình Y = a.X + b.
Đồ thị này còn thể hiện các mẫu dương tính qua các mẫu cần kiểm tra - các hiển thị
tương ứng với chu kỳ ngưỡng và log số bản sao ban đầu trên đường chuẩn. Theo Too
(2001), số bản sao trình tự đích ban đầu càng nhiều tương ứng với số chu kỳ ngưỡng
càng thấp.
Hiệu quả khuếch đại có giá trị gần 100% là chỉ thị tốt nhất cho phản ứng chính
xác và có thể lặp lại. Trong thí nghiệm, hiệu quả khuếch đại cần nằ trong khoảng từ
90-105%. Hiệu quả khuếch đại thấp có thể do mồi không đặc hiệu hoặc phản ứng chưa
tối ưu. Hiệu quả phản ứng trên 100% có thể do thao tác bơm hút mẫu sai trong dãy pha
loãng hay sự đồng khuếch đại các sản phẩm không đặc hiệu như cấu trúc nhị trùng của
cặp mồi (primer-dimer). Khi hiệu quả khuếch đại trên 105% cần xem lại vấn đề tối ưu
quy trình phản ứng hoặc độ đặc hiệu của mồi và mẫu dò.
12
Hình 2.6 Đường chuẩn cho phản ứng định lượng.
()
Ngoài mẫu, các thành phần sau cần phải có để đảm bảo độ tin cậy phản ứng real-time
PCR:
Đối chứng âm (NTC - no template control) cần được chạy cùng nhằm chứng
minh PCR mix không bị nhiễm DNA ngoại lai, quá trình thao tác không gây nhiễm
chéo hoặc nhiễm sản phẩm khuếch đại…
Đối chứng dương: DNA được cho vào PCR mix để sản phẩm khuếch đại có kích
thước và trình tự giống hệt sản phẩm DNA quan tâm. Thông thường đối chứng (+) là
dung dịch pha loãng ở nồng độ biết trước của plasmid đã được chèn đoạn DNA đích.
Đối chứng nội: là DNA khuếch đại song song với DNA đích nhưng có kích
thước khác trình tự DNA đích khác hoàn toàn hoặc khác một phần so với trình tự
DNA đích (khi sử dụng mẫu dò) (Phạm Hùng Vân, 2009).
2.4.6. Thiết kế mồi và mẫu dò cho phản ứng real-time PCR
Thiết kế mồi cần chú ý những nguyên tắc sau:
-
Mồi có hàm lượng GC từ 50-60%
-
Nhiệt độ nóng chảy Tm ở giữa 55-60oC
-
Tránh cấu trúc thứ cấp, điều chỉnh vị trí mồi ở bên ngoài cấu trúc thứ cấp của
trình tự đích nếu cần.
-
Tránh lặp lại base G và C hơn 3 lần.
-
Thiết kế base G và C ở đầu cuối của mồi.
-
Kiểm tra trình tự của mồi xuôi và ngược để đảm bảo không có sự bắt cặp bổ
sung đầu 3’ (tránh tạo hiện tượng primer-dimer).
13
-
Kiểm tra lại sự đặc hiệu bằng các công cụ chuyên dụng như Basic Local
Alignment Search Tool…
Để phản ứng xảy ra tốt, đoạn DNA nên có kích thước khoảng 75 - 200 bp, vì vậy nên
thiết kế mồi khuếch đại sản phẩm DNA kích thước này.
Thiết kế mẫu dò:
Giống như mọi thí nghiệm định lượng khác, real-time PCR sử dụng mẫu dò
Taqman yêu cầu sự khuếch đại hiệu quả và đặc hiệu sản phẩm. Nguyên tắc thiết kế
mẫu dò cũng tương tự mồi nhưng đặc biệt mẫu dò nên có nhiệt độ bắt cặp cao hơn Tm
mồi từ 5-10oC.
Mẫu dò thường ngắn hơn 30 nucleotide và không có base G ở đầu 5’ vì nó có thể
hấp thụ tín hiệu huỳnh quang ngay cả khi probe bị cắt đứt. Trình tự mẫu dò cần có tỷ
lệ GC khoảng 30 - 80% và có nhiều base C hơn G.
2.5. Một số nghiên cứu trong và ngoài nước về PRRSV
2.5.1. Nghiên cứu trên thế giới
Egli và ctv (2001) đã sử dụng kỹ thuật PCR truyền thống và real-time PCR sử
dụng Taqman để phát hiện và định lượng hai dòng vi-rút EU và NA của PRRS và xác
định ngưỡng phát hiện của Taqman đối với dòng NA là 102 TCID50 và dòng EU là
103 TCID50.
Wasilk và ctv (2004) so sánh độ nhạy và đặc hiệu trong phát hiện vi-rút PRRS
của kỹ thuật real-time PCR so với nested PCR trên mẫu huyết thanh và tinh dịch giữa,
kết quả nghiên cứu cho thấy real-time RT-PCR phát hiện lượng vi-rút ở giới hạn thấp
hơn, độ nhạy được quan sát vào khoảng 33 bản sao/ml.
Lurchachaiwong và ctv (2008) sử dụng real-time RT-PCR để phát hiện nhanh và
xác định hai dòng NA và EU của vi-rút PRRS với SYBR Green I, Taqman và giải
trình tự. Kết quả phát hiện vi-rút với độ nhạy là 104 bản sao đối với SYBR Green I, và
với mẫu dò Taqman là 103 bản sao.
Xiao và ctv (2008) phát hiện PRRSV gây độc lực cao gây ra trận dịch lớn tại
Trung Quốc năm 2006 bằng kỹ thuật real-time PCR với mẫu dò Taqman. Kết quả cho
biết PRRSV được phát hiện với độ nhạy 105 bản sao/ml.
2.5.2. Một số nghiên cứu tại Việt Nam
Trần Thị Bích Liên và Trần Thị Dân (2007) tiến hành khảo sát 1082 mẫu huyết
thanh tại 21 trại chăn nuôi công nghiệp và hộ chăn nuôi thuộc hai tỉnh miền Đông
14
Nam Bộ từ 2003 - 2005 nhằm xác định tỷ lệ nhiễm vi-rút PRRS khu vực này bằng kỹ
thuật ELISA phát hiện kháng kháng thể. Kết quả đã xác định tỷ lệ heo nhiễm PRRSV
hai tỉnh này là 36,78% và 85,71%.
Kim Văn Phúc và ctv (2007) khảo sát 23 mẫu nghi nhiễm PRRSV bằng kỹ thuật
nested RT-PCR, kết quả các mẫu nhiễm dòng Bắc Mỹ, không có mẫu nhiễm dòng
châu Âu.
Nhóm các nhà khoa học Việt Nam và Trung Quốc đã xác định đặc tính của dòng
vi-rút phân lập từ các ổ dịch trên heo xảy ra tại Việt Nam năm 2007, có sự tương đồng
bộ gen khoảng 99%, các dòng này đều bị mất 30 amino axit trên protein không cấu
trúc số 2 (nsp-2) (Feng và cs, 2009).
Lê Thanh Hòa và ctv (2008) phân tích trình tự ORF6 trên mẫu heo bệnh tại
Quảng Nam (TXMT1), kết quả cho thấy TXMT1 này thuộc type NA, có tỷ lệ đồng
nhất về thành phần nucleotide và tỷ lệ tương đồng về amino axit rất cao (99 - 100%)
với các dòng của Trung Quốc; thấp hơn so với dòng VR2332 (94 % về nucleotide, 96
%về aa); và rất thấp với dòng Lelystad (69 % nucleotide; 79 % aa). Điều này cho thấy
dòng TXMT1 của Việt Nam có biến đổi di truyền cao, có thể có cùng nguồn gốc phát
sinh với các dòng PRRSV độc lực cao của Trung Quốc.
Huỳnh Thị Thu Hương (2009) sử dụng kỹ thuật RT-PCR phát hiện vi-rút PRRS
trên các mẫu cho ELISA dương tính và trên máu, kết quả mẫu cho thấy chỉ nhiễm
PRRSV type NA với tỷ lệ 19,89% và khả năng phát hiện vi-rút trong máu cao hơn
trong huyết thanh.
Theo Nguyễn Ngọc Hải và ctv (2010), phân tích ORF5 của vi-rút PRRS tại Đồng
Nai và Tp.HCM cho thấy chúng thuộc nhóm Bắc Mỹ, cùng nhóm với chủng vi-rút
PRRS độc lực cao của Trung Quốc. So sánh trình tự aa của protein GP5 giữa các
chủng PRRSV Tp.HCM và Đồng Nai với chủng vacxin BSL-PS100 cho thấy không có
sự đột biến mất hay thêm vào, có khác biệt lớn tại vùng peptide tín hiệu (aa 1-31),
vùng chức năng trung hòa sơ cấp, vùng chức năng không trung hoà và mang tính trội
miễn dịch.
Các nghiên cứu về PRRS tại Việt Nam đã xác định phần lớn vi-rút gây bệnh
PRRS ở nước ta thuộc dòng Bắc Mỹ bao gồm cả nhóm Bắc Mỹ cổ điển và biến chủng
độc lực cao có nguồn gốc từ Trung Quốc.
15