axit nitric và muối nitrat
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (4.47 MB, 37 trang )
BÀI GiẢNG HÓA HỌC 11
CHÀO MỪNG QUÝ THẦY CÔ ĐẾN DỰ GIỜ
THĂM LỚP
00:22
00:59
00:55
00:52
00:29
00:25
00:56
00:57
00:53
00:54
00:49
00:50
00:51
00:45
00:42
00:39
00:35
00:32
00:26
00:27
00:23
00:24
00:19
00:20
00:21
00:15
00:12
00:09
00:05
00:02
01:00
00:58
00:46
00:47
00:48
00:43
00:44
00:40
00:41
00:36
00:37
00:38
00:33
00:34
00:30
00:31
00:28
00:16
00:17
00:18
00:13
00:14
00:10
00:11
00:06
00:07
00:08
00:03
00:04
00:00
00:01
KHỞI ĐỘNG
Câu đố sau :
“ Muối gì làm thuốc súng
Sức công phá phi thường
Nhưng các bà nội trợ
Lại dùng làm lạp sưởng?”
KNO3 ( diêm tiêu)
TRƯỜNG THPT NGUYỄN ĐÌNH CHIỂU
TỔ: HÓA – SINH – CN
TCT 14:
Bài 9: Axit nitric (tiết 1)
Giáo viên: Trần Thị Loan
Lớp: 11A9
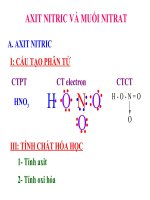
A. AXIT NITRIC
I. CẤU TẠO PHÂN TỬ
II. TÍNH CHẤT VẬT LÍ
III. TÍNH CHẤT HÓA HỌC
IV. ỨNG DỤNG
V. ĐIỀU CHẾ
A. AXIT NITRIC
I. CẤU TẠO PHÂN TỬ
Phiếu học tập số 1
1. Từ kiến thức đã học về liên kết hóa học (lớp 10) hãy viết công thức electron, công thức cấu tạo của axit
nitric?
2. Nêu tính chất vật lí của axit nitric?
3. Dựa vào cấu tạo phân tử và độ âm điện của N hãy dự đoán tính chất hóa học của axit nitric?
4. Hãy chỉ ra những tính chất hóa học chung và khác biệt giữa HNO 3 và H2SO4?
5. Tính chất muối nitrat và ứng dụng?
A. AXIT NITRIC
I. CẤU TẠO PHÂN TỬ
+5
Công thức cấu tạo
Mô hình phân tử
A. AXIT NITRIC
II. TÍNH CHẤT VẬT LÍ
-Axit HNO3 tinh khiết là chất lỏng, không màu, bốc khói mạnh trong không khí ẩm
2. Nêu tính chất vật lí của axit nitric?
- Axit HNO3 kém bền.
- Axit HNO3 tan
theo bất
kỳ tỉ lệ nào.
Khitrong
có ánhnước
sáng, HNO
3 bị phân hủy tạo thành NO2.
4 HNO3 →4 NO2 + O2 + 2H2O
→ Dung dịch có màu vàng.
→ Bảo quản trong bình tối màu
A. AXIT NITRIC
III. TÍNH CHẤT HÓA HỌC
h đoán tính chất
ndự
3. Dựa vào cấu tạo phân tử và độ âm điện của N hãy
ạ
m
hóa học của axit nitric?
H
nh
ạ
m
it
x
a
h
n
Tí
n
Tí
O
+5
m
oá
h
xi
o
h
O
N
O
A. AXIT NITRIC
III. TÍNH CHẤT HÓA HỌC
1. Tính axit
+ Làm quỳ tím hóa đỏ
+ Tác dụng với oxit bazơ
2HNO3 + CuO → Cu(NO3)2 + H O
2
+ Tác dụng với bazơ
HNO3 + NaOH →NaNO3
+ H2O
+ Tác dụng với muối của axit yếu hơn
2HNO3 + CaCO3 →Ca(NO3)2 + CO2↑ + H2O
III. TÍNH CHẤT HÓA HỌC
2. Tính oxi hóa
a. Tác dụng với kim loại
Với M là kim loại, n: hóa trị cao nhất của M
O 3đ
N
H
ặc
NO2
H2O
+
M
+
HNO3 loãng
M(NO3)n+
M khử TB,yếu:
HNO3
NO
H2O
+
Pb, Cu, Ag…
HN
O
M
3l
:k
oã
hử
ng
Al
m
,M
g,
Ca
…
ạn
h:
N O
2
N
2
NH4NO3
+
H2O
LƯU Ý
* NO2 là khí màu nâu đỏ.
* NO là khí không màu, hóa nâu
trong không khí.
* N2O là khí vui, khí gây cười.
* N2 không duy trì sự hô hấp, sự cháy.
* NH4NO3 không sinh ra ở dạng khí, nhưng khi cho kiềm vào dung dịch,
thấy có khí mùi khai thoát ra.
III. TÍNH CHẤT HÓA HỌC
2. Tính oxi hóa mạnh
a. Tác dụng với kim loại: Trừ Au, Pt
0
+5
+2
+2
3Cu + 8HNO3 loãng→ 3Cu(NO3)2 + 2NO+4H2O
0
+5
+2
+4
Cu + 4HNO3 đặc→ Cu(NO3)2 + 2NO2 + 2H2O
Lưu ý: Trong dung dịch HNO3 đặc, nguội: Fe, Al và Cr bị thụ động hóa.
III. TÍNH CHẤT HÓA HỌC
2. Tính oxi hóa
b. Tác dụng với phi kim (C, S, P)
0
+5
+6
+4
S + 6HNO3 đặc → H2SO4 + 6NO2 + 2H2O
0
+5
+4
+4
C + 4HNO3 đặc → CO2 + 4NO + 2H O
2
2
III. TÍNH CHẤT HÓA HỌC
2. Tính oxi hóa
c. Tác dụng với hợp chất (FeO, SO2, H2S...)
Ví dụ:
3FeO + 10HNO3 (loãng) → 3Fe(NO3)3 + NO
3H2S + 2HNO3 (loãng) → 3S + 2NO + 4H2O
+ 5H2O
4. Hãy chỉ ra những tính chất hóa học chung và khác biệt giữa HNO 3 và
H2SO4?
So sánh tính chất HNO3 và H2SO4
HNO3
H2SO4
Giống nhau: Đều là axit mạnh
HNO3 ngoài tính axit mạnh còn thể hiện tính oxh
H2SO4 chỉ thể hiện tính oxh mạnh ở nồng độ đậm
mạnh ở mọi nồng độ.
đặc.
Khí
Khí NO
nào2gây
, NOralàhiện
nguyên
tượng
nhân
mưa
gây
axit
ra
hiện tượng mưa axit, làm ô nhiễm môi
trường
Vậy chúng ta xem một số hình ảnh về nguyên nhân sinh ra khí NO2, NO và hậu quả ảnh hưởng đến
môi trường
N2 + O 2
2NO
2NO + O2 → 2NO2
4NO2 + O2 + 2H2O → 4HNO3
Mưa axit