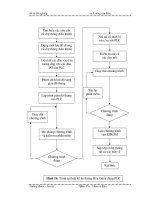
ĐIỆN PHÂN DD KHÔNG THOÁT KIM LOẠI
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (1.15 MB, 48 trang )
MÔNCÔNG
CÔNGNGHỆ
NGHỆĐIỆN
ĐIỆNHÓA
HÓA
MÔN
CHƯƠNG 4: ĐIỆN PHÂN
DUNG DỊCH NƯỚC
KHÔNG THOÁT KIM LOẠI
4.1
• Một số khái niệm điện phân dung dịch
không thoát kim loại
4.2
• Phương pháp điện phân sản xuất
NaOH – Cl2
4.3
• Quy trình của các phương pháp điện
phân điều chế các hợp chất clo: NaClO,
NaClO3 và NaClO4
4.1
Một số
khái niệm
điện phân
dung dịch
không
thoát kim
loại
1. Cơ sở lý thuyết
a. Các quá trình điện cực
Điện phân dung dịch muối ăn theo phương pháp catôt
rắn và anôt không tan, trong dung dịch có những loại
ion sau:
NaCl → Na+ + ClH2O → H+ + OH-.
Quá trình trên catôt:
H+ + e → H
H + H → H2
Nồng độ ion hyđro trong dung dịch rất nhỏ. Bởi vậy
hyđro sinh ra trên catôt là do sự phân huỷ nước:
2H2O + 2e → 2H+ + 2OHNa+ đến catôt kết hợp OH- tạo thành xút:
Chúng ta biết rằng: điện thế điện cực tiêu chuẩn của H+ = 0,
điện thế điện cực tiêu chuẩn của Na+ = -2,7V. Bởi vậy trên
điện cực rắn mặc dù nồng độ H+ rất nhỏ nhưng chỉ có H+
phóng điện còn Na+ không thể phóng điện được do điện thế
phóng điện của ion H+ dương hơn điện thế phóng điện của ion
Na+ .
Quan sát đường cong phân cực hình 3 chúng ta thấy rằng: Sự
phân cực phụ thuộc không những vào nhiệt độ, thành phần
• Quá trình trên anốt:
Cl - e → ClCl + Cl → Cl2
Ở anôt Cl- phóng điện.
Ở đây ta thấy rằng điện thế thuận nghịch phóng điện của ion
OH- âm hơn do với điện thế thuận nghịch phóng điện của
ion Cl- trong dung dịch NaCl bão hòa.
Trong dung dịch NaCl bão hòa ở 1800C điện thế thuận
nghịch phóng điện của ion OH- là:
εOH - = 0,41 – 0,058lg( 0,8x10-7) = 0,82.
Điện thế thuận nghịch phóng điện của ion Cl- cũng ở
điều kiện trên là:
εCl - = 1,36 – 0,058lg( 5,5 – 0,6) = 1,33V.
Như vậy, rõ ràng ion OH- có khả năng phóng điện lớn
hơn ion Cl- . Muốn cho Clphóng điện ưu tiên thì phải
cho nguyên liệu làm anôt thế nào cho quá thế oxy lớn
nhất mà quá thế clo lại nhỏ nhất.
Khi giá trị điện thế đạt đến giá trị điện thế cân bằng của oxy thì oxy sẽ tỏa ra
trên anôt, nhưng khi giá trị điện thế đạt đến điện thế cân bằng của clo thì clo
cùng với oxy tỏa ra trên anôt, nhưng clo tăng rất nhanh khi tăng mật độ
dòng điện.
Khi mật độ dòng điện đạt 1000A/m2 , tổn thất cho sự phóng điện hyđro chỉ
chiếm một vài phần trăm dòng điện. Đường cong phân cực anôt khi tỏa clo
từ dung dịch 260 – 280 g/l NaCl( hình 5).
Clo tỏa ra trên anôt manhêtic (đường 4) có phân cực anôt lớn hơn grafit
(đường cong 3). Nâng cao nhiệt độ thì phân cực giảm. Sự hòa tan clo trên
b. Điện thế phân hủy
Quá trình tổng của sự phân hủy NaCl thể hiện theo phương trình
sau:
2H2O + 2e → H2 + 2OH2Cl- - 2e → Cl2
Tổng: 2H2O + 2Cl- → Cl2 + H2 + 2OH2H2O + 2NaCl → Cl2 + H2 + 2NaOH
Đại lượng điện thế thuận nghịch có thể tính theo phương trình
Neo, nếu biết được hoạt độ của ion H+ và Cl- ở gần điện cực.
Điện thế thuận nghịch catot εH2 và anot εCl2 được biểu diễn dạng
sau:
- εH2 = ε0 H2 + 0,000198T.lgaH+
- εCl2 = ε0 Cl2 + 0,000198T.lgaCl–
• Chất đệm: có những tác dụng sau:
+Ổn định pH của dung dịch mạ, tùy theo khoảng pH sử dụng
mà cho các chất cho phù hợp.
Ví dụ: H3BO3 sử dụng trong dung dịch mạ nikensunfat
NaCH3COO, CH3COOH… trong mạ hóa học Ni
+Tăng độ dẫn điện của dung dịch:
Những chất này có tính chất làm giảm điện trở dung dịch
nhưng không tham gia phản ứng điện cực nhằm tăng khả năng
phân bố
Các chất phụ gia thường gặp:
Na2SO4 trong mạ Zn, Ni, sulfat
H2SO4 trong mạ đồng sulfat
• Chất hoạt động bề mặt
Chất hoạt động bề mặt sẽ hấp phụ trên bề mặt catot, sự hấp
phụ này phụ thuộc vào dạng chất hoạt động bề mặt (chiều dài
phân tử, nhóm phân cực, sự phân cực trong phân tử ) nồng độ
chất hoạt động bề mặt, nhiệt độ, điện tích của catot và các
chất khác của dung dịch tham gia vào lớp điện tích kép.
c. Điện thế catot
Nồng độ H+ được xác định từ phương trình phân ly nước.
H2O → H+ + OH-
Vì [H2O] = const nên K’ = [H+ ].[OH- ] ở 250C. K’ = 1,05. 10-14
Nồng độ ion OH- ở catot bằng nồng độ xút vì nó là chất điện ly mạnh phân ly hoàn
toàn. Hoạt độ của ion OH- là:
a = COH- .f”a
Người ta suy f”a từ lực ion của dung dịch.
N=1/2*(m1z12 + m2z22 + ….)
m – Nồng độ phân tử của ion.
Z – Hóa trị của ion.
d. Điện thế anot
Điện thế phân hủy lý thuyết NaCl ở 250C là:
E = 1,332 – (- 0,836) = 2,168V
Hiệu ứng nhiệt của quá trình tổng khi điện phân có thể xác
định theo phương trình:
NaCl.nH2O + H2O → NaOH.nH2O + 1/2Cl2 + 1/2H2
Có thể suy ra từ hiệu ứng nhiệt của các phản ứng:
1. Nhiệt tạo thành NaCl từ các nguyên tố:
Na + 1/2Cl2 → NaCl + 97,69Kcal
2. Nhiệt hòa tan NaCl khan trong nước:
NaCl + nH2O → NaCl.nH2O – 0,458Kcal
3. Nhiệt tạo thành dung dịch xút từ natri và nước:
Na + (n + 1)H2O → NaOH.nH2O + 1/2H2 = 44,38
Kcal.
Nhiệt lượng tiêu hao là:
Q = 97,69 – 44,838 = 52,852 Kcal.
e. Quá thế.
- Quá thế hydro: Điện thế lý thuyết của điện cực hydro trên bạch kim phủ
bạch kim khi dòng điện cực tiêu chuẩn.
Điện thế phóng điện của ion H+ trên điện cực khác nhau thì khác nhau.
Hiệu số giữa điện thế điện cực cân bằng hydro trên bạch kim phủ bạch kim và điện
thế bất kỳ nào đó gọi là quá thế hydro.
- Quá thế oxy:
Điện thế điện cực oxy lý thuyết( áp suất bằng áp suất khí quyển và nhiệt độ là 18 0C)
là: 1,23 V dương hơn điện thế hydro trong dung dịch đó. Điện thế điện cực hydro
trong dung dịch tiêu chuẩn ( COH - = 1) bằng -0,82V.
Điện thế điện cực oxy trong dung dịch tiêu chuẩn bằng:
E = -0,82 + 1,23 = 0,41V
Trong dung dịch trung hòa E = -0,82V.
Nhưng trong thực tế oxy tỏa ra luôn luôn có điện thế lớn hơn, phần lớn hơn đó gọi là
quá thế của oxy.
- Quá thế clo:
Sự phóng điện của Cl- trên điện cực bạch kim
thường không kèm theo hiện tượng quá thế,
nhưng đối với những nguyên liệu khác thể
hiện rất rõ
2. Điện cực và màng
a. Anot
Yêu cầu bền hóa học với các chất O2, Cl2, HCl, HClO.
Ngoài ra cần phải chọn nguyên liệu làm anot để quá thế Cl 2 nhỏ và O2 lớn, có độ bền cơ
học cao dễ chế tạo và rẻ tiền.
- Bạch kim:
Thời kỳ đầu anot bạch kim được dùng ở dạng lá mỏng hay lưới, làm việc được với mật
độ dòng điện cao: 15000 – 20000 A/m2 . Nhưng ngày nay thế giới ít dùng vì đắt tiền.
- Anot cacbon:
Có hai dạng chủ yếu là than và grafit.
Nguyên liệu chủ yếu của anot than là cốc và than antracit đốt nóng đến 1400 0C. Loại
này có điện trở cao độ dẫn điện dẫn nhiệt nhỏ và độ tro lớn.
Điện cực grafit dùng chế tạo từ cốc gia công nhiệt trong lò điện nhiệt độ cao 2000 0c
Loại này có độ dẫn điện, dẫn nhiệt cao và độ trở nhỏ.
Anot than chỉ dùng vào những năm đầu về sau người ta dùng anot
grafit có độ bền cao và điện thế thấp khi tỏa clo là tính chất quan
trọng nhất của điện cực grafit
Trong điều kiện làm việc bình thường anot grafit hoàn toàn bền
ở nhiệt dộ < 1000C và sản phẩm chủ yếu ở anot là clo. Trong
quá trình làm việc anot grafit dần dần bị phá hủy do tác dụng
của oxy hoạt động. Sản phẩm này luôn luôn lẫn vào hỗn hợp
khí clo. Ngoài phân hủy hóa học ra grafit còn bị phân hủy cơ
học. Tốc độ phân hủy phụ thuộc vào điều kiện kỹ thuật thao tác.
Sự phân hủy anot tăng cao khi tăng cao nhiệt độ, mật độ dòng
điện nhưng nếu tính theo đơn vị sản phẩm thì sự tiêu hao grafit
giảm khi nâng cao mật độ dòng điện.
b. Catôt
Thường bằng sắt cấu tạo từ sắt tấm dày 1,5 – 2mm có
dùi lỗ hay ở dạng lưới. Cấu tạo theo
Sở dĩ cấu tạo như vậy là vì để tăng tiết diện làm việc và cho dung dịch
cũng như hydro qua các khe nhỏ.
Diện tích lỗ thường chiếm 25 – 30% diện tích catôt.
c. Màng
Màng để phân riêng khu vực catôt và anôt.
Tùy theo nguyên tắc làm việc có thể chia ra làm hai loại: màng ngăn và màng lọc:
- Màng ngăn: phân riêng hẳn khu vực catôt và anôt chỉ cho ion đi qua mà không cho
dung dịch đi qua.
Yêu cầu:
+ Bền hóa học với xút và axit, độ bền cơ học cao.
+ Trở lực khuếch tán lớn.
+ Có khả năng cho các ion tự do đi qua, điện trở màng nhỏ.
- Màng lọc: Cho cả ion và dung dịch đi qua.
Yêu cầu: bền cơ học, bền hóa học và điện trở nhỏ.
Tính chất lý học của màng:
+ Độ xốp: Trong thực tế người ta tính độ xốp thể tích nghĩa là tính tỷ lệ thể tích lỗ
trống và thể tích màng:
- Lượng chất lỏng đi qua màng (Q cm3 ) phụ thuộc vào bề mặt tác dụng (S
dm2 ), chiều dày màng ( δ cm), thời gian tiến hành (τ giờ), áp suất tĩnh học
của chất lỏng (H cm), và độ nhớt của chất lỏng (η cantipor).
K: hệ số đặc trưng tính chất của màng.
K = Q nếu SH τ δ η bằng đơn vị
- Điện trở màng:
- Khuếch tán: Sự khuếch tán chất lỏng qua màng tỷ lệ với nồng độ về hai
phía của màng (C’ – C) thời gian τ và hệ số khuếch tán Δ khi nồng độ và
nhiệt độ biết trước.
Nếu P xác định bằng thực nghiệm có thể tính β, Δ. Hệ số khuếch tán có thứ nguyên là:
cm2 /gy; cm2 /giờ; cm2 /ngày .
Có thể xác định Δ theo công thức: Δ t2 = Δ t1[ 1 + 0,024(t2 – t1)]
Sản xuất xút - clo theo phương pháp cũ với chất điện giải không chuyển động,
người ta dùng màng xi măng. Ngày nay, người ta dùng màng amiang, hay gây
kết tủa trên lưới catôt.
Những khoáng chất thiên nhiên của amiang là (Mg, Fe)SiO 3; H4(Mg, Fe)3Si2O6.
Loại này có nhiều ở Liên Xô và nhiều nước trên thế giới.
4.2
Phương
pháp
điện
phân
sản xuất
NaOH
và Clo
1. Điều kiện điện phân
Ðể thực hiên tốt quá trình điện phân ,cần
phải bảo đảm các điều kiện dưới đây:
- Duy trì mức độ phân hủy muối ăn khoảng
45 - 55%
- Muối không bị phân hủy sẽ theo dung
dịch xút ra ngoài thùng điện phân .
- Nồng độ muối ăn trong dung dịch gần
như bão hòa (khoảng 310 - 315 g/l)
vì dung dịch càng đậm đặc thì dộ tan của
Cl càng thấp .
- Nhiệt độ điện phân tương đối cao, khoảng 85 97oC,nhiệt độ cao cũng có tác dụng hạn chế các quá
trình điện phân như dung dịch muối đậm đặc.
2. Quy trình sản xuất xút và clo :
Các phương pháp sản xuất điện phân phổ biến:
- Phương pháp catot rắn với màng ngăn
- Phương pháp catot Hg