Bài giảng Hóa học đại cương - Chương 2: Hệ thống tuần hoàn các nguyên tố hóa học
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (3.61 MB, 64 trang )
CHƯƠNG II
HỆ THỐNG TUẦN HOÀN CÁC
NGUYÊN TỐ HÓA HỌC
Dimitri Mendeleev
CHƯƠNG II. HỆ THỐNG TUẦN HOÀN
I.
ĐỊNH LUẬT TUẦN HOÀN VÀ ĐIỆN TÍCH
HẠT NHÂN NGUYÊN TỬ
II.
CẤU TRÚC ELECTRON NGUYÊN TỬ VÀ
HỆ THỐNG TUẦN HOÀN CÁC NGUYÊN
TỐ HÓA HỌC
III. CẤU TRÚC ELECTRON NGUYÊN TỬ VÀ
SỰ THAY ĐỔI TÍNH CHẤT CỦA CÁC
NGUYÊN TỐ TRONG HTTH
I. ĐỊNH LUẬT TUẦN HOÀN VÀ ĐIỆN
TÍCH HẠT NHÂN NGUYÊN TỬ
• Tính chất các đơn chất cũng như
dạng tính chất của các hợp chất
thay đổi tuần hoàn theo chiều tăng
điện tích hạt nhân nguyên tử.
Modern Periodic Table
II. ĐỊNH LUẬT TUẦN HOÀN VÀ ĐIỆN
TÍCH HẠT NHÂN NGUYÊN TỬ
1. Các họ nguyên tố s, p, d, f
2. Chu kỳ
3. Nhóm
4. Cách xác định vị trí ngtố trong bảng
HTTH
1. Các họ nguyên tố s, p, d, f
a. Các nguyên tố họ s (ns1,2):
ns1 – kim loại kiềm
ns2 – kim loại kiềm thổ
b. Các nguyên tố họ p (ns2np1-6) :
ns2np1 ns2np2 ns2np3 ns2np4
B - Al
C - Si
N-P
ns2np5
ns2np6
O - S Halogen Khí trơ
c. Các nguyên tố họ d (n-1)d1-10ns1,2 : KL chuyển tiếp
d. Các nguyên tố họ f (n-2)f1-14(n-1)d0,1ns2 :
các nguyên tố đất hiếm
4f1 – 14 : lantanoit
5f1 – 14 : actinoit
‘s’-groups
Beyond the d-orbitals
d-transition elements
lanthanides
actinides
f-transition elements
‘p’-groups
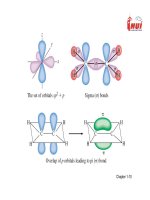
s- and p-orbitals
1s
2s
n=1
l=0
ml = 0
n=2
l=0
ml = 0
2p
H: 1s1
n=2
l=0
ml = -1 ml = 0
ml = 1
s- and p-orbitals
1s
2s
n=1
l=0
ml = 0
n=2
l=0
ml = 0
2p
He: 1s2
n=2
l=0
ml = -1 ml = 0
ml = 1
s- and p-orbitals
1s
2s
n=1
l=0
ml = 0
n=2
l=0
ml = 0
2p
Li: 1s2 2s1
n=2
l=0
ml = -1 ml = 0
ml = 1
s- and p-orbitals
1s
2s
n=1
l=0
ml = 0
n=2
l=0
ml = 0
2p
Be: 1s2 2s2
n=2
l=0
ml = -1 ml = 0
ml = 1
s- and p-orbitals
1s
2s
2p
B: 1s2 2s22p1
electron hoá trị
s- and p-orbitals
1s
2s
2p
C: 1s2 2s22p2
Hund’s rule: maximum number of unpaired electrons is
the lowest energy arrangement.
s- and p-orbitals
1s
N: 1s2 2s22p3
O: 1s2 2s22p4
2s
2p
s- and p-orbitals
1s
F: 1s2 2s22p5
Ne: 1s2 2s22p6
2s
2p
s- and p-orbitals
Na: 1s22s22p63s1
or [Ne]3s1
1s22s22p63s2
[Ne]3s2
Mg:
or
P: [Ne]3s23p3
Ar: [Ne]3s23p6
2. Chu kỳ.
Là dãy các nguyên tố viết theo hàng ngang
trong CK tính chất các ngtố biến đổi tuần hoàn
STT chu kỳ = n của lớp electron ngoài cùng
Chu kỳ I (CK đặc biệt): chỉ có 2 nguyên tố họ s
Chu kỳ II, III (CK nhỏ): 8 nguyên tố = 2(s) + 6(p)
Chu kỳ IV, V (CK lớn): 18 ngtố = 2(s) + 10(d) + 6(p)
Chu kỳ VI (CK hoàn hảo): 32 ngtố = 2(s) + 14(f) +
10(d) + 6(p)
Chu kỳ VII (CK dở dang): có 2(s) + 14(f) + ... (d)
3. Nhóm:
là cột dọc các ngtố có tổng số e hóa trị bằng nhau
Phân nhóm: Các ngtố có cấu trúc e tương tự nhau
tính chất hóa học tương tự nhau
8 phân nhóm chính A (nguyên tố họ s và p)
8 phân nhóm phụ B (nguyên tố họ d và f)
Phân nhóm chính A (nguyên tố họ s và p)
Số thứ tự PN chính = tổng số e ở lớp ngoài cùng
( tổng số e hóa trị)
IA
IIA
ns1
ns2
IIIA
IVA
VA
VIA
VIIA
VIIIA
ns2np1 ns2np2 ns2np3 ns2np4 ns2np5 ns2np6
Phân nhóm phụ B (các nguên tố họ d và f)
Số thứ thự PNP = tổng số e trên ns và (n - 1)d
IIIB
IVB
VB
VIB
ns2(n-1)d1
Nguyên tố f
VIIB
ns2(n-1)d2
ns2(n-1)d3
VIIIB
IB
ns2(n-1)d4
ns1(n-1)d5
IIB
ns2(n-1)d5
ns2(n-1)d6,7,8
ns2(n-1)d9
ns1(n-1)d10
ns2(n-1)d10
Tất cả các nguyên tố d và f đều là kim loại
• PNP VIIIB có 9 nguyên tố
• PNP IIIB có 14 PNP thứ cấp (PNP loại 2):
6s24f1 – 14 : lantanoit
7s25f1 – 14 : actinoit
4. Cách xác định vị trí ngtố trong bảng HTTH
• Số thứ tự = Z = e + q
• Số thứ tự chu kỳ = nmax
• Số thứ tự nhóm = tổng số e hoá trị (nằm trên
AO hóa trị)
– Các nguyên tố họ s, p: nằm ở PNC (A).
AO hóa trị: nsnp
– Các nguyên tố họ d:
nằm ở PNP (B).
AO hoá trị: ns(n – 1)d
Nguyên tố d (n-1)dansb a = 10 số nhóm = b
a < 6 số nhóm = a+b
a = 6,7,8 số nhóm = VIIIB
– Các nguyên tố họ f thuộc PNP IIIB
III. CẤU TRÚC e NGTỬ VÀ SỰ THAY
ĐỔI T/C CỦA CÁC NGTỐ
1. Bán kính nguyên tử và ion
2. Năng lượng ion hóa I
3. Ái lực electron F
4. Độ âm điện
5. Số oxy hóa
Trong một phân nhóm:
Cấu trúc e tương tự tính chất hóa học tương tự.
Từ trên xuống: số lớp electron tăng → lực hút của
hạt nhân đối với e ngoài cùng giảm:
• tính kim loại tăng, tính phi kim giảm
• tính khử tăng, tính oxi hóa giảm
Trong một chu kỳ:
số lớp e không thay đổi,
tổng số e lớp ngoài cùng tăng lực hút của
hạt nhân đối với e ngoài cùng tăng:
• tính kim loại giảm, tính phi kim tăng
• tính khử giảm, tính oxi hóa tăng
1. Bán kính nguyên tử và ion
a. Quy ước về bán kính
b. Bán kính nguyên tử
c. Bán kính ion