Thu thập dịch tiết từ fasciola gigantica và sử dụng làm kháng nguyên trong chẩn đoán
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (1.31 MB, 45 trang )
1
PHẦN 1: MỞ ĐẦU
1.2 Đặt vấn đề
Bệnh do sán lá lớn ở gan là bệnh phổ biến ở trâu bò và các động vật khác
như dê, cừu. Bệnh có khả năng lây truyền qua người do ăn rau sống mọc dưới nước có
chứa nang trùng. Có hai loại sán lá lớn ở gan là Fasciola gigantica và Fasciola
hepatica.
Fasciola gigantica phổ biến ở những vùng nhiệt đới như Đông Nam Á,
Châu Phi, Hawaii, Pakistan và Thái Lan; còn Fasciola hepatica phổ biến ở Châu Âu,
vùng Đông Nam Châu Phi, Mỹ, Châu Úc và Nhật Bản.
Các cơng trình nghiên cứu của những tác giả trong nước cho thấy động vật
ăn cỏ ở Việt Nam nhất là trâu bò bị nhiễm sán lá gan cao và đa số là do F. gigantica.
Bệnh sán lá gan làm giảm trọng lượng con vật rõ rệt, giảm phẩm chất của
thịt (thịt bị thấm ướt), giảm sức chống đỡ với các bệnh khác, làm giảm lượng sữa ở
trâu bị ni lấy sữa.
Ở Việt Nam, trước đây bệnh do Fasciola sp ở người chưa được phát hiện.
Tuy nhiên, tỉ lệ người mắc bệnh này đang có chiều hướng gia tăng được xác định với
kỹ thuật chẩn đoán bệnh này ngày càng chính xác hơn.
Theo các cơng trình nghiên cứu khoa học trên thế giới, khi ký sinh trong cơ
thể vật chủ, sán lá gan lớn sẽ tiết ra các chất có đặc tính sinh học và là kháng nguyên
(nên còn gọi là kháng nguyên tiết) đối với thể chủ. Loại kháng nguyên này được đánh
giá là có mức độ đặc hiệu cao hơn kháng nguyên thân và kháng ngun bề mặt, do đó
việc chẩn đốn bệnh sán lá gan sẽ chính xác hơn nếu sử dụng loại kháng ngun này.
Ngồi ra, trong dịch tiết này cịn có thành phần cysteine-protease được biết như là một
enzyme thiết yếu cho cầu ký sinh giữa ký sinh vật và thể chủ. Enzyme tinh chế đã
được dùng làm vaccine tiêm chủng trên cừu cho thấy, mặc dù khơng loại trừ được
hồn tồn sự phát triển của sán lá gan nhưng kết quả thí nghiệm đã chứng minh có sự
giảm hoặc làm mất hẳn sự xuất hiện của trứng sán trong phân. Điều này cũng góp
phần hạn chế sự lây lan của dịch bệnh, giảm thiệt hại kinh tế.
2
Những nhận định trên đã được sự đồng ý của Bộ môn Công Nghệ Sinh Học
– trường Đại Học Nông Lâm TPHCM và Viện Pasteur TPHCM. Dưới sự hướng dẫn
của TS.Nguyễn Ngọc Hải và PGS.TS. Nguyễn Lê Trang, chúng tôi tiến hành thực hiện
đề tài: “Thu thập dịch tiết từ Fasciola gigantica và sử dụng làm kháng nguyên trong
chẩn đoán” để xây dựng quy trình tạo kháng thể cho mục đích chẩn đốn y học và
nghiên cứu cơ chế ký sinh của sán lá gan.
1.2 Mục đích của đề tài
Khảo sát hoạt động kháng nguyên của các thành phần trong dịch tiết.
Xây dựng quy trình tạo kháng thể đặc hiệu với kháng nguyên tiết.
Dùng kháng thể của bệnh nhân đặc hiệu với kháng nguyên tiết tạo kỹ
thuật chẩn đoán.
Khảo sát hoạt tính của cystein-protease trong dịch tiết.
1.3 Yêu cầu
Thực hiện các kỹ thuật miễn dịch liên quan đến bệnh do sán lá lớn ở gan:
Thu thập sán và dịch tiết.
Xác định nồng độ protein trong dịch tiết của sán lá gan lớn (Fasciola gigantica)
bằng phương pháp Bradford.
Xác định thành phần protein trong dịch tiết bằng phương pháp điện di
SDS-PAGE 12%.
Kiểm tra phản ứng giữa kháng thể trong huyết thanh bệnh nhân nhiễm
Fasciola sp và kháng nguyên tiết trong dịch tiết của sán lá gan lớn bằng
phương pháp miễn dịch khuếch tán kép Ouchterlony.
Tạo cột sắc ký ái lực Sepharose 4B - kháng nguyên tiết để tinh chế
kháng thể đặc hiệu với kháng nguyên tiết của sán lá gan lớn.
Tinh chế kháng thể kháng Fasciola sp từ huyết thanh bệnh nhân nhiễm
sán lá gan lớn, dùng sắc ký ái lực miễn dịch.
Chế tạo hệ thống miễn dịch men để phát hiện kháng ngun Fasciola sp.
Tìm hoạt tính protease trong dịch tiết của sán lá gan lớn với phương
pháp điện di SDS-PAGE, 12% và gelatine 0,1% trong thạch.
3
PHẦN 2: TỔNG QUAN TÀI LIỆU
2.1 Sơ lƣợc lịch sử nghiên cứu sán lá gan và bệnh do sán lá gan lớn gây nên [4]
Loài sán lá gan Fasciola gigantica đã được Cobbold phát hiện từ năm
1855.
Bệnh do sán lá gan F. gigantica gây ra gọi là bệnh sán lá gan, bệnh phổ
biến ở vùng Á Châu và Phi Châu.
Theo E. Brumpt, dê, cừu, trâu, bò và cả người cũng nhiễm F. gigantica.
Năm 1879, Brie là người đầu tiên đã công bố và mô tả về bệnh sán lá
gan ở cừu.
Năm 1881, Thomas và Leuckart là hai người đầu tiên đã phát hiện được
trong vịng đời (chu trình phát triển) của sán lá gan phải có ốc (ký chủ
trung gian) tham gia và hai năm sau vào năm 1883, Thomas đã thực
nghiệm và bổ sung thêm về chu trình: phát hiện trứng sán lá gan phát
triển phải có nước, nước là yêu cầu cấp bách nhất của ngoại cảnh. Việc
nghiên cứu chu trình phát triển của sán lá gan sau này vẫn do Thomas
chủ trì, cuối cùng đã nghiên cứu thành cơng vịng đời của F. hepatica.
2.2 Vịng đời của sán lá gan lớn
Trong điều kiện nhiệt độ thích hợp (từ 28-300C), có ốc ký chủ trung gian
Lymnaea swinhoei hoặc Lymnaea viridis và có vật chủ cuối cùng (dê, cừu, trâu, bị
nhiễm kén gây bệnh Adolescaria) thì vịng đời phát triển của sán lá gan nước ta được
xác định với các khoảng thời gian như sau:
Ở môi trường nước (ao, hồ, rãnh…): Trứng sán lá gan nở thành
miracidium sau 14-16 ngày.
Ở trong ốc ký chủ trung gian:
Miracidium phát triển thành sporocyst trong 7 ngày.
Sporocyst thành redia trong 8-21 ngày.
Redia thành cercaria non trong 7-14 ngày.
4
Cercaria non thành cercaria trưởng thành trong 13-14 ngày.
Ở trong nước (ao, hồ, rãnh…): Cercaria rụng đuôi thành adolescaria gây
bệnh sau 2 giờ.
Ở trong vật chủ cuối cùng: Thời gian sán phát triển thành sán trưởng
thành là 79-88 ngày.
.
Hình 2.1 – Chu kỳ phát triển của sán lá gan lớn (Fasciola sp)[13]
5
Như vậy điều kiện nóng ẩm của nước ta rất thuận lợi cho sự gây nhiễm bệnh
cũng như nhiễm bệnh trong tự nhiên. Gia súc nhai lại rất dễ cảm nhiễm kén gây bệnh.
Ở những vùng có mầm bệnh (trứng sán), có nhiệt độ thích hợp để trứng nở thành
miracidium, có ốc ký chủ trung gian, có dê, cừu, trâu, bị nuốt phải kén gây bệnh thì cứ
bình qn ba tháng lại tạo ra một đời sán mới. Con vật trong khi vẫn mang sán lại
nhiễm tiếp mầm bệnh mới, gây ra sự bội nhiễm làm cho mức độ bệnh trở nên nặng
hơn.
2.3 Hình thái sinh học của sán lá gan lớn (Fasciola sp)
Cũng như nhiều loài sán lá khác, sán lá gan có hệ sinh dục lưỡng tính (có cả bộ
phận sinh dục đực và cái trên một cá thể). Sán có hai giác bám, giác miệng ở phía đầu
sán, giác bụng tròn và ở gần giác miệng. Sán lá gan khơng có hệ tuần hồn và hơ hấp.
Hệ bài tiết gồm nhiều ống nhỏ, phân nhánh và thông với hai ống chính. Hai ống này
hợp lại ở cuối thân rồi thơng ra ngồi qua lỗ bài tiết. Thực quản tương đối ngắn, ống
tiêu hóa khá dài ra tận phần cuối thân sau, phân thành nhiều nhánh. Dịch hoàn nằm sau
buồng trứng và cũng phân nhánh.
PGS. TS. Phan Địch Lân (1994), đã phân biệt khái quát hai loài sán lá gan như
sau:
Một lồi có chiều dài thân gấp ba lần chiều rộng, vai sán khơng có hoặc
nhìn khơng rõ rệt, nhánh ruột chia tỏa ra nhiều nhánh ngang, loài này là
F. gigantica.
Lồi kia có thân hình như cái lá, thân rộng, phía đầu lồi hẳn ra phía trước
làm cho sán có “vai đặc biệt”, nhánh ruột chia ít và nhỏ, loài này là F.
hepatica.
6
Hình 2.2 – Hình thái sinh học của sán lá gan lớn (Fasciola sp)[15]
2.4 Tác hại của bệnh do sán lá lớn ở gan
2.4.1 Ở gia súc [4]
Đây là bệnh khá phổ biến đối với trâu bò ở đồng bằng sông Cửu Long và các
địa phương khác trong cả nước. Sán dinh dưỡng bằng cách ăn các hồng cầu, các tế bào
thượng bì của niêm mạc ống dẫn mật.
Bệnh sán lá gan trâu bò rất phổ biến ở những vùng trũng nước ngọt, vì có nhiều
điều kiện thuận lợi cho trứng phát triển và có sự hiện diện của ký chủ trung gian. Do
sán non di hành trong nhu mô gan làm thương tổn gan, vật bệnh sốt, kém ăn, mệt mỏi.
Triệu chứng lâm sàng thường gặp là gầy rạc, suy nhược cơ thể, ỉa phân nhão
không thành khuôn; về sau con vật lúc táo bón, lúc tiêu chảy, niêm mạc mắt nhợt nhạt;
lơng xù, mốc, dễ nhổ. Phân có mùi khắm, đen, hốc mắt sau, có con có nhèm; có thủy
thủng ở nách, ức, chướng hơi dạ cỏ, hơi thở hôi, vùng gan sưng lên. Khi sờ vào vùng
này con vật có cảm giác đau đớn và chết dễ dàng vì viêm gan nặng hoặc vì suy kiệt.
7
2.4.2 Ở ngƣời [3]
Bệnh tiến triển theo hai giai đoạn:
Giai đoạn gan (xâm nhập): Các triệu chứng xuất hiện khoảng 6-12 tuần
sau khi ăn phải các nang ấu trùng vào kéo dài 2 - 4 tháng. Trong giai
đoạn này, một số lượng lớn ấu trùng di chuyển qua thành ruột, qua
khoang phúc mạc, bao gan. Các triệu chứng hay gặp nhất là đau bụng,
sốt cơn, sút cân, nổi mề đay, ho, khó thở, đau ngực, rối loạn đại tiện,
chán ăn và buồn nơn. Có khi đau khắp bụng nhưng thường khu trú ở
vùng hạ sườn phải. Bạch cầu ái toan tăng rất cao (70% - 80%).
Giai đoạn mật (trưởng thành): Có thể kéo dài nhiều năm do Fasciola sp
có xu hướng di chuyển đến lòng ống mật chủ và phát triển thành sán
trưởng thành ở đó. Trên đường đi sán ăn mô gan ký chủ gây ra các triệu
chứng nặng. Gan to, vàng da, thiếu máu (một con sán trưởng thành hút
0,2 ml máu /ngày). Đơi khi sán non có thể lọt vào tĩnh mạch về đại tuần
hoàn và định vị ở những nơi xa như mô dưới da, phổi, mắt… (trường
hợp ký sinh trùng lạc chỗ). Sau ba tháng, sán đã định vị trong ống mật.
Người bệnh sẽ có những triệu chứng viêm gan mật mãn, tiếp tục bị mệt
mỏi, sụt cân, biếng ăn… Giai đoạn này, số bạch cầu ái toan lại giảm
nhiều. Trong phân cũng như dịch mật người bệnh bắt đầu có thể tìm thấy
những trứng sán. Nhưng thực tế số trứng rất ít và cũng ít khi xét nghiệm
này được chỉ định. Bệnh tiếp tục kéo dài trong nhiều năm, nếu để tồn lưu
lâu ngày sẽ bị các bệnh mãn tính của đường mật và có thể dẫn đến biến
chứng xơ gan, vỡ gan, suy gan, đau bụng dai dẳng, mất sức lao động và
cuối cùng có thể dẫn đến tử vong.
8
2.5 Chẩn đốn, phịng ngừa và điều trị bệnh sán lá lớn ở gan
2.5.1 Ở gia súc [4]
Chẩn đoán: Chú ý đến tính chất vùng có đủ điều kiện thích hợp cho sán
phát triển. Trâu bị ở thể mãn tính gầy ốm, suy nhược và tiêu chảy kéo
dài (viêm ruột mãn). Để tìm trứng sán trong phân ta có thể sử dụng
phương pháp gạn rửa sa lắng phân: lấy 4-8 viên phân, nếu phân nhão thì
lấy một lượng phân bằng quả táo ta, hòa trong nước sạch rồi lọc qua lưới
thép bỏ bớt cặn bã. Nước lọc được để lắng cặn và gạn rửa nhiều lần rồi
gạn nước trong ở trên bỏ đi, lấy cặn phân soi kính hiển vi tìm trứng sán
lá gan ở độ phóng đại 100 lần. Trứng sán lá gan hình bầu dục, một đầu
hơi nhỏ hơn, màu vàng nâu, trong có phơi bào xếp sát đến vỏ trứng.
Hình 2.5.1 – Trứng sán lá gan lớn (Fasciola sp)[17]
Theo Enigh, một con sán lá gan một năm có thể thải theo phân khoảng
6000 trứng và sán có thể sống trong cơ thể gia súc tới 11 năm. Trong
điều kiện nhiệt độ và ẩm độ thích hợp, chỉ một phần số trứng phát triển,
một miracidium phát triển thành chừng 180 – 200 cercaria trưởng thành.
Sự khô ráo và tác động trực tiếp của ánh nắng mặt trời làm trứng chết.
Trong phân ướt trứng sống được 8 tháng. Trứng sán ngừng phát triển ở
10-120C. Ở nhiệt độ dưới 500C trứng sống được 2 ngày. Trong cỏ phơi
chưa khô, adolescaria gây bệnh duy trì được sức sống 3-5 tháng.
Phịng bệnh:
+ Chống phát tán mầm bệnh: Ủ phân diệt trứng sán, làm tinh
sạch “tinh khiết” ốc ký chủ trung gian. Áp dụng biện pháp
9
chia lô chăn thả, qui hoạch bãi chăn gia súc không bị nhiễm
sán, kiểm tra gia súc để phân loại tẩy sán trước khi thả vào bãi.
+ Diệt mầm bệnh: Tẩy sán lá gan trong cơ thể gia súc theo lịch
dựa vào chu trình sinh học của sán. Những cơ sở giống 3
tháng tẩy 1 lần; các cơ sở ô nhiễm nặng tẩy 2 lần/năm; cơ sở ô
nhiễm nhẹ tẩy 1 lần/1 năm; cơ sở nhiễm dưới 20% tổng đàn
thì phát hiện con nào có sán tẩy con đó và cần tăng cường sức
khỏe của đàn gia súc bằng chế độ ăn uống và quản lý tốt sức
cày kéo của trâu bò, định kỳ kiểm tra sức khỏe.
Điều trị:
+ Dertyl – B cho uống liều 6 – 9 mg/ kg thể trọng.
+ Dovenix: Chích bắp 1 ml/ 25 kg thể trọng.
Khi điều trị nên kết hợp bồi dưỡng cho con vật và quản lý tốt về môi trường.
2.5.2 Ở ngƣời [2,3]
Ở người, việc chẩn đoán sán lá gan vẫn gặp rất nhiều khó khăn do có
nhiều triệu chứng lâm sàng và bệnh tích khơng rõ ràng. Hai trường hợp
đầu tiên nhiễm sán lá gan lớn trên người ở Việt Nam đã được Đỗ Dương
Thái và Trịnh Văn Thịnh báo cáo vào năm 1978. Ca tiếp theo được ghi
nhận vào năm 1991 và từ năm 1997 đến nay khi Trần Vinh Hiển và Trần
Thị Kim Dung sử dụng phương pháp huyết thanh miễn dịch men nhằm
chẩn đoán bệnh do sán lá lớn ở gan trên người thì các ca bệnh được phát
hiện ngày một nhiều hơn. Theo phương pháp này, đã phát hiện trên 500
ca ở người chỉ trong vịng có 3 năm. Đa số bệnh nhân đến từ các tỉnh ven
biển miền Trung như Đà Nẵng, Quảng Ngãi, Bình Định, Phú n,
Khánh Hịa. Tất cả bệnh nhân đều có hình ảnh tổn thương gan trên siêu
âm, tổn thương dễ nhầm với abces gan do amibe; abces gan do vi khuẩn,
ung thư gan. Bên cạnh đó xét nghiệm máu cho thấy bạch cầu toan tính
tăng cao từ 16 – 70% và tất cả có hiệu giá kháng thể là 1/1600 – 1/12800
với kháng nguyên là Fasciola gigantica.
10
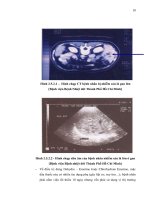
Hình 2.5.2.1 – Hình chụp CT bệnh nhân bị nhiễm sán lá gan lớn
[Bệnh viện Bệnh Nhiệt đới Thành Phố Hồ Chí Minh]
Hình 2.5.2.2 - Hình chụp siêu âm của bệnh nhân nhiễm sán lá lớn ở gan
[Bệnh viện Bệnh nhiệt đới Thành Phố Hồ Chí Minh]
Về điều trị dùng Dehydro – Emetine hoặc Chlorhydrate Emetine, mặc
dầu thuốc này có nhiều tác dụng phụ (gây liệt cơ, suy tim…); bệnh nhân
phải nằm viện tối thiểu 10 ngày nhưng vẫn phải sử dụng vì thị trường
11
trong nước chưa có thuốc nào thuận tiện hơn. Hiện nay, có xu hướng sử
dụng triclabendazole.
Theo dõi bệnh nhân sau điều trị thì thấy tỷ lệ bạch cầu toan tính trong
máu và hình ảnh siêu âm gan có xu hướng trở lại bình thường sớm hơn
hiệu giá huyết thanh miễn dịch. Đến tháng 9, tỷ lệ bạch cầu toan tính
trong máu của 70% bệnh nhân trở lại mức bình thường sớm hơn hiệu giá
huyết thanh miễn dịch. Sau một năm điều trị, hiệu giá kháng thể vẫn còn
cao (trên 91,96%) nên không thuận lợi để theo dõi hiệu quả của điều trị.
Do tập quán ăn rau sống, bối cảnh sinh thái môi trường, chăn nuôi gia
súc gần nơi trồng rau, số người mắc bệnh chắc chắn phải rất cao trên
thực tế, vì vậy dùng Emetine chưa phải là một giải pháp tốt cho việc điều
trị hàng loạt cần phải có sự phối hợp giữa nhiều ngành chức năng: thú y,
canh nông, môi trường, sinh thái, y học để giải quyết tốt vấn đề này ở
nước ta.
2.6 Dịch tiết từ sán lá gan lớn trong thời gian ký sinh có vai trò sinh học
2.6.1 Protein tiết và đáp ứng miễn dịch
Protein trong dịch tiết của sán lá gan lớn được tiết ra ở các giai đoạn phát
triển khác nhau của sán lá gan trong cơ thể của ký chủ. Loại protein này được xem như
một sự nhiễm bệnh đối với Fasciola sp. Do đó, nó có thể được dùng để chẩn đoán sớm
bệnh sán lá gan lớn ở người khi kháng thể đặc hiệu chống lại sán chưa được xuất hiện
(từ 1 – 3 tuần sau nhiễm). Bệnh thường có những triệu chứng lâm sàng không rõ ràng
và biến động nên đa số các bệnh nhân nhập viện đều cho kết quả kháng thể kháng
Fasciola sp cao. Lúc này, lượng protein tiết đánh giá qua xét nghiệm sẽ giảm dần và
có xu hướng mất hẳn. Do đó, việc phát hiện kháng nguyên tiết trong huyết thanh bệnh
nhân cũng gặp nhiều khó khăn. Sán ký sinh ở ống dẫn mật nên lượng protein tiết sẽ
lưu thông xuống ruột và được bài tiết theo phân. Vì thế, việc tìm protein tiết trong
phân có nhiều thuận lợi hơn.
Xét nghiệm huyết thanh học qua phương pháp miễn dịch men đã được Trần
Vinh Hiển và Trần Thị Kim Dung dùng để phát hiện kháng thể của người bệnh mang
12
lại hiệu quả cao. Nhưng do sử dụng kháng nguyên thân của F. gigantica nên có thể có
những phản ứng chéo không mong muốn và không thể đánh giá được hiệu quả điều trị
bệnh vì lượng kháng thể vẫn cịn tồn tại rất lâu trong cơ thể bệnh nhân sau khi đã khỏi
bệnh. Thành phần protein trong dịch tiết của sán lá gan lớn được đánh giá là có tính
đặc hiệu hơn so với kháng nguyên thân của F. gigantica (còn gọi là kháng nguyên tiết
– excretory/ secretory antigens) nên có thể sử dụng để cải tiến phương pháp huyết
thanh miễn dịch men để phát hiện kháng thể nhạy hơn và để tránh các phản ứng chéo.
Ngoài ra, kháng nguyên tiết còn được dùng để đánh giá hiệu quả điều trị vì các nghiên
cứu khoa học cho thấy sau khi được điều trị thì lượng kháng nguyên tiết sẽ được giảm
một cách từ từ trong cơ thể ký chủ. Do đó hiệu quả điều trị sẽ được đánh giá nhanh
chóng hơn [6, 5, 11,12].
2.6.2 Hoạt động protease
Thành phần chủ yếu của dịch tiết là cysteine-protease trong thời gian ký
sinh đóng vai trò chủ chốt trong việc xâm nhập bệnh vào cơ thể ký chủ. Các enzyme
này giúp phân giải thành phần protein của ký chủ để cung cấp dinh dưỡng cho sán phát
triển và để tạo điều kiện thuận lợi cho sự di chuyển của ký sinh trùng qua ruột non và
gan. Chúng phân cắt những protein của màng ruột như fibronectin, laminin và
collagen. Mặt khác, chúng còn bất hoạt hàng rào bảo vệ miễn dịch của tế bào chủ bằng
sự phân cắt các immunoglobulins. [8,10]
Do đó, việc xác định và tinh chế thành phần protease này có ý nghĩa quan
trọng trong việc phòng ngừa và điều trị bệnh sán lá gan lớn ở người và gia súc.
Các thử nghiệm tạo vaccine từ các loại protease trong vật liệu tiết của sán lá
gan lớn ở giai đoạn non và trưởng thành đã được thực hiện cho thấy có kết quả tốt tác
động lên sự dinh dưỡng và phát triển của ký sinh trùng cũng như hạn chế số lượng
trứng trong phân. Từ đó kiểm sốt được sự lan nhiễm của bệnh và hạn chế mức thiệt
hại về kinh tế [10].
13
PHẦN 3: NỘI DUNG VÀ PHƢƠNG PHÁP NGHIÊN CỨU
3.1 Thời gian và địa điểm
Thời gian thực hiện đề tài: từ tháng 3/2005 đến tháng 6/2005.
Địa điểm: phịng Hóa Miễn Dịch, Viện Pasteur Thành phố Hồ Chí Minh.
3.2 Vật liệu
3.2.1 Đối tƣợng nghiên cứu
Sán trưởng thành từ gan trâu, bò bị nhiễm sán lá gan được lấy từ công ty
Vissan.
Sử dụng sán chết được giữ trong môi trường PBS. Bảo quản ở -200C.
Ni sán cịn sống trong mơi trường được pha chế bên ngoài vật chủ để
thu lấy dịch tiết. Bảo quản ở -200C.
3.2.2 Thiết bị và dụng cụ
3.2.2.1 Thiết bị
Cân phân tích E14130, OHAUS, Switzerland.
Máy lọc nước Titertek (Microtitration).
Tủ hút khí (pha hóa chất) Kottermann.
Máy đo pH METTLER TODEDO MP220.
Máy sấy tiệt trùng.
Tủ cấy vô trùng.
Lọc vô trùng 0,22 μm.
Máy ly tâm lạnh MEGAFUGE 1.0 R, Heraeus Instruments.
Máy ly tâm nhỏ Micro centrifuge.
Máy khuấy từ CATM6/1.
Tủ lạnh Vestfrost REETECH, DOSAI, SANYO.
Máy vortex Minishaker MS1.
Máy lắc thường LAB-ROTATOR, LAB-LINE.
Máy đo quang phổ hấp thụ Spectrophotometer U 3310 Hitachi (Japan).
14
Bộ điện di protein SNEW.
Máy đọc ELISA Sanofi PR 2100, Diagnostics Pasteur.
Máy nghiền tế bào bằng sóng siêu âm Sonicator (Merck)
Máy chụp ảnh.
Máy vi tính.
3.2.2.2 Dụng cụ
Van kẹp; ống nghiệm thủy tinh; bơng gịn khơng thấm nước; các loại
ống nhựa 5 ml, 15ml, 50 ml; bộ kính điện di đứng; kim bơm butanol
100 μl, kim bơm mẫu 50 μl; eppendorf; đầu cone; bình tia đựng cồn,
nước cất; ống hút nhựa; ống đong; giấy lọc; cóng đo bằng nhựa;
pipetman và típ các loại.
3.2.3 Hóa chất và cách chuẩn bị các dung dịch
Nước cất 2 lần.
Dung dịch PBS 1X.
Môi trường RPMI 1640 1X để nuôi sán (hãng Gibco BRL Code 51800 –
035).
Kháng sinh Streptomycin.
Kháng sinh Penicillin.
Dung dịch màu (Bradford 4X) dùng để xác định nồng độ protein bằng
phương pháp Bradford:
+ Comassie blue G (Serva Blue G – N0 35050)
85 mg
+ Ethanol (EtOH)
50ml
+ H3PO4 85%
100ml
+ H2O cất hai lần
100ml
Dung dịch BSA (Bovine Serum Albumin)
Các dung dịch dùng trong điện di:
1. Dung dịch 40% T: Acrylamide (38,93g); N, N’-Methylene-bisacrylamide (1,07g). Hòa tan trong khoảng 80 ml + 1 ít MB1 và
xoay với máy khuấy từ trong 30 phút. Chỉnh đúng 100 ml. Lọc
qua Whatman số 1 cho vào chai nâu và bảo quản ở 40C.
15
2. Dung dịch 9,5% T: Acrylamide (6,3g); N, N’-Methylene-bisacrylamide (3,2g). Làm theo như với dung dịch 1.
3. Đệm phân giải (1,5M Tris): Tris base (18,15g). Trộn với khoảng
70 ml H2O. Dùng HCl hòa tan và chỉnh pH xuống 8,8. Chỉnh
đúng 100 ml và bảo quản ở 40C.
4. Đệm tập trung: Tris base (3g). Trộn với khoảng 35 ml H2O. Dùng
HCl, hòa tan và chỉnh pH xuống 6,8. Chỉnh đúng 50 ml và bảo
quản ở 40C.
5. Dung dịch SDS 10%: 10g/100 ml. Giữ ở nhiệt độ phịng.
6. Dung dịch đệm bình điện di: Tris base (12g); glycine (57,6g). Hòa
tan và chỉnh đúng 1000 ml. Bảo quản ở 40C. Khi dùng pha lỗng
¼ và cộng 1% dung dịch 5 (4 ml/400ml).
7. Dung dịch cố định: Sulfosalicylic acid (4g) + 100 ml Trichloroacetic acid 12,5%.
8. Dung dịch nhuộm: Coomassie R250 (2,5g); Methanol (600 ml);
Acid acetic (90ml). Trộn đều bột màu với hai dung mơi hữu cơ
này để hịa tan trước khi cho nước vào, 300 ml nước. (Có một số
bột màu có giá bột thủy tinh, không tan được phải lọc qua
Whatman số 1).
9. Dung dịch tẩy: Methanol (50ml); Acid acetic (75ml); nước cho
đến 1000 ml.
10. Dung dịch glycerol (d=1,25g/ml) 1g=0,8 ml (nếu không dùng 1g
glycerol dùng 0,8 ml H2O)
11. Dung dịch xanh-glycerol dùng để pha mẫu: glycerol (2 ml); SDS
10% (2,5 ml); đệm 4 (2 ml); màu bromphenol (80 μl); nước cất
vừa đủ 10 ml. Bảo quản ở 40C.
Dung dịch TEMED (2μl/4ml) khi còn mới. Khi lực xúc tác
bị yếu đi tăng lên cao hơn.
Dung dịch APS/KPS (A/K persulfate) (100 mg/ml) pha
trước khi dùng ở 40C. Chỉ dùng dung dịch mới pha (15 μl/ 4 ml) khi còn mới.
16
Khi lực xúc tác bị yếu đi, tăng lên cao hơn. Để hãm tốc độ polymer hóa, các
dung dịch monomer cần cho xuống 40C trước khi thực hiện gradient.
Dung dịch Triton 2,5%.
Dung dịch EDTA 1mM; glycine 0,1M; L-Cystein 10mM; pH = 8.
Các dung dịch dùng trong miễn dịch khuếch tán kép:
Dung dịch gel agarose 1% pha trong đệm PBS 1X để làm
phản ứng miễn dịch khuếch tán kép trên thạch.
Dung dịch nhuộm đỏ Ponceau S 0,2%.
Các dung dịch dùng trong sắc ký ái lực:
Gel CN-Br activated Sepharose 4B (Pharmacia, Thụy Điển).
Dung dịch NaN3 0,05% (dd1).
Dung dịch HCl 1mM, pH = 3.
Dung dịch đệm carbonate: NaHCO3 0,1M; NaCl 0,5M;
thimerosal 0,01%; pH = 8,7 (dd3).
Dung dịch Tris-HCl 0,1M; NaCl 0,5M; pH = 8 (dd4).
Dung dịch NaCl 0,5M; CH3COONa 0,1M; pH = 4 (dd5).
Dung dịch Tris-HCl 0,1M; NaN3 0,05%; NaCl 0,5M; pH = 7,4 (dd6).
Dung dịch glycine 0,1M, pH = 2,5.
Các dung dịch dùng trong kỹ thuật ELISA:
Đệm carbonate Na2CO3; pH = 9,6: NaHCO3 0,075M (pH =
8; 1,26g/ 200 ml); Na2CO3 0,075 M (pH = 10,9; 159 g/200
ml); NaN3 0,003% (0,04 g/200 ml).
Dung dịch rửa: PBS thimerosal 0,01%; Tween 0,05%.
Dung dịch bão hòa pH = 8 (HCl): Tris 0,1M; NaCl 0,15 M;
EDTA 1mM, NaN3 0,05%; Tween 20 0,05%; Gelatin 0,5%.
NHS-LC-Biotin (21336, Pierce).
OPD – cơ chất cho peroxydase (Sigma, USA).
Streptavidin - peroxydase (Sigma, USA).
Chất hiện màu.
17
Dung dịch ngừng phản ứng H2SO4 1,5 N.
3.3 Phƣơng pháp
3.3.1 Quy trình lấy mẫu [6]
Sán trưởng thành từ gan trâu hoặc bò bị nhiễm sán lá gan được rửa 4 lần với
PBS 1X cho sạch máu và mật, sau đó cho vào ống chứa PBS và bảo quản ở -200C.
Đối với sán sống cho vào môi trường nuôi RPMI 1640 (1 con/5 ml/1 ống
nghiệm), ủ ở 370C/24h. Sau đó ly tâm (3000 vòng/phút/40C/30phút) thu lấy dịch nổi,
bảo quản ở -200C.
3.3.2 Định lƣợng protein bằng phƣơng pháp đo mật độ quang OD280 [9]
Phương pháp này sử dụng một máy đo quang phổ 250 – 700 nm (UV – VIS).
Cấu tạo gồm nguồn sáng, một khe hở cho ánh sáng đi vào, các lăng kính và cách tử để
tạo thành các ánh sáng đơn sắc, ngăn chứa mẫu và đầu dò để đo lượng ánh sáng sau
khi qua mẫu. Photon ánh sáng ở vùng tử ngoại do đèn nguồn phát qua hệ thống các
lăng kính và cách tử sẽ chỉ tạo ánh sáng đơn sắc với bước sóng nhất định. Khi đi qua
dung dịch trong cốc sẽ gây ra sự thay đổi năng lượng của các điện tử. Khi phân tử hấp
thụ năng lượng ánh sáng này, các điện tử sẽ chuyển lên mức năng lượng cao hơn.
Phân tử protein hấp thụ ánh sáng cực đại ở bước sóng 280 nm, sự hấp thụ này
có được chủ yếu là do các amino acid có nhân thơm như phenylalanine, tyrosine,
tryptophan. Tuy nhiên, mỗi protein có thành phần và số lượng các amino acid trên
khác nhau nên mỗi protein sẽ có một hệ số tắt (extinction) tương ứng. Hệ số tắt này là tỉ
số giữa độ hấp thụ quang ở bước sóng 280 nm (OD280) trên nồng độ (mg/ml) của protein.
Ví dụ, protein BSA có hệ số tắt là 0,66; như vậy nếu BSA giá trị OD280 = 0,66 thì nồng độ
của BSA là 1 mg/ml.
18
Hình 3.3.2 – Biểu đồ quang học máy đo quang phổ 250 – 700 nm (UV – Vis)[9]
3.3.3 Xác định nồng độ protein bằng phƣơng pháp Bradford [7,18]
Bradford là một phương pháp định lượng protein rất phổ biến bởi vì nó đơn
giản, nhanh, khơng đắt và nhạy. Phương pháp này sử dụng thuốc nhuộm
Coommassie Briliant Blue G-250 (CBBG). Thuốc nhuộm này liên kết chuyên biệt
với protein ở vị trí các nhóm amino acid arginine, tryptophan, tyrosine, histidine và
phenylalanine trong đó chủ yếu là liên kết với arginine (nhiều hơn 8 lần so với
nhóm khác). CBBG liên kết với các nhóm này dưới dạng amin, mà ở dạng này nó
hấp thụ ánh sáng tối đa ở bước sóng 595 nm (màu xanh); Thuốc nhuộm ở dạng tự
do là cation, mà ở dạng này nó hấp phụ ánh sáng tối đa ở bước sóng 470 nm (màu
đỏ). Phương pháp này được đo ở bước sóng 595 nm bởi một máy quang phổ kế, và
vì vậy đo phức hợp CBBG với protein.
19
Hình 3.3.3 – Cấu trúc hóa học của Coommassie Brilliant Blue G-250
Sự lựa chọn protein chuẩn cho phương pháp này cũng ảnh hưởng nhiều đến kết
quả. Đối với mỗi protein được định lượng nên có một protein chuẩn thích hợp.
BSA là một protein chuẩn thường được lựa chọn và kết quả là tương đối với BSA.
Cách thực hành:
Xác định đường chuẩn theo nồng độ protein chuẩn (BSA).
Dung dịch BSA có nồng độ 200 µg/ ml.
Thực hiện đường chuẩn độ protein tương đối với BSA.
Chuẩn bị mẫu protein tinh chế.
Pha lỗng mẫu sao cho sự quan sát có đựơc nằm trong giới hạn cho phép
của đường chuẩn.
Thứ tự các chất cho vào giếng: nước cất, BSA chuẩn (hoặc mẫu protein),
dung dịch Bradford 4X.
Trộn đều các chất trong giếng (tránh tạo bọt), để phản ứng trong 5 phút.
Đo bằng máy đọc ELISA ở bước sóng 595 nm.
Xử lý số liệu bằng phần mềm KC4 và Microsoft Excel 2003.
20
Bảng 3.3.3 – Tổ chức thực hiện đƣờng chuẩn protein theo nồng độ BSA.
Nƣớc cất hai Dung dịch Bradford
Lƣợng
V ( BSA)
Giếng
BSA(µg)
(200µg/ml)(µl)
lần (µl)
4X (µl)
A1
0
0
180
60
A2
0
0
180
60
B1
1
5
175
-
B2
1
5
175
-
C1
2
10
170
-
C2
2
10
170
-
D1
4
20
160
-
D2
4
20
160
-
E1
6
30
150
-
E2
6
30
150
-
F1
8
40
140
-
F2
8
40
140
-
21
3.3.4 Điện di SDS-PAGE 12% xác định thành phần protein trong dịch
tiết của sán lá gan lớn [9,16]
Phương pháp điện di protein SDS-PAGE (Sodium Dodecyl Sulfate
Polyacrylamide Gel Electrophoresis) được Laemmli (1970) phát triển từ sự hiệu chỉnh
bằng cách thêm 0,1% SDS (chất tẩy mang điện tích âm) vào hệ PAGE của OrnsteinDavis (1964) nhằm xác định trọng lượng phân tử các loại protein trong phổ điện di;
xác định thành phần và độ sạch của chế phẩm protein trong quá trình được tinh chế
(Davis E.Garfin 1995) [16]. Trong kỹ thuật này, protein được xử lý với chất tẩy SDS
và tác nhân khử cầu nối disulfide là mercaptoethanol hoặc dithiolthretol (DTT). Với
các tác nhân này, protein từ cấu trúc bậc 2, 3, 4 được biến đổi thành chuỗi polypeptide
(bậc 1) và tất cả protein đều được tích điện âm. Tỷ lệ lượng SDS bám được vào
protein là không thay đổi:
SDS/ protein (g/g) =1,4
Tổ chức của phức hợp protein-SDS cấu tạo thành một hình bầu dục dài
(ellipsoid) với các cực âm của các nhóm sulfate ở phía ngồi. Protein càng lớn, bầu
dục càng dài. Do đó, có sự liên quan giữa trọng lượng phân tử của protein với tốc độ di
chuyển của các protein trong mơi trường có SDS cho đường biễu diễn tuyến tính
log.(M.W.) = ax + b (chiều dài đường di). Công thức này cho thấy trọng lượng phân tử
(M.W) càng lớn, đường đi càng ngắn, tức a < 0 và cắt các cầu nối S-S là cần thiết để
đảm bảo quy luật trên.
Tốc độ di chuyển của một protein trong phương pháp điện di dựa trên sự
khác nhau về điện tích, kích thước lỗ gel, trọng lượng phân tử, cường độ điện trường,
thời gian điện di, nhiệt độ…
Các thành phần được sử dụng để xây dựng nên giá thể đa phân
(polymer) là acrylamide, N,N’-methylene-bis (acrylamide), tetramethylenediamine
(TEMED) và ammonium persulfate.
22
Hình 3.3.4.1 – Các thành phần đƣợc sử dụng để tạo gel polyacrylamide
Khi ammonium persulfate bị phân ly trong nước, nó hình thành nên các
gốc tự do:
S2O82- → 2SO42Nếu các gốc tự do này được tiếp xúc với acrylamide, gốc tự do trong
phân tử acrylamide được hình thành. Sau đó acrylamide được hoạt hóa này sẽ phản
ứng với các phân tử acrylamide khác để tạo ra một chuỗi đa phân dài.
Hình 3.3.4.2 – Phản ứng chuỗi đa phân hóa acrylamide
23
Sự hình thành gel địi hỏi các chuỗi đa phân này liên kết chéo với nhau.
Hợp chất N,N’-methylene-bis (acrylamide) sẽ giúp tạo phản ứng đa phân hóa các
chuỗi acrylamide.
Hình 3.3.4.3 – Phản ứng tạo liên kết chéo nối hai sợi đa phân acrylamide
Kích thước lỗ gel được xác định bởi hai thông số: (1) nồng độ
acrylmide( C%) ; (2) mức độ liên kết chéo (T%).
C%= Nồng độ Bis, (g) / Nồng độ acrylamide, (g)
T%= Nồng độ acrylamide (g)– Bis, (g) / Thể tích, (ml)
Thơng thường C% ít được quan tâm, người ta quan tâm đến thông số T%
nhiều hơn. Sự thay đổi T% làm cho khoảng trống của gel thay đổi, T% càng tăng lưới
sàng lọc phân tử càng dày đặc, các phân tử lớn khó hoặc khơng chuyển qua được. Sự
có mặt của SDS sẽ làm cho các phân tử protein khi đi qua gel được bọc bởi một lớp
điện tích âm. Khi điện di các phân tử protein được di chuyển từ cực âm sang cực
dương và đồng thời cũng là di chuyển từ lớp gel có khoảng trống của lưới phân tử to
đến lớp có khoảng trống của lưới phân tử nhỏ. Những phân tử có kích thước lớn sẽ di
24
chuyển chậm hơn phân tử có kích thước nhỏ khi đi qua một lỗ gel có kích thước nhất
định. Với sự di chuyển này, các phân tử protein sẽ được phân tách trên băng điện di
hoàn toàn theo trọng lượng phân tử. Trong thực tế để xác định trọng lượng phân tử của
một protein, người ta thường so sánh với một thang phân tử lượng chuẩn, là một hỗn
hợp các protein có trọng lượng phân tử khác nhau đã được biết.
Với mục đích đưa các protein trong mẫu về cùng một vạch xuất phát
đồng thời tạo ra sự phân tách tốt hơn, người ta thường sử dụng phương pháp điện di
gel không liên tục. Ở phương pháp này, gel thường có hai lớp: lớp trên (gel tập trung),
lớp dưới (gel phân tách). Hai lớp gel này khác nhau bởi dung dịch đệm, nồng độ
acrylamide.
Cách tiến hành:
Chuẩn bị tấm kính để đổ gel
Chuẩn bị một gel polyacrylamide có nồng độ acrylamide là 12 % theo
bảng sau:
Bảng 3.3.4 – Cách chuẩn bị một gel polyacrylamide 12%T
Separating gel
Stacking gel
2,64 ml H2O
2 ml dung dịch 2
1,5 ml dung dịch 3
1 ml dung dịch 4
60µl dung dịch 5
40 µl dung dịch 5
1,8 dung dịch 1
0,96 ml H2O
TEMED 100 µl
50 µl TEMED
APS 130 µl
100 µl APS
Bề mặt gel phân giải:
+ Isobutanol hoặc 0,5 ml dung dịch 3
+ 20 µl dung dịch 5
+ 1,48 ml H2O
25
Sau khi đổ gel phân tách (separating gel) trước, ta cho bultanol vào để
nén bằng mặt gel. Lưu ý không để tạo bọt khí. Sau khi gel đơng, ta rửa lớp butanol
bằng nước cất. Sau đó tiếp tục đổ gel tụ chùm (stacking gel). Các giếng được đặt ở lớp
gel tụ chùm nhờ lược. Sau khi gel trùng ngưng xong, tiến hành lấy lược ra và lắp gel
vào bình điện di.
Chuẩn bị mẫu thử: Mẫu thử sau khi xác định được nồng độ sẽ được trộn
với dung dịch pha mẫu theo tỷ lệ 1:1 và xử lý mẫu bằng cách đun cách
thủy trong vòng năm phút.
Chuẩn bị máy điện di: pha dung dịch đệm bình điện di.
Mẫu được nạp vào giếng, tiến hành chạy điện di (80V; 40 mA; 2giờ 45
phút).
Sau khi điện di, nhuộm Coomassive trong 10 phút. Sau đó tiến hành tẩy
bằng cách ngâm gel trong dung dịch tẩy cho đến khi nền gel trở nên
trong suốt. Thay mới dung dịch thuốc tẩy khi dung dịch này có màu
tương đương với màu trong nền gel.
Xem kết quả.
Trường hợp điện di để xác định hoạt tính protease trong dịch tiết của sán lá gan
ta tiến hành tương tự chỉ khác là thêm cơ chất gelatine 0,1% vào gel phân tách và
khơng có xử lý mẫu để tránh làm biến tính protease trong mẫu. Sau khi điện di ngâm
trong Triton 2,5% hai lần mỗi lần 30 phút.
Ngâm trong dung dịch hoạt hóa EDTA 1mM, glycine 0,1 M, L-cystein
10mM pH = 8 trong 30 phút.
Thay nước ngâm tiếp bằng dung dịch trên để qua đêm.
Sau đó tiến hành nhuộm và tẩy tương tự như điện di thường.