Một số dạng bài tập vô cơ có lời giải chi tiết lớp 11, 12
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (200.87 KB, 28 trang )
MỘT SỐ DẠNG BÀI TẬP VÔ CƠ KHÁC
1. BÀI TẬP NHIỆT PHÂN MUỐI
Câu 1: Nung m gam một loại quặng canxit chứa a% về khối lượng tạp chất trơ, sau
một thời gian thu được 0,78m gam chất rắn, hiệu suất của phản ứng nhiệt phân là
80%. Giá trị của a là
A. 37,5.
B. 67,5.
C. 32,5.
D. 62,5.
Hướng dẫn
0
t
Chú ý: Quặng canxit là CaCO3. CaCO3 ��� CaO CO2 �
nhie�
t pha�
n
m � 0,22m m�
� mCaCO
CO
2
3
0,22m.100
44
0,22m.100
0,5
44
� 0,8
� 0,8
� a 37,5%
m.a
100 a
m
100
100
Câu 2: Nhiệt phân 50,5 gam KNO3 với hiệu suất 60%, lượng oxi thu được tác
dụng vừa đủ với m gam photpho. Giá trị lớn nhất của m là:
A. 10,33.
B. 12,4.
C. 3,72.
D. 6,20.
Hướng dẫn
0
t
nKNO3 0,5mol; KNO3 ��
� KNO2 0,5O2 � nO2 0,25.0,6 0,15mol
m lớn nhất khi oxit là
BTNT.oxi
P2O3 ����
� nP 0,2mol � mP 6,2g
Câu 3: A là hỗn hợp các muối Cu(NO3)2, Fe(NO3)3, Mg(NO3)2 trong đó O chiếm
55,68% về khối lượng. Cho dung dịch KOH dư vào dung dịch chứa 50 gam muối
A, lọc kết tủa thu được đem nung đến khối lượng không đổi thu được m gam oxit.
Giá trị của m là:
A. 12,88 gam. B. 18,68 gam. C. 31,44 gam. D. 23,32 gam.
Hướng dẫn
1
�
�nO 1,74 � mA 42,67g
mO 27,84 � �
� mKL 50 0,58.62 14,04g
�nNO3 0,58mol
0,58
NO3 �0,5O
����
� moxit 14,04
.16 18,68g
2
Câu 4: Hỗn hợp X gồm KCl và KClO 3.Người ta cho thêm 10 gam MnO2 vào 39,4
gam hỗn hợp X thu được hỗn hợp Y. Nung y ở nhiệt độ cao được chất rắn Z và khí
P. Cho Z vào dung dịch AgNO3 lấy dư thu được 67,4 gam chất rắn. Lấy 1/3 khí P
sục vao dung dịch chứa 0,5mol FeSO4 và 0,3mol H2SO4 thu được dd Q. Cho dd
Ba(OH)2 láy dư vào dung dịch Q thu được X gam kết tủa. Biết các phản ứng hoàn
toàn, Giá trị của X là:
A. 185,3
B. 197,5
C. 212,4
D. 238,2
Hướng dẫn
� �
�nKCl amol
39,4�
� 74,5a 122,5b 39,4
�
� �nKClO3 bmol
a 0,2mol
�
��
� nO2 1,5b 0,3mol
�
b 0,2mol
�
� �
�nAgCl 0,4mol
67,4�
� a b 0,4
�
n
10mol
� � MnO2
�nBaSO 0,8mol
�nSO24 0,8mol
� 4
�
�
�
BTNT
����
� Q �nFe3 0,4mol ���
� X 238,2�nFe(OH)3 0,4mol
�
�
�nFe2 0,1mol
�nFe(OH)2 0,1mol
1
P0,1O2
3
Chú ý : Ta suy ra các chất trong Q bằng BTE vì
nO2 0,1� ne 0,4 nFe3
Câu 5: Nung 66,20 gam Pb(NO3)2 trong bình kín, sau một thời gian thu được
64,58 gam chất rắn và hỗn hợp khí X. Hấp thụ hoàn toàn X vào nước, được 3 lít
dung dịch Y. Dung dịch Y có giá trị pH là:
A. 2.
B. 3.
C. 4.
D. 1
Hướng dẫn
2
�
�nNO amol BTE �4b a
m 1,62� 2
���
��
46a 32b 1,62
�
�nO2 bmol
a 0,03mol
�
BTNT.nito
��
����
� nHNO3 0,03mol; �
H �
�
� 0,01� A
�b 0,0075mol
Câu 6: Nhiệt phân hoàn toàn một muối amoni của axit cacbonic sau đó dẫn toàn
bộ sản phẩm vào 50 gam dung dịch H 2SO4 19,6 % thì đủ tạo một muối trung hòa
có nồng độ 23,913%. Công thức và khối lượng của muối ban đầu lần lượt là:
A. (NH4)2CO3; 9,6 gam.
B. NH4HCO3; 9,6 gam.
C. NH4HCO3; 11,5 gam.
D. (NH4)2CO3; 11,5 gam.
Hướng dẫn
nH2SO4 0,1mol � n NH4
SO4
2
0,1mol � nNH3 0,2mol
ta đi thử đáp án ngay
A. (NH4)2CO3; 9,6 gam. 0,1.(18.2 60) 9,6
B. NH4HCO3; 9,6 gam. 0,2.79 15,8
C. NH4HCO3; 11,5 gam. 0,2.79 15,8
D. (NH4)2CO3; 11,5 gam. 0,1.(18.2 60) 9,6
Câu 7: Nung nóng hỗn hợp gồm 15,8 gam KMnO4 và 24,5 gam KClO3 một thời
gian thu được 36,3 gam hỗn hợp Y gồm 6 chất. Cho Y tác dụng với dung dịch HCl
đặc dư đun nóng lượng khí clo sinh ra cho hấp thụ vào 300 ml dung dịch NaOH
5M đun nóng thu được dung dịch Z. Cô cạn Z được chất rắn khan các phản ứng
xảy ra hoàn toàn. Khối lượng chất rắn khan thu được là:
A. 12g
B. 91,8g
C. 111g
D. 79,8g
Hướng dẫn
�
15,8 24,5 36,3
�nKMnO4 0,1mol BTKL
���
� nO
0,25mol
�
16
�nKClO3 0,2mol
BTE
��
�
� 0,1.5 0,2.6 0,25.2 2nCl2 � nCl2 0,6mol
3
�nNaCl 1mol
BTNT.Clo
�
�����
� a b 1,2
�
�nNaCl amol
�
��
� � BTE
� m 91,8�nNaClO3 0,2mol
� a 5b
�
�nNaClO3 bmol ����
�nNaOH 0,3mol
Câu 8: Nung 44 gam hỗn hợp X gồm Cu và Cu(NO 3)2 trong bình kín cho đến khi
các phản ứng xảy ra hoàn toàn thu được chất rắn Y. Chất rắn Y phản ứng vừa đủ
với 600 ml dung dịch H2SO4 0,5 M và thấy Y tan hết. Khối lượng Cu và Cu(NO 3)2
có trong hỗn hợp X là:
A. 12,4 g Cu; 31,6 g Cu(NO3)2 B. 8,8 g Cu; 35,2 g Cu(NO3)2
C. 6,4 g Cu; 37,6 g Cu(NO3)2 D. 9,6 g Cu; 34,4 g Cu(NO3)2.
Hướng dẫn
BTNT
nH2SO4 0,3mol � nH2O 0,3mol ���
� nO nCuO 0,3mol
BTNT.Cu
�
�����
� a b 0,3
a 0,1mol
�
�nCu amol
�
44�
� � BTKL
��
�C
b 0,2mol
� 64a 188b 44 �
�nCu(NO3)2 bmol ����
Câu 9: Cho 0,5 mol Mg và 0,2 mol Mg(NO 3)2 vào bình kín không có oxi rồi nung
ở nhiệt độ cao đến phản ứng hoàn toàn thu được hỗn hợp chất rắn X. Hỗn hợp chất
rắn X tác dụng với nhiều nhất 500 ml dung dịch Fe(NO 3)3 có nồng độ aM. Giá trị
của a là:
A. 0,667.
B. 0,4.
C. 2.
D. 1,2.
Hướng dẫn
�nMg 0,5mol
�nMgO 0,4mol
�
�
BTNT
BTNT:oxi
���
� nNO2 0,4mol ����
��
�
�nMg 0,3mol
�nMg(NO3)2 0,2mol
�
Fe3 1e � Fe2
�
� nFe3 0,6mol
�
2
�Mg 2e � Mg
Câu 10. A là hỗn hợp các muối Cu NO3 2 ,Fe NO3 2 ,Fe NO3 3 ,Mg NO3 2 . Trong đó
O chiếm 28,8% về khối lượng. Cho dd KOH dư vào dd chứa 50 gam muối A. Lọc
kết tủa thu được đem nung trong chân không đến khối lượng không đổi thu được m
gam oxit. Giá trị của m là:
4
A. 33,8
B. 47,3
C. 17,6
D. 39,3
Hướng dẫn
Câu này đề bài là vô lý vì trong tất cả các muối % m o đều lớn hơn 28,8% thậm
chí là >50%
Ý tưởng của bài toán như sau :
A
mOtrong A 50.28,8% 14,4 � nOtrong A 0,9mol � ntrong
0,3mol
NO
3
Áp dụng bảo toàn điện tích dễ thấy trong oxit thì số mol O = 0,5 số mol
Có ngay:
NO3
mOxit mmuoi mNO mO 50 0,3.62 0,15.16 33,8g
3
Câu 11. Nhiệt phân hoàn toàn 1,88 gam Cu(NO3)2 rồi hấp thụ toàn bộ lượng khí
sinh ra bằng nước thu được 2 lít dung dịch X. Tiếp tục thêm 0,04 gam NaOH vào
100 ml dung dịch X được dung dịch Y. pH của dung dịch X,Y lần lượt là
A. 2 ; 7,0.
B. 3 ; 11,0.
C. 2,2 ; 12,0. D. 7; 12,7.
Hướng dẫn
nCu(NO3)2
BTNT.nito
�����
� nNO2 0,02mol
�
0,01� �
� nHNO3 0,02mol � PH 2
0,02
BTE
� nO2
0,005
����
4
�
�
�nNaOH 0,001mol
� PH 7
�
�nHNO3 0,02/ 20 0,001mol
Câu 13: Nhiệt phân hoàn toàn 0,2 mol muối M(NO3)2 thì thu được 16,0 gam oxit
và 10,08 lít (đktc) hỗn hợp khí gồm NO2 và O2. X là hỗn hợp RBr và MBr2. Lấy
31,9 gam hỗn hợp X có số mol bằng nhau tác dụng với dung dịch AgNO 3 dư thu
được 67,2 gam kết tủa. Tổng số proton của M2+ và R+ là :
A. 36.
B. 38.
C. 35.
D. 37.
Hướng dẫn
5
�
�BTNT � nNO2 0,4mol
0,2M NO3 2 � �
�nO2 0,45 0,4 0,05mol
BTNT.oxi
trong.oxit
����
� noxi
0,2.2.3 0,4.2 0,05.2 0,3mol
�nAgBr 3a
�
� Fe
�nRBr amol
�
� Fe2O3 � 31,9�
� 67,2�
� a 0,1mol � �26
�nFeBr2 amol
�nAg a
�11Na
Câu 14: Hỗn hợp X gồm 3 muối NH 4HCO3, NaHCO3, Ca(HCO3)2. Nung 48,8 gam
hỗn hợp X đến khối lượng không đổi, thu được 16,2 gam chất rắn Y. Cho Y vào
dung dịch HCl lấy dư, thu được 2,24 lít khí (đktc). Phần trăm khối lượng của
NH4HCO3 trong hỗn hợp X là:
A. 34,43 %.
B. 32,38 %.
C. 35,6 %.
D. 33,2 %.
Hướng dẫn
�n
NH4HCO3 amol
�
�nNa CO 0,5b
�
�
t0
48,8�nNaHCO3 bmol ��
�16,2� 2 3
HCl � nCO2 0,5b
�
�nCaO c
n
cmol
�
� Ca HCO3 2
79a 84b 162c 48,8 �
a 0,2mol
�
�
�
��
53b 56c 16,2
� �b 0,2mol � %NH 4HCO3 � B
�0,5b 0,1
�c 0,1mol
�
�
Câu 15: Nhiệt phân hoàn toàn 36,8 gam quặng đôlômit (có chứa 25% khối lượng
tạp chất trơ) khí thoát ra được hấp thụ hoàn toàn bằng 210 ml dung dịch Ba(OH) 2
1M. Sau khi kết thúc phản ứng thu được m gam kết tủa. Giá trị của m là:
A. 41,37.
B. 19,7.
C. 23,64.
D. 29,55.
Hướng dẫn
ndolomit nMgCO3.CaCO3
36,8.0,75
BTNT
0,15 ���
� nCO2 0,3mol
84 100
�
�nCO 0,3mol
�� 2
� n� 0,21.2 0,3 0,12 � m 23,64g
�nBa(OH)2 0,21mol
6
Câu 16: Nung m gam hỗn hợp X gồm FeCO3, Fe(NO3)2 trong bình chân không
đến khi phản ứng xảy ra hoàn toàn thì thu được chất rắn là Fe 2O3 và 10,08 lít (ở
đktc) hỗn hợp chỉ gồm hai khí. Nếu cho ½ hỗn hợp X trên tác dụng với dung dịch
H2SO4 loãng dư thì thu được tối đa bao nhiêu lít khí (ở đktc, sản phẩm khử duy
nhất là NO) ?
A. 2,80 lít.
B. 2,24 lít.
C. 5,60 lít.
D. 1,68 lít.
Hướng dẫn
a b
�
�nFe2O3 2
�
�
�nFeCO amol
BTNT
X� 3
���
� �nCO2 a
�
�nFe(NO3)2 bmol
�nNO2 2b
�
a 2b 0,45
�
a 0,15mol
�
� � BTE
��
� a b 2b �b 0,15mol
����
�nFe2 0,15mol � nNO 0,05mol
�nFeCO 0,075mol
X �
�
BTE
:� 3
���
� � BTNT
� V 2,8lit
2 �nFe(NO3)2 0,075mol
� nCO2 0,075mol
����
Câu 17: Nhiệt phân hoàn toàn 83,5 gam một hỗn hợp hai muối nitrat: A(NO 3)2 và
B(NO3)2 (A là kim loại họ s và tác dụng được với nước ở điều kiện thường, B là
kim loại họ d) tới khi tạo thành những oxit, thể tích hỗn hợp khí thu được gồm NO 2
và O2 là 26,88 lít (0oC và 1atm). Sau khi cho hỗn hợp khí này qua dung dịch NaOH
dư thì thể tích của hỗn hợp khí giảm 6 lần. Thành phần % theo khối lượng của
A(NO3)2 và B(NO3)2 trong hỗn hợp lần lượt là:
A. 78,56% và 21,44%.
B. 40% và 60%.
C. 33,33% và 66,67%.
D. 50% và 50%.
Hướng dẫn
1
�
A NO3 2 � AO 2NO 2 O 2 �n
�
�
2 ; � NO2 1mol
�
�
1
n 0.02 mol
�
B NO3 2 � BO 2NO 2 O 2 � O2
�
2
m
31,1
Ca
�
�
� � AOBO
� AB 46 � �
n AOBO 0, 05
Mn
�
�
7
Câu 18: Nung m gam hỗn hợp X gồm KClO 3 và KMnO4 thu được chất rắn Y
(KCl, K2MnO4, MnO2, KMnO4) và O2. Trong Y có 1,49 gam KCl chiếm 19,893%
theo khối lượng. Trộn lượng O2 ở trên với không khí theo tỉ lệ thể tích VO : VKK 1: 4
thu được hỗn hợp khí Z. Đốt cháy hết 0,528 gam cacbon bằng hỗn hợp Z thu được
hỗn hợp khí T gồm 3 khí O2, N2, CO2, trong đó CO2 chiếm 22% về thể tích. Biết
trong không khí có 80% N2 và 20% O2 theo thể tích. Giá trị của m là:
A. 8,53.
B. 8,77.
C. 8,91.
D. 8,70.
2
Hướng dẫn
�X Y O2
�
�
�KCl 1, 49 � m y 7, 49
�
nC nCO2 0, 44 mol � nT 0, 2 mol
�
� nO2 0,04 mol � m 7, 49 0,04.32 8,77 g
Chú ý :
C O2 � CO2
Nên số mol khí không thay đổi
Câu 19: Sau khi đun nóng 23,7 gam KMnO4 thu được 22,74 gam hỗn hợp chất
rắn. Cho hỗn hợp chất rắn trên tác dụng hoàn toàn với dung dịch axit HCl 36,5% (d
= 1,18 g/ml) đun nóng. Thể tích khí Cl2 (đktc) thu được là :
A. 2,24.
B. 4,48
C. 7,056. D. 3,36.
Hướng dẫn
Sơ đồ phản ứng :
O2 �
KMnO4
�
K 2MnO4
�
�MnCl 2
HCl
���
Cl 2 �
�MnO2
�
(2)
KCl
�
�
KMnO4
�
Như vậy, sau toàn bộ quá trình phản ứng : Chất oxi hóa là Mn +7 trong KMnO4,
2
1
số oxi hóa của Mn thay đổi từ +7 về +2. Chất khử là O trong KMnO4 và Cl
trong HCl, số oxi hóa của O thay đổi từ -2 về 0, số oxi hóa của Cl thay đổi từ -1 về
8
0.
Áp dụng bảo toàn khối lượng, ta có :
0,96
mO 23,7
22,74
0,96 gam � nO
0,03 mol.
{
{
2
2
32
m
m
KMnO4
chaá
t raé
n
Áp dụng bảo toàn electron, ta có :
5nKMnO 4nO 2nCl � nCl 0,315 mol
2
{2
{2
1 2 34
0,03
0,15
� VCl
2
(�
ktc)
?
0,315.22,4 7,056 l�
t
Câu 20: Nhiệt phân hoàn toàn hỗn hợp T gồm Fe(NO 3)2 và Al(NO3)3 thu được hỗn
hợp khí X. Trộn hỗn hợp khí X với 112 ml khí O 2 (đktc) thu được hỗn hợp khí Y.
Hấp thụ hoàn toàn hỗn hợp khí Y vào 3,5 lít H 2O (không thấy có khí thoát ra) thu
được dung dịch có pH = 1,7. Phần trăm khối lượng của Fe(NO 3)2 trong hỗn hợp T
là:
A. 62,83%.
B. 50,26%.
C. 56,54%.
D. 75,39%.
Hướng dẫn
�X 0,005O � Y
2
�
1
�
2NO2 O2 H2O � 2HNO3
�
2
�
��
H � 0,02 � nH 0,07mol
�� �
�X
n
a mol �nFe O 0,5a
�
� Fe NO3 2
�
��
�� 2 3
0,0125mol �nAl NO3 bmol
�nAl2O3 0,5b
3
�
nNO2 0,07mol
nO2
2a 3b 0,07 nN
�
�
��
� nO 6a 9b 1,5a 1,5b 0,07.2 0,0125.2
�
a 0,02mol
�
��
� %Fe NO3 2 62,83%
�b 0,01mol
Câu 21 : Tiến hành phản ứng nhiệt nhôm với Fe2O3 trong điều kiên không có
không khí. Chia hỗn hợp sau phản ứng thành hai phần. Phần một có khối lượng 67
gam cho tác dụng với lượng dư dung dịch NaOH thấy có 16,8 lít H 2 bay ra. Hòa
tan phần hai bằng một lượng dư dung dịch HCl thấy có 84 lít H2 bay ra. Biết các
9
phản ứng xảy ra hoàn toàn và các thể tích đo đktc . khối lượng Fe thu được trong
quá trình nhiệt nhôm là:
A. 56gam
B. 112gam
C. 28 gam
D. 84 gam
Hướng dẫn
�
�nFe 2amol
�
�
2a.56 27b 102a 67
�
�
BTE
��
�
��
�P1 67�nAl bmol
3b 0,75.2
�
�
� BTNT.oxi
� nAl2O3 amol
�
�����
�
a 0,25mol
� �
��
�
b 0,5mol
� �
� �n k
BTE
�P2 � Fe
��
�
� 2k 3k 3,75.2 � k 1,5mol
� �nAl k
�
�
�
� �nFe 2a k 2(mol)
Câu 22: Nung m gam hỗn hợp X gồm Zn(NO 3)2 và NaNO3 ở nhiệt độ cao đến
phản ứng hoàn toàn thu được 8,96 lít hỗn hợp khí Y (đktc) . Cho khí Y hấp thụ vào
nước thu được 2 lít dd Z và còn lại 3,36 lít khí (đktc) không bị hấp thụ (coi như
oxi không tan trong nước). Dung dịch Z có:
A. PH = 1,3
B. PH = 1
C. PH = 1,7
D. PH = 2
Hướng dẫn
NO
�
nY 0,4� 2 H2O � O�
2 0,15
O2
�
BTNT.nito
����
� nNO2 naxit
0,4 0,15
.4 0,2mol � PH 1
5
Chú ý: Bảo toàn e có ngay số mol NO2 gấp 4 lần số mol O2
Câu 23: Hỗn hợp X gồm KClO3,Ca(ClO3)2,CaCl2 và KCl có tổng khối lượng là
83,68 gam. Nhiệt phân hoàn toàn X thu được 17,472 lít O 2(đktc) và chất rắn Y gồm
CaCl2 và KCl. Y tác dụng vừa đủ 0,36 lít dung dịch K 2CO3 0,5M thu được dung
dịch Z. Lượng KCl trong Z nhiều gấp 22/3 lần lượng KCl trong X. Phần trăm khối
lượng KClO3 trong X là?
10
A. 47,62%
B. 23,51%
C. 58,55%
D. 81,37%
Hướng dẫn
�
�nCaCl a mol
nO2 0,78mol � mY 83,68 0,78.32 58,72g� 2
�nKCl bmol
�111a 74,5b 58,72
�
�nCaCO 0,18 � a 0,18mol � b 0,52mol
Y 0,18K 2CO3 � � 3
�nZ nKCl b 0,36
� nKCl Z 0,88mol � nKClX 0,12mol
BTNT
���
� n KClO3 b 0,12 0,4mol � %KClO3
49
�C
83,68
Câu 24 : Nung hỗn hợp gồm 6,4 gam Cu và 54 gam Fe(NO3)2 trong bình kín ,chân
không. Sau phản ứng hoàn toàn thu được hỗn hợp khí X . Cho X phản ứng hết với
nước thu được 2 lít dung dịch Y. pH của dung dịch Y là:
A. 0,664
B. 1,3
C. 1
D. 0,523.
Hướng dẫn
�nCu 0,1mol
�
�
�nFe(NO3)2 0,3mol
��
�nCuO 0,1mol
��
��nFe2O3 0,15mol
�
BTNT
���
� ��
�
�nHNO3 amol
��
�nNO2 0,6mol � �
BTE
� a 2(0,6 a) 0,025.4
�nNO 0,6 a ���
��
��n 0,025mol
�� O2
a 0,433mol
�
�
��
� PH A
H �
��
�
� 0,2167
Với BTE mình luôn mặc định là bên trái là số mol e nhường ,bên phải là số mol
e nhận.
Câu 25. Hỗn hợp X gồm Fe(NO3)2, Cu(NO3)2 và AgNO3. Thành phần % khối
lượng của nitơ trong X là 11,864%. Có thể điều chế được tối đa bao nhiêu gam hỗn
hợp ba kim loại từ 14,16 gam X?
A. 10,56 gam B. 7,68 gam
C. 3,36 gam
D. 6,72 gam
11
Hướng dẫn
X
mtrong
14,16.0,11864 1,68 � nN 0,12mol � nOtrong X 0,36mol
N
BTKL
���
� mKL mX �m(N,O) 14,16 0,12.14 0,36.16 6,72g
Câu 26. Tiến hành nhiệt phân hoàn toàn m gam hỗn hợp X gồm Cu(NO 3)2 và Cu
trong một bình kín, thu được chất rắn Y có khối lượng (m – 7,36) gam. Cho toàn
bộ chất rắn Y tác dụng với dung dịch H2SO4 đặc nóng dư đến khi phản ứng xảy ra
hoàn toàn thu được 0,672 lít SO2 (đktc) là sản phẩm khử duy nhất. Giá trị m là:
A. 19,52 g.
B. 20,16 g.
C. 22,08 g.
D. 25,28 g.
Hướng dẫn
Do Y + H2SO4 có SO2 nên Y chứa Cu dư do đó khối lượng giảm là khối lượng
của NO2 (0,16 mol)
Có ngay
�
�nCu NO3 2 0,08mol
BTNT.nito
����
� m�
�nCu amol
:
�n a 0,08
t0
��
� m 7,36� Cu
�nO 6.0,08 2,0,16 0,16mol
BTE
��
�
� 2(a 0,08) 0,16.2 0,03.2 � a 0,11mol � m 22,08g
Câu 27: Nhiệt phân hoàn toàn hỗn hợp gồm m1 gam Fe(NO3)2 và m2 gam Al(NO3)3
thu được hỗn hợp khí X Trộn hỗn hợp khí X với 112 ml khí O 2 (ddktc) được hỗn
hợp khí Y. Hấp thụ hoàn toàn hỗn hợp khí Y vào 3,5 lít H 2O (không thấy có khí
thoát ra) được dung dịch có pH = 1,7. Giá trị m1 và m2 lần lượt là
A. 4,5 và 6,39
B. 2,700 và 3,195
C. 3,60 và 2,130
D. 1,80 và 0,260
Hướng dẫn
�nFe(NO3)2 2amol BTNT �
�nFe O a mol
�
���
�� 2 3
�
�nAl(NO3)3 2bmol
�nAl2O3 bmol
12
�nNO2 4a 6b
�
BTNT
���
�X �
12a 18b 3a 3b 2(4a 6b)
0,5a 1,5b
�nO2
2
�
BTE
�
���
�
� 4a 6b 4(0,5a 1,5b 0,005)
�nNO 4a 6b
�
�Y � 2
� BTNT nito
� naxit 0,07 4a 6b
�nO2 0,5a 1,5b 0,005�����
a 0,01mol
�
��
�C
�b 0,005mol
Câu 28. Nhiệt phân hoàn toàn hỗn hợp X gồm KNO 3 và Fe(NO3) thu được hỗn
hợp khí Y. Dẫn từ từ hỗn hợp khí Y vào nước thấy các khí được hấp thụ hoàn toàn.
Tỉ lệ về số mol của 2 chất tương ứng trong hỗn hợp X là :
A. 1 : 1
B. 2 : 1
C. 1 : 2
D. 1 : 3
Hướng dẫn
�nNO 2b
�
�
�nKNO3 amol
�nKNO2 amol BTNT � 2
X�
��
���
��
a 0,5b
�nFe(NO3)2 bmol �nFe2O3 0,5b
�nO2
2
�
BTE
���
� nNO2 4nO2 � 2b 4
a 0,5b
� b 2a
2
Câu 29. Đem nung một khối lượng Ca(NO3)2 sau một thời gian dừng lại. làm
nguội rồi cân thấy khối lượng giảm 0,54 gam. Khối lượng Ca(NO 3)2 đã bị nhiệt
phân là:
A. 0,8200 gam
B. 2,7675 gam
C. 0,4500 gam
D. 0,2321 gam
Hướng dẫn
t
Ca NO3 2 ��
� Ca NO2 2 O2
0
nO
2
0,54
t pha�
n
0,016875 mol � mnhie�
2,7675g
Ca NO3
2
32
Câu 30: Nhiệt phân hoàn toàn 50 gam một loại quặng đôlômit có lẫn tạp chất trơ
sinh ra 8,96 lít khí CO2 (ở đktc). Thành phần phần trăm về khối lượng của
CaCO3.MgCO3 trong loại quặng nêu trên là:
13
A. 50%.
B. 73,6%
C. 40%.
D. 84,2%.
Hướng dẫn
Ta có :
BTNT.C
nCO2 0,4mol ����
nCaCO3.MgCO3 0,2 mol
� %CaCO3.MgCO3
0,2.184
.100 73,6%
50
Câu 31: Nhiệt phân hoàn toàn 1,88g một muối nitrat của kim loại hoá trị II thấy
thoát ra 0,56 lit hỗn hợp khí (đktc). Công thức của muối nitrat là:
A. Zn(NO3)2
B. Cu(NO3)2
C. Fe(NO3)2
D. Hg(NO3)2.
Hướng dẫn
Giả sử số oxi hóa của kim loại không đổi.Ta có ngay :
�
�nNO amol
0,025� 2
�nO2 bmol
a b 0,025
�
� � BTE
� a 4b
����
BTNT.N
a 0,02mol ����
� nmuoi 0,01mol
�
��
b 0,005mol
�
� M muoi 188 � M kim loai 188 62.2 64
→ Chọn B
Câu 32: Nhiệt phân 50,56 gam KMnO4 sau một thời gian thu được 46,72 gam chất
rắn. Cho toàn bộ lượng khí sinh ra phản ứng hết với hỗn hợp X gồm Mg, Fe thu
được hỗn hợp Y nặng 13,04 gam. Hòa tan hoàn toàn hỗn hợp Y trong dung dịch
H2SO4 đặc, nóng dư thu được 1,344 lít SO2 (đktc). Thành phần % về khối lượng
Mg trong X là:
A. 39,13%.
B. 52,17%.
C. 28,15%.
D. 46,15%.
Hướng dẫn
BTKL
���
� mO 50,56 46,72 3,84
� nO 0,24
14
�nMg amol
�
13,04g�nFe bmol
�n 0,24mol
�O
� %Mg
BTKL
����
� 24a 56b 9,2
a 0,15mol
�
�
��
� BTE
� 2a 3b 0,24.2 0,06.2
�b 0,1mol
����
0,15.24
.100 39,13%
9,2
Câu 33: Nung 19,4 gam hỗn hợp Fe(NO3)2, AgNO3 một thời gian thu được hỗn
hợp chất rắn X. Cho X vào nước đến khi các phản ứng xảy ra hoàn toàn thu được
chất rắn Y và dung dịch Z. Cho Y vào dung dịch HCl dư có 4,32 gam chất rắn
không tan. Cho Z tác dụng với dung dịch HCl dư thì có khí không màu thoát ra hóa
nâu trong không khí. Phần trăm khối lượng của AgNO3 trong hỗn hợp ban đầu là
A. 30,94%.
B. 35,05 %
C. 22,06%.
D. 30,67%.
Hướng dẫn
Vì Z tác dụng với HCl cho khí NO nên Z phải có Fe 2+ và NO3 .Do đó,Z không
còn Ag+
Vậy ta có :
nAg nAgNO3
4,32
0,04.170
0,04 mol � %AgNO3
.100 35,05%
108
19,4
Câu 34: Nung nóng m gam PbS ngoài không khí sau một thời gian, thu được hỗn
hợp rắn (có chứa một oxit) nặng 0,95 m gam. Phần trăm khối lượng PbS đã bị đốt
cháy là:
A. 95,00 %
B. 25,31 %
C. 74,69 %
D. 64,68 %
Hướng dẫn
Để ý thấy PbS → PbO
Do đó mỗi mol PbS bị nhiệt phân khối lượng chất rắn sẽ giảm 32 – 16 = 16 gam.
Cho m =100 .Ta có ngay :
5
0,3125 mol
16
pha�
n�
�
ng
� mPbS
0,3125.(207 32) 74,69g
pha�
n�
�
ng
� m � 5(gam) � nPbS
15
Câu 35: Trộn KMnO4 và KClO3 với một lượng bột MnO2 trong bình kính thu
được hỗn hợp X. Lấy 52,550 gam X đem nung nóng , sau một thời gian thu được
hỗn hợp chất rắn Y và V lít khí O2. Biết KClO3 bị nhiệt phân hoàn toàn tạo 14,9
gam KCl chiếm 36,315% khối lượng Y. Sau đó cho toàn bộ Y tác dụng hoàn toàn
với axit HCl đặc du đung nóng , sau phản ứng cô cạn dung dịch thu được 51,275
gam muối khan. Hiệu suất của quá trình nhiệt phân muối KMnO4 trong X là:
A. 62,5%
B. 91,5%
C. 75%
D. 80%
Hướng dẫn
nKCl 0,2mol � nKClO3 0,2 mol
BTKL
���
� n�
O2
mY
14,9
41,03g
0,36315
52,550 41,03
0,36mol
32
Vì cho X hoặc Y tác dụng với HCl thì khối lượng muối như nhau nên.
�nKMnO amol
4
�
�nKCl a 0,2
�
�
HCl
mX 52,55�nKClO3 0,2mol ���
�
�
�nMnCl2 a b
n
bmol
� MnO2
Ta có ngay :
74,5(a 0,2) 126(a b) 51,275
�
BTKL
���
��
158a 87b 52,55 24,5
�
a 0,15mol
�
��
b 0,05mol
�
� H%
0
t
2KMnO4 ��
� K 2MnO4 MnO2 O2
0,36 0,3
80%
0,075
Câu 36: Cho 31,6 gam hỗn hợp Cu và Cu(NO3)2 và một bình kín không chứa
không khí rồi nung bình ở nhiệt độ cao để phản ứng xảy ra hoàn toàn, khối lượng
chất rắn giảm 9,2 gam so với ban đầu. Cho chất rắn này tác dụng với HNO 3 thấy có
NO thoát ra. Khối lượng Cu trong hỗn hợp đầu là:
A. 18,8.
B. 12,8.
C. 11,6.
D. 15,7.
Hướng dẫn
16
Vì phản ứng hoàn toàn và chất rắn tác dụng với HNO 3 có khí NO → 9,2 gam là
NO2.
Ta có :
nNO2
�nCu(NO3)2 0,1mol
9,2
�
BTNT.N BTKL
0,2mol �����
� 31,6�
46
mCu 12,8g
�
Câu 37: Nhiệt phân hoàn toàn 9,4 gam 1 muối nitrat kim loại thu được 4 gam chất
rắn oxit. CTPT của muối là:
A. Fe(NO3)3. B. Cu(NO3)2. C. KNO3.
D. AgNO3.
Hướng dẫn
Vì thu được oxit nên ta loại C và D ngay.
Với B ta có:
nCu(NO3)2
9,4
BTNT.Cu
0,05mol ����
� mCuO 0,05.80 4g
188
Câu 38: Nung nóng mg Cu(NO3)2 sau một thời gian dừng lại, làm nguội rồi cân
thấy khối lượng giảm 0,54 gam.Vậy khối lượng Cu(NO3)2 đã bị nhiệt phân là:
A. 0,5 gam.
B. 0,49 gam. C. 0,94 gam. D. 9,4 gam.
Hướng dẫn
Ta có :
tpha�
n
�
nb�nhie�
amol
� Cu NO3 2
� m 2a.46 0,5a.32 0,54g
�
t0
Cu NO3 ��
� CuO 2NO2 0,5O2
�
2
�
� a 0,005 mol
� mCu(NO3 )2 0,94g
2. BÀI TOÁN ĐỒNG VỊ
Giả sử nguyên tố A có n đồng vị.Phần trăm các đồng vị lần lượt là x1,x2...xn
A
A1 .x1 A2 .x 2 A3 .x3 ...
x1 x 2 x3 ...
Ta có công thức tình nguyên tử khối trung bình:
Chú ý bài toán : Tính % của 1 đồng vị nào đó trong hợp chất.
Câu 1: Trong tự nhiên, nguyên tố đồng có hai đồng vị là
63
29
Cu
và
65
29
Cu
. Nguyên tử
17
khối trung bình của đồng là 63,54. Thành phần phần trăm tổng số nguyên tử của
65
đồng vị Cu là:
A. 27%
29
B. 50%
C. 54%
D. 73%
Hướng dẫn
63,54
65 X 63(100 X )
� X 27 � A
100
Ta có :
Câu 2: Trong tự nhiên clo có hai đồng vị bền:
37
17
Cl
chiếm 24,23% tổng số nguyên
35
17
37
tử, còn lại là Cl . Thành phần % theo khối lượng của 17 Cl trong HClO4 là:
A. 8,92%
B. 8,43%
C. 8,56%
D. 8,79%
Hướng dẫn
37.24, 23 35.75,77
35, 4846
100
37.0, 2423
� % 1737Cl
.100 8,92%
1 64 4.35, 4846
Cl
Câu 3: Nguyên tố X có hai đồng vị, đồng vị thứ nhất 35X chiếm 75%. Nguyên tử
khối trung bình của X là 35,5. Đồng vị thứ hai là:
A. 34X.
B. 37X.
C. 36X.
D. 38X.
Hướng dẫn
35,5
75.35 25. X
� X 37
100
Câu 4: Nguyên tố Cu có nguyên tử khối trung bình là 63,54 có 2 đồng vị X và Y,
biết tổng số khối là 128. Số nguyên tử đồng vị X = 0,37 số nguyên tử đồng vị Y.
Vậy số nơtron của đồng vị Y ít hơn số nơtron của đồng vị X là:
A. 2
B. 4.
C. 6.
D. 1.
18
Hướng dẫn
% X 27%
�X Y 100 �
��
�
%Y 73%
�X 0,37Y
�
�
27 X 73 128 X
100
�X 65
63,54 � �
�A
Y 63
�
Câu 5: Một nguyên tố R có 2 đồng vị có tỉ lệ số nguyên tử là 27/23. Hạt nhân của
R có 35 hạt proton. Đồng vị thứ nhất có 44 hạt nơtron, đồng vị thứ 2 có số khối
nhiều hơn đồng vị thứ nhất là 2. Nguyên tử khối trung bình của nguyên tố R là bao
nhiêu?
A. 79,2.
B. 79,8.
C. 79,92.
D. 80,5.
Hướng dẫn
% X 54% �X 79
�X Y 100 �
79.54 81.46
��
��
�R
�C
�
%Y 46%
Y 81
100
�23 X 27Y
�
�
Câu 6: Trong tự nhiên Ag có hai đồng vị bền là 107Ag và 109Ag. Nguyên tử khối
trung bình của Ag là 107,87. Hàm lượng 107Ag có trong AgNO3 là (biết N =14; O
= 16)
A. 43,12%.
B. 35,59%.
C. 35,56%.
D. 35,88%.
Hướng dẫn
%107Ag X
107X 109(100 X)
� X 56,5%
100
107.0,565
.100 35,59%
107,87 62
� 107,87
� %107 Ag X trong AgNO3
79
81
Câu 7: Nguyên tố Brom có 2 đồng vị là Br và Br . Khi cho Br2 phản ứng vừa đủ
với 3,45 gam Na thu được 15,435 gam muối. Cho biết nguyên tử khối của Na là
79
23, thành phần % về số nguyên tử của đồng vị Br trong hỗn hợp hai đồng vị là:
A. 45%
B. 54,38%
C. 44,38%
D. 55%
Hướng dẫn
19
BTNT
nNa 0,15mol ���
� nNaBr 0,15 � 23 M
% 79Br : X �
15,435
� M 79,9
0,15
79X 81(100 X)
79,9 � X 55
100
Câu 8: Hidro được điều chế bằng cách điện phân nước, hidro đó gồm 2 loại đồng
1
2
vị 1 H và 1 D . Biết nguyên tử khối của hidro là 1,008, nguyên tử khối của oxi là 16.
2
Trong 27,024 gam nước nói trên có số nguyên tử đồng vị 1 D là:
A.14,214.1021
B.33,502.1022
C.13,352.1021
D.14,455.1021.
Hướng dẫn
Ta có :
nn���
c
1,008
2.X 1.(100 X)
100
� X 0,8%
27,024
1,5.6,023.1023.2.0,8
1,5 mol � N 2 D
14,45.1021
1
2.1,008 16
100
Câu 9: Trong tự nhiên, nguyên tố đồng có hai đồng vị là
63
29
Cu
và
65
29
Cu
. Nguyên tử
khối trung bình của đồng là 63,54. Thành phần phần trăm của đồng vị
CuSO4 là:
A.17%
B.11%
C.21%
D.14%
65
29
Cu
trong
Hướng dẫn
Ta
có :
63,54
65
� %29
Cu
65 X 63(100 X )
� X 27
100
0,27.65
.100 11%
63,54 96
20
3. BÀI TOÁN TÍNH BÁN KÍNH NGUYÊN TỬ
Cần nhớ một số công thức :
Khối lượng riêng của một chất :
D
m
V .
4
V r3
3
Thể tích khối cầu :
; r là bán kính của khối cầu.
m
D
4
.3,14.r 3
3
Liên hệ giữa D vá V ta có công thức :
Ta giải bài toán như sau :
Giả sử có 1 mol nguyên tử.
Vtinhthe�
Vtinhthe�.%
m
4
� V1.n.tu
r 3 � r ...
23
D
3
6,023.10
BÀI TẬP ÁP DỤNG
Câu 1: Giả thiết trong tinh thể, các nguyên tử sắt là những hình cầu chiếm 75%
thể tích tinh thể, phần còn lại là các khe rỗng giữa các quả cầu, cho khối lượng
nguyên tử của Fe là 55,85 ở 20oC khối lượng riêng của Fe là 7,78 g/cm 3. Cho
Vhc = 4/3 r3. Bán kính nguyên tử gần đúng của Fe là:
A. 1,44.10-8 cm.
B. 1,29.10-8 cm.
C. 1,97.10-8 cm.
D. Kết quả khác.
Hướng dẫn
Giả sử có 1 mol nguyên tử Fe:
Vtinhthe�
m 55,85
7,179(cm3)
D 7,78
� V1.n.tu
Vtinhthe�.0,75
4
8,94.1024 r 3 � r 1,29.108cm
3
6,023.10
23
21
Câu 2: Ở 200C khối lượng riêng của Au là DAu = 19,32 g/cm3. Giả thiết trong tinh
thể các nguyên tử Au là những hình cầu chiếm 75% thể tích tinh thể. Biết khối
lượng nguyên tử của Au là 196,97. Tính bán kính nguyên tử của Au là :
8
A. 1,44.10 cm
8
B. 2,54.10 cm
8
C. 1,84.10 cm
8
D. 1,68.10 cm
Hướng dẫn
196,97
V Au
10,195 cm 3
19
,
32
Ta có: Thể tích của 1 mol tinh thể Au:
75
1
10,195.
.
12,7.10 24 cm 3
23
100 6,023.10
Thề tích của 1 nguyên tử Au:
Bán kính của Au:
r 3
3V
3.12,7.10 24
3
1,44.10 8 cm
4.
4.3,14
Câu 3: Khối lượng riêng của canxi kim loại là 1,55 g/cm 3. Giả thiết rằng, trong
tinh thể canxi các ngtử là những hình cầu chiếm 74% thể tích tinh thể, phần còn lại
là khe rỗng. Bán kính nguyên tử canxi tính theo lí thuyết là:
A. 0,155nm.
B. 0,185 nm.
C. 0,196 nm.
D. 0,168 nm.
Hướng dẫn
+ Thể tích 1 mol tinh thể Ca :
V
+ Thể tích 1 mol nguyên tử Ca :
+ Thể tích 1 nguyên tử Ca :
Áp dụng công thức :
V
V
40
28,81cm3
1,55
V 28,81.74% 19,1cm3
19,1
3,17.1023cm3
23
6,02.10
4 3
3V
r � r 3
1,96.108 cm 0,196nm
3
4
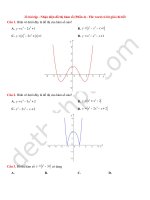
Câu 4: Nguyên tử X có cấu trúc mạng lập phương tâm diện (hình
bên).
Phần trăm thể tích không gian trống trong mạng lưới tinh thể của
22
X là:
A. 32 %.
B. 26 %.
C. 74 %.
D. 68 %.
Hướng dẫn
a là độ dài ô mạng cơ sở; r là bán kính nguyên tử
Có
4
�
�1 � 1
4. . .r 3
� .8 � .6 4
�
��
�f 33
0, 74 � B
�8 � 2
a
�
ngay �a 2 4r
Câu 5: Cho biết KLNT của Mg là 24,305 và khối lượng riêng của magie kim loại
3
là 1,74g/ cm .Giả thiết các nguyên tử Mg là những hình cầu nội tiếp trong các hình
lập phương.Bán kính gần đúng của Mg là :
8
A. 4,41.10 cm
8
B. 3,61.10 cm
8
C. 1,41.10 cm
8
D. 1,01.10 cm
Hướng dẫn
+ Thể tích 1 mol tinh thể Ca :
V
24,305
13,986cm3
1,74
v
V
2,319.1023 cm3
23
6,023.10
+ Thể tích 1 hình lập phương con :
+ Đường kính nguyên tử Mg bằng cạnh hình lập phương nên ta có :
r
L 13
1
v 3 2,319.1023 1,41.108 cm
2 2
2
23
4. BÀI TOÁN VỀ PHÂN BÓN HÓA HỌC
HƯỚNG DẪN
Độ dinh dưỡng của phân đạm đánh giá qua hàm lượng %N
Độ dinh dưỡng của phân lân đánh giá qua hàm lượng %P2O5
Độ dinh dưỡng của phân Kali đánh giá qua hàm lượng % K2O
ÁP DỤNG
Câu 1: Một loại phân lân có thành phần chính Ca(H 2PO4)2.2CaSO4 và 10,00% tạp
chất không chứa photpho. Hàm lượng dinh dưỡng trong loại phân lân đó là:
A. 36,42%.
B. 28,40%.
C. 25,26%.
D. 31,00%.
Hướng dẫn
Độ dinh dưỡng của phân lân được đánh giá qua hàm lượng P2O5.
Giả sử có 100 gam phân lân. Ta có ngay:
�
Ca H2PO4 .2CaSO4 :90gam � n 0,1779 � nP 0,3558mol
�
2
100gam�
pcha�
t :10 gam
�ta�
� nP O 0,1779mol � %P2O5 25,26% � C
2 5
Câu 2: Cho m gam một loại quặng photphorit (chứa 7% là tạp chất trơ không chứa
photpho) tác dụng vừa đủ với dung dịch H2SO4 đặc để sản xuất supephotphat đơn.
Độ dinh dưỡng của supephotphat đơn thu được khi làm khan hỗn hợp sau phản
ứng là:
A. 53,62%.
B. 34,20%.
C. 42,60%.
D. 26,83%.
Hướng dẫn
Cho m = 100 g.
24
�
Ca3(PO4 )2 : 93g
� nCa PO 0,3 mol � nP O 0,3mol
�
2 5
3
4 2
cha�
ttr�:7g
�
Ta có ngay:
Ca3(PO4)2 + 2H2PO4 → Ca(H2PO4)2 + 2 CaSO4
→ Độ dinh dưỡng =
mP 2O 5
26,33%
100 0,6.98
→ Chọn D
Câu 3: Một loại phân amophot chỉ chứa hai muối có số mol bằng nhau. Từ 1,96 tấn
axit photphoric sản xuất được tối đa bao nhiêu tấn phân bón loại này?
A. 2,81 tấn. B. 2,64 tấn. C. 2,30 tấn.
D. 2,47 tấn.
Hướng dẫn
�
�
�NH4H2PO4 :a
BTNT.phot pho
Amophot: �
�����
� nP 2a
�
�
NH4 2 HPO4 :a
�
�
�
�nH3PO4 0,02mol � 2a 0,02 � a 0,01mol
� m 0,01(115 132) 24,7g
Câu 4: Một loại phân đạm ure có độ dinh dưỡng là 46,00%. Giả sử tạp chất trong
phân chủ yếu là (NH4)2CO3. Phần trăm về khối lượng của ure trong phân đạm này
là:
A. 92,29%.
B. 96,19%.
C. 98,57%.
D. 97,58%.
Hướng dẫn
Giả sử có 100 gam Ure (NH2)2CO
�
NH2 2 CO:amol
60a 96b 100 �
a 1,61538mol
�
�
100�
; mN 46 � �
��
14.2(a b) 46 �
b 0,032mol
NH4 2 CO3 : bmol
�
�
� %Ure 96,19%
Câu 5: Phân supephotphat kép thực tế sản xuất được thường chỉ có 40% P2O5. Vậy %
khối lượng Ca(H2PO4)2 trong phân bón đó là:
A. 78,56%.
B. 56,94%.
C. 65,92%.
D. 75,83%.
25