Tải Giải bài tập Hóa 11 nâng cao bài 12 - Axit nitric và muối nitrat
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (133.36 KB, 4 trang )
<span class='text_page_counter'>(1)</span><div class='page_container' data-page=1>
<b>Giải bài tập Hóa 11 nâng cao bài 12</b>
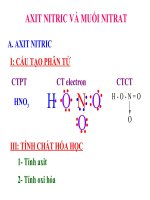
<b>Bài 1 (trang 55 sgk </b>Hóa 11 nâng cao<b>): Viết công thức electron và công</b>
thức cấu tạo của axit nitric và cho biết nguyên tố có số oxi hóa là bao nhiêu?
Lời giải:
<b>Bài 2 (trang 55 sgk Hóa 11 nâng cao): Lập Phương trình hóa học của các</b>
phản ứng sau đây:
a) Fe+HNO3 (đặc,nóng)→NO2+⋯
b) Fe+HNO3 (lỗng)→NO+<sub>⋯</sub>
c) Ag+HNO3 (đặc)→NO2+⋯
d) P+HNO3 (đặc)→NO2+H3PO4…
Lời giải:
a) Fe+6HNO3 (đặc,nóng)→3NO2+Fe(NO3)3+3H2O
b) Fe+4HNO3 (lỗng)→NO+Fe(NO3)3+H2O
c) Ag+2HNO3 (đặc)→NO2+AgNO3+H2O
d) P+5HNO3 (đặc)→5NO2+H3PO4+H2O
</div>
<span class='text_page_counter'>(2)</span><div class='page_container' data-page=2>
Hãy viết Phương trình hóa học của các phản ứng trong sơ đồ chuyển hóa trên.
Lời giải:
<b>Bài 4 (trang 55 sgk Hóa 11 nâng cao): Hợp chất nào sau đây của nitơ</b>
không được tạo ra khi cho HNO3 tác dụng với kim loại?
A. NO
B. NH4NO3
C. NO2
D. N2O5
Lời giải:
Chọn D. N2O5
</div>
<span class='text_page_counter'>(3)</span><div class='page_container' data-page=3>
Lời giải:
Khi điều chế HNO3 bố khói (HNO3 tính khiết) phải sử dụng H2SO4 đặc và
NaNO3 ở dạng rắn vì: HNO3 tan nhiều trong nước và tạo thành hỗn hợp đẳng
phí (685 HNO3)
NaNO3 (rắn) + H2SO4 (đặc) →to<sub> NaHSO4 + HNO3</sub>
<b>Bài 6 (trang 55 sgk </b>Hóa học 11<b> nâng cao): Phản ứng giữa HNO3 và FeO</b>
tạo ra khí NO. tổng các hệ số trong phản ứng oxi hóa – khử này bằng?
A. 22
B. 20
C. 16
D. 12
Lời giải:
Chọn A. 3FeO+10HNO3 → 3Fe(NO3)3 +NO+5H2O
<b>Bài 7 (trang 55 sgk Hóa 11 nâng cao): Cho 13,5 gam nhơm tác dụng vừa</b>
đủ với 2,2 lít dung dịch HNO3 phản ứng tạo ra muối nhôm và một hỗn hợp khí
NO và N2O. Tính nồng độ mol của dung dịch HNO3. Biết rằng tỉ khối của hỗn
hợp khí đối với hiđro bằng 19,2.
Lời giải:
Đặt số mol Al tham gia phản ứng (1) và (2) lần lượt là x mol và y mol.
→ x + y = 13,5/27(*)
Al + 4HNO3 → Al (NO3)3 + NO + 2H20 (1)
x → 4x x
8Al + 10 HNO3 → 8Al(NO3)+ 2N2O + 15H2O (2)
y → 15y/4 → 3y/8
Hỗ hợp khí gồm NO x mol: N2O. 3y/8 mol
</div>
<span class='text_page_counter'>(4)</span><div class='page_container' data-page=4>
Từ (1) và (2) ⇒ = 4x + 15y/4 = 1,9 mol
Nồng độ mol/lit của dung dịch HNO3 đã dùng: = 1,9/2,2 = 0,86M
<b>Bài 8 (trang 55 sgk Hóa 11 nâng cao): Đốt cháy hồn tồn 4,4 gam một</b>
sunfua kim loại cơng thức MS (kim loại M có các số oxi hóa +2 và +3 trong các
hợp chất) trong lượng dư oxi. Chất rắn thu được sau phản ứng hòa tan trong một
lượng vừa đủ dung dịch HNO3 37,8%. Nồng độ phần trăm của muối trong dung
dịch thu được là 41,7%.
a) Xác đinh cơng thức sunfua kim loại.
b) Tính khối lượng dung dịch HNO3 đã dùng.
Lời giải:
a) Gọi khối lượng nguyên của M là M
4MS +7O2 → to<sub> 2M2O3 +4SO2</sub>
M2O3 + 6HNO3 → 2M(NO3)3 + 3H2O
1 → 6 → 2
Xét 1 mol M2O3
Khối lượng dung dịch NHO3 đã dùng:
= 6.63.100/37,8 = 1000 (G)
</div>
<!--links-->