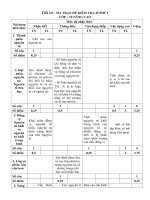
TIET 10 MA TRANDAP ANDE KIEM TRA HOA HOC 9
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (115.36 KB, 3 trang )
<span class='text_page_counter'>(1)</span><div class='page_container' data-page=1>
<b> Tuần:28</b> <b>Ngày soạn:13/03/2012</b>
<b> Tiết:10</b> <b>Ngày dạy:14/03/2012</b>
<b> I. Mục tiêu </b>
<b>1. Kiến thức: Học sinh khắc sâu kiến thức theo các chủ đề sau:</b>
a. Chủ đề 1: Tính chất hố học của oxit
b. Chủ đề 2 : Một số oxit quan trọng.
c. Chủ đề 3 : Tính chất hố học của oxit
d. Chủ đề 4 : Một số oxit quan trọng
<b>2. Kĩ năng:</b>
- Giải bài tập trắc nghiệm khách quan.
- Viết phương trình hóa học và giải thích.
- - Kĩ năng giải bài tập tính theo phương trình hóa học.
<b> 3. Thái độ</b>
- Xây dựng lòng tin và tính quyết đốn của học sinh khi giải vấn đề
- Rèn tính cẩn thận, nghiêm túc trong kiểm tra
<b> II. Hình thức đề kiểm tra</b>
Kết hợp hai hình thức: TNKQ (30%) và TL (70%)
<b>Ma trận của đề thi :</b>
<b>Tên chủ đề</b> <b>Nhận biết</b> <b>Thông hiểu</b> <b>Vận dụng</b> <b>Cộng</b>
<i><b>TNKQ</b></i> <i><b>TL</b></i> <i><b>TNKQ</b></i> <i><b>TL</b></i> <i><b>TNKQ</b></i> <i><b>TL</b></i>
<b>Chủ đề 1</b> Oxit axit tác dụng
với nước
Nhận biết oxit axit
và oxit bazơ
Tính chất hóa
học của oxit
Số câu 1 1 <i><b>Số câu</b></i> <i><b>2</b></i>
Số điểm 0,5 0,5 <i><b>Số điểm</b></i> <i><b>1,5</b></i>
Tỉ lệ % 5% 5% <i><b>Tỉ lệ</b></i> <i><b>15%</b></i>
Chủ đề 2 Điều chế oxit Viết PTHH
Một số oxit
quan trọng
Số câu 1 1 1 <i><b>Số câu</b></i> <i><b>3</b></i>
Số điểm 0,5 0,5 2 <i><b>Số điểm</b></i> <i><b>3</b></i>
Tỉ lệ % 5% 5% 20% <i><b>Tỉ lệ</b></i> <i><b>30%</b></i>
Chủ đề 3 Nhận biết về axit
H2SO4
Tính chất hóa
học của axit
Số câu 1 <i><b>Số câu</b></i> <i><b>1</b></i>
Số điểm 1 <i><b>Số điểm</b></i> <i><b>1</b></i>
Tỉ lệ % 10% <i><b>Tỉ lệ</b></i> <i><b>10%</b></i>
Chủ đề 4 Tính chất hóa học
của H2SO4
Kim loại tác
dụng với axit
Một số axit
quan trọng
</div>
<span class='text_page_counter'>(2)</span><div class='page_container' data-page=2>
Số điểm 1 4 <i><b>Số điểm</b></i> <i><b>5</b></i>
Tỉ lệ % 10% 40 <i><b>Tỉ lệ</b></i> <i><b>50%</b></i>
<i><b>Tổng số câu</b></i> <i><b>4</b></i> <i><b>2</b></i> <i><b>2</b></i> <i><b>1</b></i> <i><b>9</b></i>
<i><b>Tổng số điểm</b></i> <i><b>2</b></i> <i><b>1</b></i> <i><b>3</b></i> <i><b>4</b></i> <i><b>10</b></i>
<i><b>Tỉ lệ %</b></i> <i><b>20%</b></i> <i><b>10%</b></i> <i><b>30%</b></i> <i><b>40%</b></i> <i><b>100%</b></i>
<b>A) Đề thi :</b>
<b>I) Trắc nghiệm : ( 3đ) Khoanh tròn vào ý đúng trong các câu sau . </b>
<b>Câu 1: ( 0,5đ) Có những chất khí sau , H</b>2 , N2 , O2 , SO3 , chất khí nào tác dụng được với nước
, và làm cho giấy quỳ tím chuyển thành màu đỏ .
a) H2 . b) SO3 . c) N2 . d ) O2 .
<b>Câu 2 : (0,5đ) Khi nung đá vôi ( thành phần chính CaCO</b>3 ) , sản phẩm tạo ra những chất nào
sau đây ?
a) CaO . b) CO2 . c) CO . d) CaO , CO2 .
<b>câu 3 : (0,5đ) Có những chất sau , BaO , BaCl</b>2 , Zn , ZnO , chất nào nói trên tác dụng với
dung dịch HCl , giải phóng ra khí H2 .
a) BaO . b) BaCl2 . c) Zn . d) ZnO .
<b>Câu 4: (0,5 đ) Lưu huỳnh đioxit được tạo thành từ cặp chất nào sau đây?</b>
a. Na2SO3 và H2O b. Na2SO3 và NaOH
c. Na2SO4 và HCl d. Na2SO3 và H2SO4
<b>Câu 5 (0,5)</b>Axit sunfuric loãng tác dụng được với dãy chất nào sau đây
a. Zn, Na2O, NaOH b. Zn, Cu, CaO
c. Zn, H2O, SO3 d. Zn, NaOH, CO2
<b>Câu 6 (0,5đ)</b> Cặp chất nào sau đây xảy ra phản ứng:
a. Na2O + NaOH b. Cu + HCl
c. P2O5 + H2SO4 lỗng d. Cu + H2SO4 đặc, nóng
<b>II) Tự luận : ( 7đ) </b>
<b>Câu 1 : ( 2đ) Viết các phương trình hóa học , cho dãy chuyển hóa sau .</b>
0
0 0
2 5
2; ; 2 ;
2 3 2 4 2 4
(1) ( 2) (3) ( 4)
<i>V O</i> <i>t</i>
<i>O</i> <i>t</i> <i>H O</i> <i>NaOH t</i>
<i>S</i>
<i>SO</i>
<i>SO</i>
<i>H SO</i>
<i>Na SO</i>
<b>Câu 2 : ( 1đ) Có 2 lọ bị mất nhãn đựng 3 dung dịch trong suốt , dung dịch H</b>2SO4 ,dung dịch
NaCl , dung dịch KCl , làm thế nào để nhận biết dung dịch H2SO4 bằng phương pháp hóa học
, trong 2 lọ nói trên .
<b>Câu 3 : ( 4đ) Cho 1 lượng sắt dư , tác dụng với dung dịch axit HCl , phản ứng kết thúc thu </b>
được 3,36 lít khí (đktc) .
a) Viết phương trình hóa học xảy ra .
b) Tính khối lượng sắt đã tham gia phản ứng .
<b>B) Đáp án : </b>
<b>I) Trắc nghiệm : (3 đ)</b>
Câu 1 Câu 2 Câu 3 Câu 4 Câu 5 Câu 6
b d c d a d
<b>II) Tự luận : ( 7 đ) </b>
</div>
<span class='text_page_counter'>(3)</span><div class='page_container' data-page=3>
1)
0
2 <sub>2</sub>
<i>t</i>
<i>S O</i>
<i>SO</i>
(0,5đ) , 2)
0
2 5;
2 2 3
2 2
<i>V O t</i>
<i>SO</i> <i>O</i>
<sub></sub>
<i>SO</i> <sub>(0,5đ) , </sub>3)
0
3 2 <sub>2</sub> <sub>4</sub>
<i>t</i>
<i>SO</i> <i>H O</i>
<i>H SO</i>
(0,5đ) 4) <i>H SO</i>2 4 2<i>NaOH</i> <i>Na SO</i>2 42<i>H O</i>2 (0,5đ)
<b>Câu 2 : ( 1đ) Sử dụng giấy quỳ tím cho vào 3 lọ , 2 lọ khơng thấy hiện tượng gì , đó là </b>
dung dịch NaCl , dung dịch KCl . ( 0,5đ)
Lọ làm cho giấy quỳ tím chuyển thành màu đỏ , đó là lọ đựng dung dịch H2SO4 . (0,5đ)
<b>Câu 3 : ( 4đ) </b>
a) Theo bài ra ta có phương trình hóa học :
<i>Fe</i>
2
<i>HCl</i>
<i>FeCl</i>
2
<i>H</i>
2<sub> (1đ) </sub>b) Theo bài ra ta có : Số mol khí H2 = 3,36/ 22,4 = 0,15 ( mol ) (1đ) .
Theo phương trình hóa học ta có : 1mol Fe tạo ra 1mol khí H2
0,15mol Fe tạo ra 0,15 mol khí H2 (1đ)
Khối lượng của Fe tham gia phản ứng là : = 0,15 * 56 = 8,4 gam ( 1đ)
</div>
<!--links-->