Tài liệu Đáp án thi thử ĐH Hóa KA lần 10 (2009-2010) pdf
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (63.55 KB, 3 trang )
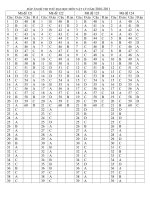
Đáp án đề 10
1C 6D 11D 16A 21B 26C 31A 36D 41D 46C
2D 7A 12B 17D 22A 27B 32B 37A 42D 47A
3B 8D 13B 18C 23C 28A 33C 38D 43C 48D
4B 9B 14B 19A 24C 29C 34B 39C 44D 49B
5C 10D 15D 20B 25C 30B 35D 40B 45C 50D
Hớng dẫn giải một số câu hỏi
10. Giải
Gọi số khối của đồng vị cha biết của nguyên tố agon là A
3
Ta có
= + + =
Ar
3
0,34 0, 06 99, 6
A 36 38 A 39, 98
100 100 100
A
3
= 40
12. Đáp án A.
Vì: m
hh
= m
hhsau p
+ m
O(trong oxit)
= 215 +
15
.16
100
= 217,4 (gam).
13. Đáp án B.
Giải:
Theo PT: 1 mol
2
3
CO
2mol Cl
-
+ 1mol CO
2
m
muối tăng
= 71 - 60 = 11 g
Theo gt: x mol 0,03mol 11.0,03 =0,33g
10 0,33 10,33
muoi
m = + =
(gam).
16. Đáp án A
Giải:
hh
M
= 1,5.16 = 24
2
H
V
2 4
24
11
2
22
4
2
==
CO
H
V
V
CO
V 28 22
19. Đáp án A
Hớng dẫn: áp dụng phơng pháp bảo toàn electron ta có:
n
e
=
It
F
=
1,34.2
26,8
= 0,1 (mol) electron
Quá trình katot Quá trình anot
Cu
2+
+ 2e Cu 2Cl
-
- 2e Cl
2
0,05 0,1 0,05 0.06 0,06 0,03 (mol)
Khối lợng đồng thoát ra là H
2
O - 2e
1
2
O
2
+ 2H
+
0,05 x 64 = 3,2 (gam). 0,1 - 0,06 = 0,04 0,01
Thể tích khí thoát ra ở anot = (0,03 + 0,01) x 22,4 = 0,896 (lit).
20. Đáp án B.
Giải: CO + O
(trongoxit)
CO
2
m
KL
= m
hh
- m
O(trong oxit)
n
O(trong oxit)
= n
COp
=
15,68
22, 4
= 0,7 (mol) m
KL
= 40 - 16.0,7 = 28,8 (gam).
23. Đáp án C
Giải
Theo phơng pháp bảo toàn electron, tổng số mol electron thu bằng tổng số mol
electron nhờng. Tổng e thu = (0,015x4x2) + (0,01x3)=0,15(mol).
Tổng số e nhờng = 0,15mol n
Fe
= 0,15:3 = 0,05 (mol)
Khối lợng Fe = 0,05x56 = 2,8g
24. Đáp án C.
Vì: n
O(trong oxit)
= 2.
2
CO
n
= 0,1.2 = 0,2 (mol)
m
hhban đầu
= m
hhKL
+ m
O(trong oxit)
= 2 + 16.0,2 = 5,2 (gam).
25. Đáp án C
2
2, 24
22, 4
CO
n
= =0,1mol;
2
( )
Ca OH
n
=0,075mol Tỷ lệ 2 >
2 2
( )
0,1
:
0,075
CO Ca OH
n n
= > 1
Sản phẩm là hỗn hợp hai muối CaCO
3
và Ca(HCO
3
)
2
26. Đáp án C
CO và H
2
không khử đợc Al
2
O
3.
34. Đáp án B
Giải thích : phenol và anilin làm mất màu dung dịch brom vì mật độ electron cao ở các
vị trí octo và para. So với phenol anisol có mật độ e lớn hơn ở các vị trí octo và para vì
nhóm CH
3
đẩy electron.
35. Đáp án D
Anbumin + dd CuSO
4
tạo dung dịch màu xanh tím.
NaOH + dd CuSO
4
tạo kết tủa màu xanh nhạt.
Glixerol + dd CuSO
4
tạo dung dịch màu xanh thẫm.
CH
3
COOH + dd CuSO
4
tạo dung dịch màu xanh.
36. Đáp án D.
Giải
PTTQ của este: C
n
H
2n-2
O
2
+
3 1
2
n +
O
2
nCO
2
+ (n-1) H
2
O
n
axit
=
OHCO
nn
22
−
=0,25 - 0,2 = 0,05 (mol).
37. §¸p ¸n A.
V×: 2
R
COOH + Na
2
CO
3
→
2
R
COONa + CO
2
+ H
2
O
0,2 0,2 0,1
⇒ m = 14,8 + 0,2 . (23 - 1) = 19,2 (gam).
39. §¸p ¸nC. Theo §L b¶o toµn khèi l−îng:
12
5
6,0
25,0
6,03,0.2.2
)(3,0
100
25
.22.
4,22
96,8
.2
)()(
)()()()(
2
22222
==⇒===
=−=⇒+=+=
H
C
OtrongHHcacbontronghidroH
OHOOHCOOHOCOOpuO
n
n
nn
molnnnnnn
⇒ CTPT: C
5
H
12
40. §¸p ¸n B.
n
kÕt tña
=
100
10
= 0,1 (mol)
CH
4
+ O
2
→
CO
2
+ 2H
2
O (1)
CO
2
+ Ca(OH)
2
→
CaCO
3
(2)
0,1 0,1 0,1
4
CH
m =
0,1x16= 1,6gam