Tài liệu Đáp án thi thử ĐH Hóa KA lần 8 (2009-2010) docx
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (53.95 KB, 3 trang )
Đáp án đề 8
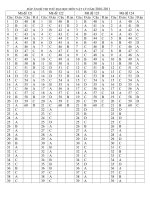
1B 6A 11C 16B 21C 26A 31D 36A 41B 46B
2A 7B 12D 17D 22B 27B 32B 37C 42
1
D
42
2
A
47B
3A 8C 13B 18B 23C 28A 33D 38A 43C 48B
4B 9B 14C 19D 24A 29C 34B 39A 44A 49C
5B 10C 15D 20D 25
1
D
25
2
A
30D 35B 40A 45B 50A
Hớng dẫn giải một số câu hỏi
5. Đáp án B
Giải thích: Nguyên tử E có 7 electron ở các phân lớp p, tức là 2p
6
3p
1
. Cấu hình electron
đầy đủ của E là 1s
2
2s
2
2p
6
3s
2
3p
1
, suy ra Z
E
= 13. E là nhôm.
Tổng số hạt mang điện của F = 13x2 + 8 = 34, suy ra Z
F
= 34:2 = 17 F là clo.
9. Đáp án B
Giải
n
e
=
It
F
=
1,34 2
26,8
ì
= 0,1 (mol);
Quá trình anot: 2Cl
-
Cl
2
+ 2e (1)
0,06 0,03 0,06
H
2
O
1
2
O
2
+ 2e +2H
+
(2)
0,01 0,04
Thể tích khí thoát ra ở anot là 0,04 x 22,4 = 0,896lit
12. Đáp án B
Giải: Khối lợng H
2
= 7,8-7=0,8g, số mol H
2
= 0,4mol
Gọi x, y là số mol của Al và Mg, ta có 27x + 24y = 7,8 (I)
1,5x + y = 0,4 (II)
x = 0,2 và y = 0,1 hay khối lợng Al =5,4g; khối lợng Mg = 2,4g
13. Đáp án C
Giải thích: Các dung dịch K
2
CO
3
, CH
3
COONa, Na
2
S có pH >7 vì chúng là muối của axit
yếu và bazơ mạnh.
17. Đáp án D
Cả 4 kim loại đều tác dụng với dung dịch H
2
SO
4
long, giải phóng khí hiđro. Ba
tác dụng với dung dịch H
2
SO
4
long tạo ra kết tủa trắng BaSO
4
. Cho Ba d vào
dung dịch H
2
SO
4
long, sau khi hết axit, Ba tác dụng với H
2
O tạo ra dung dịch
Ba(OH)
2
. Sử dụng dung dịch này làm thuốc thử nhận ra các muối của Mg, Zn và
Fe.
Ba(OH)
2
+ MgSO
4
BaSO
4
+ Mg(OH)
2
Ba(OH)
2
+ FeSO
4
BaSO
4
+ Fe(OH)
2
4Fe(OH)
2
+ O
2
+ 2H
2
O 4Fe(OH)
3
màu nâu đỏ
Ba(OH)
2
+ ZnSO
4
BaSO
4
+ Zn(OH)
2
Ba(OH)
2
+ Zn(OH)
2
BaZnO
2
+ 2H
2
O
19. Đáp án D
Giải thích: mỗi đồng vị của C có thể tạo ra 6 loại phân tử cacbonic, 2đồng vị của
C tao ra 12 loại phân tử cacbonic.
20. Đáp án D
Giải thích: các phản ứng tự oxi hóa -tự khử là các phản ứng oxi hóa khử trong đó
các chất oxi hóa và chất khử thuộc về cùng một nguyên tố hóa học và cùng số oxi hóa ban
đầu. Các phản ứng (1), (3), (4), (5) và (7) là các phản ứng tự oxi hóa, tự khử. Chọn
phơng án D.
21. Đáp án C
Giải thích
Các phản ứng hóa học trên đều là phản ứng tự oxi hóa tự khử, trong đó clo vừa là chất oxi
hoá, vừa là chất khử. Chọn phơng án C.
22. Đáp án B
Giải
H
2
SO
4
+ NaCl NaHSO
4
+ HCl
1mol 1mol=
58,5
58,5
1mol
C% HCl =
36,5
100%
36,5 146
+
=20%
23. Đáp án C
Giải
C
M
=
0, 2 0,6
0,5
+
= 1,6M
24. Đáp án A
Giải
Số mol H
+
= 0,05.0,02 + 0,02.2.0,075 = 0,001+0,003=0,004mol; [H
+
]=
0,004
0,04
=0,1M
pH =-lg[H
+
] = 1
25. Giải
1. Đáp án D.
Theo định luật bảo toàn electron n
e
thu = n
e
nhờng =
4, 48
3
22, 4
ì =0,6mol
- Nếu kim loại hóa trị III thì số mol kim loại là 0,2mol, khối lợng mol KL là
19, 2
0, 2
=96,
không có kim loại nào phù hợp, loại.
- Nếu kim loại hóa trị II thì số mol kim loại là 0,3mol, khối lợng mol KL là
19, 2
0,3
=64,
kim loại phù hợp là Cu.
2. Đáp án A
Các phơng trình hóa học
Cu(NO
3
)
2
+ 2NaOH Cu(OH)
2
+ 2NaNO
3
Cu(OH)
2
0
t
CuO + H
2
O
Khối lợng CuO = 0,3x80 =24g.