Quy trình định lượng clostridium perfringens
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (1.68 MB, 41 trang )
TRƯỜNG ĐẠI HỌC
CÔNG NGHIỆP THỰC PHẨM
TP HCM
Quy trình định lượng
Clostridium perfringenes
GVHD: Phan Thị Kim Liên
Nhóm 8
•
•
•
•
•
Các thành viên nhóm
8
Đinh Hồng Ngọc
Phạm Thị Tú Oanh
Vy Thị Minh
Đào Thị Thảo Uyên
Nguyễn
Định lượng
C.perfringens
bằng phương pháp
đếm khuẩn lạc
I
Tổng quan về C. perfringenes
II
Nguyên tắc
III
Thiết bị, dụng cụ và môi trường
IV
Các bước tiến hành
V
Kết qua
• Trực khuẩn kỵ khí gram (+), sinh bào tử,
nhiệt độ tối ưu từ 37 – 450C.
•
•
Gặp phổ biến trong đường tiêu hóa của người
nên thường được dùng làm vi sinh vật chỉ thị
về khả năng nhiễm phân.
Bào tử có khả năng cạnh tranh cao, nên khi tế
bào sinh dưỡng bị chết đi, bào tử vẫn sống
sót và sinh trưởng.
NGỘ ĐỘC THỰC PHẨM DO C. PERFRINGENS
C.perfringenes được tìm thấy trong đất, trong phân người.
Chúng thường hiện diện trong các thực phẩm nguội lạnh của
cửa hàng ăn uống.
Triệu chứng: đau thắt vùng bụng, tiêu chảy.
Thời gian ủ bệnh: 12 – 24 giờ.
Nguồn thực phẩm dễ lây nhiễm: Thịt gia cầm, nhất là gia
cầm đông lạnh sâu, thịt trong các hầm chứa và các loại thực
phẩm khác.
Biện pháp: đun sôi nấu kĩ.
NGUYÊN TẮC
1. Định Nghĩa:
Vi khuẩn hình thành các khuẩn lạc điển hình (kết tủa đen,
do khử sunfit thành sunfua, làm cho màu khuẩn lạc bị đen)
trong môi trường chọn lọc và cho các phản ứng khẳng định
dương tính khi thử bằng một trong hai kỹ thuật qui định
trong tiêu chuẩn này.
2. Nguyên tắc:
-
Phương pháp hộp đổ.
o
Ủ trong điều kiện kỵ khí ở 37 C trong 24 giờ.
Định lượng các khuẩn lạc điển hình.
Khẳng định số lượng các khuẩn lạc điển hình
và tính số lượng C.perfringens có trong một
gam hoặc một mililit mẫu.
Thiết bị, dụng cụ và môi trường
1.Thiết bị và dụng cụ
-
Cân.
Bể điều nhiệt.
Nồi tiệt trùng.
Tủ ấm.
Thiết bị nuôi cấy kỵ khí.
Tủ cấy.
- Dao lấy mẫu, pH kế, Erlen.
- Que cấy thẳng và que cấy vòng.
- Phiến kính và lam kính.
- Ống nghiệm.
- Pipet.
- Hộp Petri.
Một số mơi trường thuốc thử thường dùng.
•
•
•
•
•
•
•
Thạch Tryptose Sulfide Cycloserin (TSC agar).
Môi trường Iron - Milk.
Canh thang gan cục hoặc canh thang thịt.
Canh thang nuôi cấy nha bào.
Môi trường Lactoza gelatin.
Dung dịch thioglycolat lỏng..
Thuốc nhuộm Gram.
Môi trường thạch Tryptose – Sulfide – Cycloserine
(TSC agar)
Tryptose (Difco)
15g
Men thuỷ phân
5g
Soyton
5g
Sắt ammonium citrat
1g
Natri metabisunfit
1g
Agar
20g
Nước cất
900ml
Môi trường thioglycolat lỏng.
Pepton từ casein
15g
L – Cystin
D – Glucoza
Cao nấm men
Natri Clorua
0,5g
5,5g
5g
2,5g
Natri thioglycolat (mecaptoaxetat)
0,5g
Thạch
Resazurin
0,5 – 2 ga
0,001g
Nước
1 lít
* Tuỳ thuộc vào sức đông của thạch
Môi trường di động Nitrat.
Cao thịt bò
3g
Pepton (Difco)
5g
Kali nitrat (KNO3)
1g
Dinatri hidro octophosphat
(Na2HPO4)
2,5g
Thạch
1 – 5g (tuỳ thuộc vào sức
đông của thạch)
Galactoza
Glyxerol
Nước
5g
5g
1 lít
Môi trường lactoza sunfit (LS)
Pepton từ casein
5g
Cao nấm men
2,5g
Natri clorua
2,5g
Lactoza
10g
L – Xystin
hydroclorua
0,3g
Nước
1 lít
Môi trường lactoza-gelatin (LS)
Pepton từ casein
15g
Cao nấm men
10g
Lactoza
10g
Gelatin
120g
Phenol đỏ
0,05g
Nước
1 lít
QUY TRÌNH PHÂN TÍCH
Cân 10g (10ml) mẫu + 90 ml SPW
Đồng nhất mẫu
Dịch mẫu [ 10-1 ]
Dịch mẫu [ 10-2 ]
0,1ml
TSC
TSC
TSC
TSC
Sau khi đơng đặc. Rót tiếp 15 ml thạch TSC vào mỗi đĩa petri đã được
láng mẫu thử. Lắc trộn đều sao cho thạch phủ đều khắp bề mặt đĩa petri.
Khi thạch đơng chặt, lật ngược đĩa, ủ kỵ khí ở 37oC trong 2024 giờ.
Thioglycolate brouth, ủ kỵ khí 37oC, 18 – 24 giờ
Lactose sunfit hoặc Nitrat, Lactose-gelatin ủ hiếu khí
46oC/18-24h
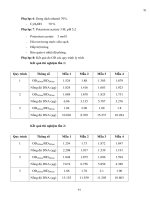
Đọc kết qua sơ bợ sau 24 giờ
- Đếm tồn
bộ các khuẩn lạc có các đặc tính: tròn, lời, bờ đều,
nhẵn, có màu đen..
- Tính số lượng vi khuẩn C. perfringens /1 g thực phẩm bằng
trung bình cộng giữa các đĩa nuôi cấy cùng nờng độ pha lỗng
nhân với hệ số pha lỗng tương ứng.
Các bước thực hiện
Bước 1: Chuẩn bị mẫu thử và huyền phù ban đầu.
Cân 10g mẫu rắn (hút
V = 10ml mẫu lỏng)
Dung dịch pha lỗng
SPW 90ml
Đờng nhất mẫu và dịch pha loãng SPW trong máy
dập 1 phút (lắc đều bình tam giác 2-3phut)
Dịch mẫu 10-1
Bước 2: Pha Loãng Mẫu
90ml SPW +
10g (10ml)
mẫu
-1
10
...
-2
10
10-n
Bước 3: Cấy và ủ mẫu
1 ml
Dịch mẫu 10-1
1 ml
Dịch mẫu 10-2
10–15ml
Môi trường TSC
10-15ml
Môi trường TSC
Để cho đông đặc. Ủ trong điều kiện kỵ khí 24h
Bước 4: Đếm và chọn các khuẩn lạc để khẳng định.
• Đếm các đĩa có số khuẩn lạc dưới 150 sau 24h
ni cấy. Khuẩn lạc C. Perfringenes điển hình có
màu đen trên môi trường TSC. Đếm các khuẩn
lạc C. Perfringenes trên những đĩa có số đếm phù
hợp.
• Chọn 5 khuẩn lạc điển hình và chọn 1 trong hai kỹ
thuật thử khẳng định sau:
Kỹ thuật khẳng định sử dụng môi trường LS
Cấy từng khuẩn lạc vào mt
ủ 370C trong 24h, kỵ khí.
thyoglycolat
lỏng.
dùng pipet
chuyển 5 giọt
dịch sang mt LS, ủ 460C
trong 24h
Kiểm tra các ống
nghiệm này về sự
sinh khí và có x́t
hiện kết tủa màu
đen => dương tính
mt LS
Kỹ thuật khẳng định sử dụng môi trường nitrat để
thử tính di động và mt lactose-gelatin.
Cấy đâm sâu
vào mt, ủ 370C
24h, kỵ khí, thêm
0.2 - 0.5ml thuốc
phát hiện nitrit
MT nitrat
Cấy khuẩn lạc, ủ 370C 24h,
kỵ khí, xuất hiện
màu vàng (do hình thành axit)
và làm lạnh
ở 50C kiểm tra hóa lỏng
MT lactose
gelatin