DIEU CHE KHI HYDRO PHAN UNG THE
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (1.75 MB, 33 trang )
<span class='text_page_counter'>(1)</span>TRƯỜNG T. CHÀO CÁC EM C¸CHHỌC S¾P XÕPSINH (Bè CôC) THÂN MẾN !. TRONG TRANG TrÝ. HOÁ HỌC LỚP 8.
<span class='text_page_counter'>(2)</span>
<span class='text_page_counter'>(3)</span> GIỚI THIỆU Dông cô - Ho¸ chÊt TRONG THÍ NGHIỆM. ống nghiệm Đèn cồn Chậu thuỷ tinh Công tơ hút Giá thí nghiệm. Tấm kính. Kẹp thí nghiệm ống dẫn khí. dung dịch HCl. Kẽm (Zn).
<span class='text_page_counter'>(4)</span> BÀI 33: ĐIỀU CHẾ KHÍ HIĐRO – PHẢN ỨNG THẾ I. ĐIỀU CHẾ KHÍ HIĐRO: 1. TRONG PHÒNG THÍ NGHIỆM:. a)Nguyên liệu: khí hiđro được điều chế bằng cách cho axit (HCl hoặc H2SO4 loãng) tác dụng với kim loại kẽm (hoặc sắt, nhôm).. Kim loaị + axit Muối + H2 .
<span class='text_page_counter'>(5)</span>
<span class='text_page_counter'>(6)</span> Các nhóm tiến hành thí nghiệm và hoàn thành phiếu học tập sau:. Cách tiến hành Bước 1: Cho vào ống nghiệm 2 - 3 viên kẽm Zn, sau đó giọt 2 - 3 ml dung dịch axit clohidric HCl vào ống nghiệm.. Bước 2: Đậy ống nghiệm bằng nút cao su có ống dẫn khí xuyên qua, sau đó thử độ tinh khiết của khí hidro (chờ khoảng 1 phút) rồi đưa que đóm còn tàn đỏ vào đầu ống dẫn khí Bước 3: Đưa que đóm đang cháy vào đầu ống dẫn khí Bước 4: Nhỏ 3 - 4 giọt dung dịch trong ống nghiệm vào ống nghiệm khô rồi cô cạn. Hiện tượng.
<span class='text_page_counter'>(7)</span> Bước 1:Cho 2-3 ml dd axit clohiđric vào ống nghiệm chứa 2-3 hạt kẽm Bước 2 : Đậy ống nghiệm bằng nút cao su có ống dẫn khí xuyên qua (chờ khoảng 1 phút )đưa que đóm có tàn đỏ vào ống dẫn khí nhận xét . Bước 3 : Đưa que đóm đang cháy vào đầu ống dẫn khí quan sát hiện tượng ? Bước 4 : Nhỏ 1 giọt dung dịch lên tấm kính và cô cạn Cô cạn một giọt dung dịch sẽ được chất rắn màu trắng , đó là kẽm clorua. ZnCl2. Các nhóm tiến hành nghiệm Kẽm thídung dịch HClvà rút ra kết luận.
<span class='text_page_counter'>(8)</span> TIẾT 49 - BÀI 33: ĐIỀU CHẾ KHÍ HIĐRO - PHẢN ỨNG THẾ. Cách tiến hành Bước 1: Cho vào ống nghiệm 2 - 3 viên kẽm Zn, sau đó giọt 2 - 3 ml dung dịch axit clohidric HCl vào ống nghiệm.. Hiện tượng Có bọt khí xuất hiện trên bề mặt viên kẽm rồi thoát ra khỏi chất lỏng, kẽm tan dần;. Bước 2: Đậy ống nghiệm bằng nút cao su có Khí thoát ra không làm tàn đóm đỏ ống dẫn khí xuyên qua, sau đó thử độ tinh bùng cháy; khiết của khí hidro (chờ khoảng 1 phút) rồi đưa que đóm còn tàn đỏ vào đầu ống dẫn khí Bước 3: Đưa que đóm đang cháy vào đầu ống dẫn khí Bước 4: Nhỏ 3 - 4 giọt dung dịch trong ống nghiệm vào ống nghiệm khô rồi cô cạn. Khí thoát ra cháy trong không khí với ngọn lửa màu xanh nhạt (yếu), đó là khí hiđro ; Thu được chất rắn màu trắng, đó là kẽm clorua ZnCl2..
<span class='text_page_counter'>(9)</span> KMnO4 O2. HCl. H2 Zn. KMnO4. HCl. H2 O2 Zn. Điều chế và thu khí 02. Điều chế và thu khí H2.
<span class='text_page_counter'>(10)</span> BÀI 33: ĐIỀU CHẾ KHÍ HIĐRO. PHẢN ỨNG THẾ. H2. H2. H2 HCl Zn. H2 HCl Zn. H2O Thu khí hydro bằng phương pháp đẩy không khí ra khỏi ống nghiệm.
<span class='text_page_counter'>(11)</span> BÀI 33: ĐIỀU CHẾ KHÍ HIĐRO. PHẢN ỨNG THẾ. H2. H2. H2. H2. H2 HCl. HCl. HCl. Zn. Zn. Zn. Hình 1. Câu 1: Hình 1, 2 Câu 1: Hình 2, 3 Câu 1: Hình 1, 2, 3. H2. Hình 2. Hình 3. H2O.
<span class='text_page_counter'>(12)</span> TIẾT 49: ĐIỀU CHẾ HIĐRO - PHẢN ỨNG THẾ. I. Điều chế khí hiđro trong phòng thí nghiệm 1. Nguyên liệu: - Kim loại: Zn hoặc Al, Fe.... PTHH:. - Axit: HCl hoặc axit clohiđric H2SO4 loãng hoặc axit sunfuric H2SO4 loãng Zn + 2HCl → ZnCl2 + H2↑. 2. Nguyên tắc : Kim loại + axit muối + H2 3. Cách thu khí hiđro: Có 2 cách. Đẩy không khí Đẩy nước (úp ngược ống nghiệm). II. Phản ứng thế.
<span class='text_page_counter'>(13)</span> Viết các PTHH điều chế khí hyđro. 2Al + 6HCl 2AlCl3 + 3H2 Fe + H2SO4 FeSO4 + H2 Zn + H2SO4 ZnSO4 + H2.
<span class='text_page_counter'>(14)</span> Viết các PTHH điều chế khí hyđro. 2Al + 6HCl 2AlCl3 + 3H2 Fe + H2SO4 FeSO4 + H2 Zn + H2SO4 ZnSO4 + H2 Nguyên tử của đơn chất Al, Fe, Zn đã thay thế nguyên tử nào của axít?.
<span class='text_page_counter'>(15)</span> Viết các PTHH điều chế khí hyđro. 2Al + 6HCl 2AlCl3 + 3H2 Fe + H2SO4 FeSO4 + H2 Zn + H2SO4 ZnSO4 + H2 * Nhận thấy: Nguyên tử của đơn chất Al, Fe, Zn thay thế nguyên tử của nguyên tố hyđro trong hợp chất axit..
<span class='text_page_counter'>(16)</span> Viết các PTHH điều chế khí hyđro. 2Al + 6HCl 2AlCl3 + 3H2 Fe + H2SO4 FeSO4 + H2 Zn + H2SO4 ZnSO4 + H2 * Nhận thấy: Nguyên tử của đơn chất Al, Fe, Zn thay thế nguyên tử của nguyên tố hyđro trong hợp chất axít..
<span class='text_page_counter'>(17)</span> Viết các PTHH điều chế khí hyđro. 2Al + 6HCl 2AlCl3 + 3H2 Fe + H2SO4 FeSO4 + H2. Phản ứng thế. Zn + H2SO4 ZnSO4 + H2 * Nhận thấy: Nguyên tử của đơn chất Al, Fe, Zn thay thế nguyên tử của nguyên tố hyđro trong hợp chất axít..
<span class='text_page_counter'>(18)</span> TIẾT 49 - BÀI 33: ĐIỀU CHẾ KHÍ HIĐRO - PHẢN ỨNG THẾ. I. Điều chế khí hiđro trong phòng thí nghiệm II. Phản ứng thế. 2Al + 6HCl 2AlCl3 + 3H2 Fe + H2SO4 FeSO4 + H2. Phản ứng thế. Zn + H2SO4 ZnSO4 + H2 Em hãy khái niệm thế nào là phản ứng thế?.
<span class='text_page_counter'>(19)</span> TIẾT 49 - BÀI 33: ĐIỀU CHẾ KHÍ HIĐRO - PHẢN ỨNG THẾ. I. Điều chế khí hiđro trong phòng thí nghiệm II. Phản ứng thế Phản ứng thế là phản ứng hoá học giữa đơn chất và hợp chất, trong đó nguyên tử đơn chất thay thế nguyên tử của một nguyên tố khác trong hợp chất.. 2Al + 6HCl 2AlCl3 + 3H2 Fe + H2SO4 FeSO4 + H2 Zn + H2SO4 ZnSO4 + H2. Phản ứng thế.
<span class='text_page_counter'>(20)</span> TIẾT 49: ĐIỀU CHẾ HIĐRO - PHẢN ỨNG THẾ I. Điều chế khí hiđro trong phòng thí nghiệm 1. Nguyên liệu: - Kim loại: Zn hoặc Al, Fe... - Axit: HCl axit clohiđric hoặc axit sunfuric H2SO4 loãng Nguyên tắc : Kim loại + axit muối + H 2 3. Cách thu khí hiđro: . Có 2 cách. Đẩy không khí. Đẩy nước (úp ngược ống nghiệm). II. Phản ứng thế Phản ứng thế là phản ứng hoá học giữa đơn chất và hợp chất, trong đó nguyên tử đơn chất thay thế nguyên tử của một nguyên tố khác trong hợp chất.. Zn + 2HCl → ZnCl2 + H2↑.
<span class='text_page_counter'>(21)</span> CỦNG CỐ BÀI Em hãy chọn từ thích hợp điền vào chỗ trống để hoàn chỉnh các câu sau: hiđro được điều 1. Trong phòng thí nghiệm, khí ………… chế bằng cách cho axit………………............. HCl hoặc H2SO4 loãng Zn hoặc Fe, Al ..tác dụng với kim loại…………………… 2. Phản ứng thế là phản ứng hoá học hợp chất , trong đó đơn chất và ……………… giữa……………. thay thế nguyên tử nguyên tử của đơn chất …………… của một nguyên tố khác trong hợp chất..
<span class='text_page_counter'>(22)</span> Bài tập củng cố Hòa tan hoàn toàn 5,4g Al trong dung dịch H2SO4 loãng. a. Viết PTHH, cho biết chúng thuộc loại phản ứng gì? b. Tính thể tích H2 thu được ở đktc. Bài làm n = Al. m M. n = Al. 5,4 27. = 0,2mol. a. 2Al + 3H2SO4 Al2(SO4)3 + 3H2 (phản ứng thế) 2 mol 0,2 mol. b.. 3 mol 3 mol. VH2 = nH2 . 22,4 = 0,3 . 22,4 = 6,72 lít.
<span class='text_page_counter'>(23)</span> Hướng dẫn về nhà Học bài cũ Làm các bài tập 1, 2, 5, trang 117 Xem bài luyện tập 6.
<span class='text_page_counter'>(24)</span> Chào tạm biệt Hẹn gặp lại.
<span class='text_page_counter'>(25)</span>
<span class='text_page_counter'>(26)</span> Bài 1: Xét các phản ứng:. a. 2H2 + O2. t0. 2H2O Phản ứng hóa hợp - OXH. b. Fe + CuSO4 → FeSO4 + Cu. Phản ứng thế. c. Mg + H2SO4 → MgSO4 + Phản ứng thế H2 d. H2 + CuO → H2O + Cu Phản ứng thế. Em hãy cho biết các phản ứng trên thuộc loại phản ứng gì?.
<span class='text_page_counter'>(27)</span>
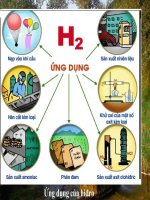
<span class='text_page_counter'>(28)</span> Ứng dụng của khí hyđro. khí hyđro khử oxi của một số oxit kim loại. Hàn cắt kim loại. Sản xuất nhiên liệu (trạm khí hyđro).
<span class='text_page_counter'>(29)</span> Ứng dụng của khí hyđro. Khinh khí cầu Bong bóng bay.
<span class='text_page_counter'>(30)</span> TIẾT 49: ĐIỀU CHẾ HIĐRO - PHẢN ỨNG THẾ. I. Điều chế khí hiđro trong phòng thí nghiệm 1. Nguyên liệu - Một số kim loại: Zn hoặc Al, Fe... - Dung dịch axit: HCl hoặc H2SO4 loãng 2. Nguyên tắc điều chế: Kim loại + axit muối + H2 3. PTHH: Zn + 2HCl → ZnCl2 + H2↑ 4. Cách thu khí hiđro: Có 2 cách. Đẩy không khí Đẩy nước (úp ngược miệng ống nghiệm).
<span class='text_page_counter'>(31)</span> Ứng dụng của hiđro. Nạp vào khí cầu. Sản xuất amoniac. Phân bón. Sản xuất axit HCl. Sản xuất nhiên liệu. Hàn cắt kim loại. Khử oxi của 1 số oxit kim lọai.
<span class='text_page_counter'>(32)</span>
<span class='text_page_counter'>(33)</span> Trường THCS CÙ CHÍNH LAN. HÓA HỌC 8.
<span class='text_page_counter'>(34)</span>