Les troubles de l’intégration visuelle - part 4 potx
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (801.17 KB, 19 trang )
cellules polyédriques, fusiformes, épithélioïdes ou en
ballon. La classification Callendar du mélanome,
établie pour des tumeurs uvéales intra-oculaires, ne
s’applique pas aux mélanomes conjonctivaux. Les
colorations immunohistochimiques jouent un rôle
important dans l’évaluation des tumeurs mélanocy-
tiques malignes survenant dans un naevus ou une
mélanose primitive acquise. Des gammes de colo-
rations impliquant des anticorps avec des amas de
cellules Melan-A, HMB-45 et S100 favorisent la
différenciation des tumeurs bénignes (naevi), des
mélanoses primitives acquises sans atypie (moins
de 1 % de probabilité de progresser vers le méla-
nome), des mélanoses primitives acquises présen-
tant des atypies (plus de 50 % de chances de
progresser vers le mélanome) et des mélanomes
malins
7, 8
. Les colorations immunohistochimiques
d’un mélanome conjonctival montrent une sensibilité
diagnostique de 100 % avec les anticorps anti-S100
et anti-Melan-A et une sensibilité diagnostique de
85 % avec l’anticorps anti-HMB-45
8
.
Traitement
Traitements chirurgicaux
Le traitement recommandé d’un mélanome
conjonctival du limbe classique comprend l’abla-
tion par excision « sans contact » de la tumeur, avec
une marge saine de 2 à 3 mm (Figure 5), une abla-
tion à l’alcool de l’épithélium cornéen adjacent et
une cryothérapie adjuvante de double congélation-
décongélation des marges saines en l’absence de
marges saines de la tumeur de la conjonctive
1,9,10
. Il
est important que toute tentative effectuée ne
perturbe pas la masse tumorale; il est également
important d’utiliser des micro-instruments distincts
pour les différents sites afin de s’assurer que les
spécimens pathologiques ne seront pas contaminés.
Les tumeurs qui ont envahi la membrane de Bow-
man (observées sur les biomicroscopies ultra-
soniques préopératoires) et qui adhèrent plus à la
cornée peuvent nécessiter une kératectomie super-
ficielle. Les tumeurs qui adhèrent à la sclérotique
sous-jacente (apparaissent immobiles à l’examen
clinique et envahissantes sur le cliché de biomicro-
scopie ultrasonique) peuvent nécessiter une
sclérectomie superficielle sous la base de la tumeur
pour tenter d’assurer une excision complète. Il
serait bon de s’assurer que le champ opératoire est
maintenu sec afin de favoriser l’adhérence de
toutes cellules tumorales à la masse excisée. Une
cryothérapie adjuvante faisant appel à une tech-
nique de double congélation-décongélation est
appliquée en dessous des bords de l’épithélium
conjonctival de la résection et à la base de la dissec-
tion sclérale
10
. Le traitement à l’alcool de la base de
la sclérotique a également été utilisé.
Les tumeurs localisées à d’autres endroits
(fornix, conjonctive palpébrale, conjonctive tarsi-
enne) doivent être excisées avec des marges saines
plus larges (3 à 4 mm), un traitement à l’alcool de la
base et une cryothérapie des marges de la conjonc-
tive
1,9
. Des greffes autogènes de la conjonctive, des
greffes de muqueuse buccale ou des greffes de
membrane amniotique peuvent s’avérer nécessaires
avec des résections plus larges et dans les cas où la
formation de symblépharon peut constituer une
complication possible
1,9
.
Moins fréquemment, certains cas peuvent
entraîner un envahissement du globe ou de l’orbite
et peuvent nécessiter de procéder à une énucléa-
tion ou une exentération orbitale modifiées
(Figure 6). Shields et al ont passé en revue
20/151 cas (13 %) de mélanomes conjonctivaux qui
ont nécessité une exentération de l’orbite pour des
patients à un stade avancé de la maladie
11
. Dans
cette série, les facteurs cliniques prédictifs d’exen-
tération de l’orbite étaient la faible acuité visuelle
(< 20/200), la tumeur amélanotique et la localisa-
tion extralimbale de la tumeur. Paridaens et al ont
montré qu’une exentération précoce n’améliorait
pas le pronostic vital
12
et qu’à l’heure actuelle, elle
est réservée à un contrôle palliatif local avec ou
sans dissection des ganglions régionaux.
Chimiothérapie topique
De publications récentes recommandent de
faire appel à une chimiothérapie topique (mito-
mycine C, 5-fluorouracil [5-FU] et interféron A) dans
le traitement des cellules de l’épithélium malpi-
ghien de la conjonctive, des mélanoses primitives
Ophtalmologie
Conférences scientifiques
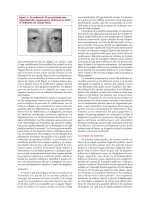
Figure 4 : Évaluation du mélanome conjonctival
par biomicroscopie ultrasonique
4a : Mélanome conjonctival provenant d’un naevus
conjonctival pré-existant.
4b : Cliché de biomicroscopie ultrasonique montrant le
possible envahissement scléral à l’interface de la tumeur et
d’une sclérotique extérieure (flèche).
4a 4b
(Reproduit avec l’aimable autorisation du Dr C. J. Pavlin, publié
dans Ultrasound Biomicroscopy of the Eye,1995)
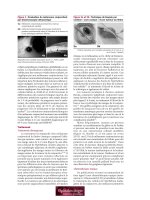
5a 5b
(Clichés reproduits avec l’aimable autorisation du D
r
Jerry A. et
du D
r
Carol L. Shields
9
)
Figure 5a et 5b : Technique de biopsie par
excision « sans contact » d’une tumeur du limbe
acquises, des mélanomes conjonctivaux et de l’en-
vahissement pagétoïde de carcinomes des glandes
sébacées
1
. Demirci et al ont observé une régression
du mélanome conjonctival et de la mélanose primi-
tive acquise présentant des atypies, avec l’applica-
tion de la mitomycine C à 0,04 %, quatre fois par
jour pendant 28 jours, en traitement initial ou pen-
dant 7 jours en tant que traitement adjuvant asso-
cié à une excision et une cryothérapie
13
. Les
recommandations actuelles préconisent de traiter la
mélanose primitive acquise présentant des atypies
ou le petit mélanome conjonctival avec 2 à 4 cycles
de mitomycine C en application topique à 0,04 %,
quatre fois par jour et où un cycle se compose de
7 jours de traitement et de 7 jours sans traitement
afin de permettre à l’épithélium de récupérer. Les
patients s’administrent des gouttes à usage topique
pendant qu’ils sont allongés sur le dos et exercent
alors une occlusion des points lacrymaux pendant
5 minutes après l’administration des gouttes. Cer-
tains centres placent maintenant de manière tem-
poraire des bouchons méatiques afin de prévenir
les effets antimétabolites sur le système de drainage
lacrymo-nasal. Les effets secondaires comprennent
le syndrome de l’œil sec, la kératite ponctuée super-
ficielle (KPS), la conjonctivite toxique et la sténose
des points lacrymaux
1
.
Le 5-FU (gouttes à 1 % dans l’œil) a également
été utilisé pour contrôler la prolifération superfi-
cielle de mélanocytes, incluant la mélanose primi-
tive acquise présentant des atypies et le mélanome
superficiel. L’interféron (Intron A) peut également
être administré par voie topique, habituellement
pour contrôler les tumeurs épithéliales malignes,
mais requiert des durées de traitement plus
longues (mois).
Les recommandations actuelles suggèrent que
la chimiothérapie topique (mitomycine C) en traite-
ment principal est le plus efficace pour les patholo-
gies intra-épithéliales telles que la mélanose
primitive acquise présentant des atypies et le petit
mélanome superficiel. Elle peut jouer un rôle en
tant que thérapie adjuvante dans des cas de marges
positives ou évidence d’envahissement après un
traitement initial de chirurgie et de cryothérapie.
Radiothérapie
Le mélanome est une tumeur qui a tendance à
résister aux radiations et requiert donc une dose
totale de 6 000 à 8 000 cGy pouvant être délivrée
par radiothérapie personnalisée sur plaque. Ceci est
réservé aux patients présentant des tumeurs dif-
fuses qui ne sont pas complètement reséquées ou à
récidives multiples
1
. La radiation joue le rôle de
traitement adjuvant ou de traitement palliatif des
mélanomes conjonctivaux et il n’est fait mention
d’aucun cas publié comparant ces traitements avec
les modalités chirurgicales.
Biopsie des ganglions lymphatiques sentinelles (GLS)
La fréquence des métastases des ganglions
lymphatiques, moins importante que celle du
mélanome conjonctival, varie de 26 à 40 %, dans
un délai de 10 ans suivant le diagnostic. Les gan-
glions régionaux qui sont impliqués comprennent
les ganglions pré-auriculaires (73 %), les ganglions
sous-mandibulaires (9 %) et les ganglions latéraux
profonds du cou (18 %). Toutefois, 26 % des
patients développent des métastases distantes, sans
pathologie ganglionnaire préalable
14
.
Esmaeli et al. ont fait état d’une technique de
biopsie GLS qui détecte les pathologies micro-
scopiques des ganglions régionaux et apporte des
éléments d’information importants en matière
de stadification du mélanome conjonctival
14
. Le
technétium (soufre colloïdal marqué au Tc-99m)
présentant une activité de 0,3 mCi (11,1 Mbq) dans
0,2 mL est injecté sous la conjonctive autour de la
base de la tumeur et est visualisé pendant 20 mi-
nutes dans la région des ganglions régionaux (gan-
glions intraparotidiens, pré-auriculaires, cervicaux
et sous-mandibulaires) à l’aide d’une sonde gamma
portative. Les ganglions individualisés sont excisés
et analysés par histologie sur hématoxyline-éosine
et après colorations immunohistochimiques
(melan-A, HMB-45, MART-1); ils sont également
analysés en recherchant la tyrosine ARNm par la
technique de PCR (polymerase chain reaction).
Les informations sur la stadification de gan-
glions positifs au moment de la résection de la
tumeur primitive permettent une détection précoce
des patients présentant un risque de développe-
ment des métastases distantes ainsi que la possibi-
lité de proposer une chimiothérapie systémique
(p. ex., interféron).
Conclusions
L’ophtalmologiste polyvalent(e) ne rencontrera
que quelques cas de mélanomes conjonctivaux au
cours de sa carrière. Cependant, étant donné la
morbidité et la mortalité importantes qui accompa-
gnent la maladie, c’est un diagnostic qu’il ne peut
Ophtalmologie
Conférences scientifiques
Figure 6 : Mélanome conjonctival à risque
élevé; présentation extralimbale et lésions à
foyers multiples de la conjonctive bulbaire avec
extension à la cornée.
(Cliché reproduit avec l’aimable autorisation du D
r
Brenda Gallie)
8. Heegaard S, Jensen OA, Prause JU. Immunohistochemical diagnosis of
malignant melanoma of the conjunctiva and uvea: comparison of the
novel antibody against melan-A with S100 protein and HMB-45.
Melanoma Res 2000;10:350-354.
9. Shields JA, Shields CL, DePotter P. Surgical management of
conjunctival tumors. Arch Ophthalmol 1997;115:808-815.
10. Shields CL, Shields JA, Armstrong T. Management of conjunctival and
corneal melanoma with surgical excision, amniotic membrane allo-
graft and topical chemotherapy. Am J Ophthalmol 2001,132:576-578.
11. Shields JA, Shields CL, Gunduz K, Cater J. Clinical features predictive
of orbital exenteration for conjunctival melanoma. Ophthal Plast
Reconstr Surg 2000;16:173-178.
12. Paridaens AD, McCartney AC, Minassian DC, Hungerford JL. Orbital
exenteration in 95 cases of primary conjunctival malignant
melanoma. Br J Ophthalmol 1994;78:520-528.
13. Demirci H, McCormick SA, Finger PT. Topical mitomycin chemother-
apy for conjunctival malignant melanoma and primary acquired
melanosis with atypia. Arch Ophthalmol 2000;118:885-891.
14. Esmaeli B, Reifler D, Prieto VG, et al. Conjunctival melanoma with a
positive sentinel lymph node. Arch Ophthalmol 2003;121:1779-1783.
Réunion scientifique à venir
16 au 19 novembre 2004
Annual Meeting of the
American Academy of Ophthalmology
New Orleans, Louisiana
Renseignements : Tél. : 415-561-8500
Fax : 415-561-8533
Courriel :
Evénements futurs dans le département
3 au 4 décembre 2004
Walter Wright Day « Ocular Emergencies »
Coordinateur – Dr Dan DeAngelis
Note : Adresse du site du Programme pour les professeurs
invités (PPI) : Toronto Western Hospital, West Wing, Room
2-401, 399 Bathurst Street, Toronto
À septembre 2004, le PPI aura lieu à l’Hôpital St Michael,
30 Bond Street, Toronto – Paul Marshall Lecture Theatre,
B1-Queen, entrée Queen Street (près de Second Cup).
différer ni laisser de côté. Une forte suspicion clinique
est indispensable au moment d’examens de lésions pig-
mentées de la conjonctive, mais une anamnèse exhaus-
tive, un examen avec une lampe à fente, des clichés
cliniques et un suivi clinique étroit peuvent aider à dif-
férencier le mélanome conjonctival des autres lésions
simulatrices. Une croissance et une nodularité docu-
mentées devraient conduire à une visualisation appro-
priée (biomicrosopie ultrasonique) et le traitement
initial joue un rôle important dans la réduction des taux
de récidives locales et de métastases. L’évaluation des
ganglions lymphatiques sentinelles jouera un rôle de
plus en plus important dans la stadification des patients.
Une résection chirurgicale méticuleuse avec une
cryothérapie adjuvante demeure le traitement de choix,
mais la chimiothérapie topique contribue à la prise en
charge initiale et secondaire. Une chimiothérapie
systémique et/ou une immunothérapie peuvent être
proposées aux patients présentant des lésions ganglion-
naires au moment de la consultation et qui, avec un peu
de chance, amélioreront leur survie à long terme.
Le D
r
McGowan est Maître de conférence à l’Université
de Toronto et exerce en tant que médecin dans l’équipe de
l’Hôpital général de North York et l’Hôpital Princess
Margaret de l’University Health Network de Toronto.
Remerciements : L’auteur tient à remercier E. Rand Simpson
pour sa contribution à la révision de ce manuscrit, le D
r
Charles J. Pavlin pour sa contribution en biomicroscopie ultra-
sonique et le D
r
Yeni Yucel pour sa contribution en histo-
pathologie. La gestion clinique a été fournie par Lee Penney,
Ocular Oncology Service et les clichés cliniques ont été fournis
par Karen Hahn et Allan Connor.
Références
1. Shields CL, Shields JA. Tumors of the conjunctiva and cornea. Surv of
Ophthalmol 2004;49:3-24.
2. Shields CL, Shields JA, Gunduz K, et al. Conjunctival melanoma; risks
factors for recurrence, exenteration, metastasis and death in 150 con-
secutive patients. Arch Ophthalmol 2000;118:1497-1507.
3. Paridaens AD, Minassian DC, McCartney AC, Hungerford JL. Prognos-
tic factors in primary malignant melanoma of the conjunctiva: a clini-
copathological study of 256 cases. Br J Ophthalmol 1994;78: 252-259.
4. Singh AD, Campos OE, Rhatigan RM, et al. Conjunctival melanoma in
the black population. Surv of Ophthalmol 1998; 43:127-133.
5. Yu GP, Hu DN, McCormick S, Finger PT. Conjunctival melanoma; is it
increasing in the United States. Am J Ophthalmol 2003;135:800-806.
6. Pavlin CJ, Foster FS. Ultrasound Biomicroscopy of the Eye. In:
Conjunctival and adnexal disease. New York: Springer-Verlag;
1995:196-208.
7. Jakobiec FA, Folberg R, Iwamoto T. Clinicopathological features of
premalignant and malignant lesions of the conjunctiva. Ophthalmol
1989;96:147-166.
© 2004 Département d’ophtalmologie et des sciences de la vision, Faculté de médecine, Université de Toronto, seul responsable du contenu de cette publication. Édition : SNELL Communication
Médicale Inc. avec la collaboration du Département d’ophtalmologie et des sciences de la vision, Faculté de médecine, Université de Toronto.
MD
Ophtalmologie – Conférences scientifiques est une marque
de commerce de SNELL Communication Médicale Inc. Tous droits réservés. L’administration d’un traitement thérapeutique décrit ou mentionné dans Ophtalmologie – Conférences scientifiques doit
toujours être conforme aux renseignements d’ordonnance approuvés au Canada. SNELL Communication Médicale se consacre à l’avancement de l’éducation médicale continue de niveau supérieur.
L’élaboration de cette publication a bénéficié d’une subvention à l’éducation de
Novartis Ophthalmics
130-009F
La version française a été révisée par le professeur Pierre Lachapelle,
Montréal.
Les avis de changement d’adresse et les demandes d’abonne-
ment pour Ophtalmologie – Conférences Scientifiques doivent
être envoyés par la poste à l’adresse C.P. 310, Succursale H,
Montréal (Québec) H3G 2K8 ou par fax au (514) 932-5114 ou
par courrier électronique à l’adresse
Veuillez vous référer au bulletin Ophtalmologie – Conférences
Scientifiques dans votre correspondence. Les envois non
distribuables doivent être envoyés à l’adresse ci-dessus.
Poste-publications #40032303
SNELL
Ophtalmologie
Conférences scientifiques
AOÛT/SEPTEMBRE 2004
Volume 2, numéro 7
COMPTE RENDU DES CONFÉRENCES
SCIENTIFIQUES DU DÉPARTEMENT
D’OPHTALMOLOGIE ET
DES SCIENCES DE LA VISION,
FACULTÉ DE MÉDECINE,
UNIVERSITÉ DE TORONTO
Département d’ophtalmologie
et des sciences de la vision
Faculté de médecine
Université de Toronto
60 Murray St.
Bureau 1-003
Toronto (Ontario) M5G 1X5
Le contenu rédactionnel d’Ophtalmologie –
Conférences scientifiques est déterminé
exclusivement par le Département
d’ophtalmologie et des sciences de la vision,
Faculté de médicine, Université de Toronto.
Département d’ophtalmologie
et des sciences de la vision
Jeffrey Jay Hurwitz, M.D., Rédacteur
Professeur et président
Martin Steinbach, Ph.D.
Directeur de la recherche
The Hospital for Sick Children
Elise Heon, M.D.
Ophtalmologiste en chef
Mount Sinai Hospital
Jeffrey J. Hurwitz, M.D.
Ophtalmologiste en chef
Princess Margaret Hospital
(Clinique des tumeurs oculaires)
E. Rand Simpson, M.D.
Directeur, Service d’oncologie oculaire
St. Michael’s Hospital
Alan Berger, M.D.
Ophtalmologiste en chef
Sunnybrook and Women’s College
Health Sciences Centre
William S. Dixon, M.D.
Ophtalmologiste en chef
The Toronto Hospital
(Toronto Western Division and
Toronto General Division)
Robert G. Devenyi, M.D.
Ophtalmologiste en chef
Le ptérygion – Mise à jour sur les concepts
actuels et les modalités thérapeutiques
PAR
SAO LEE, M.D.
ET ALLAN SLOMOVIC
, M.D.
Un ptérygion est une pathologie oculaire relativement fréquente qui prédomine
dans les régions chaudes et sèches au nord et au sud de l’équateur. Bien que l’exci-
sion chirurgicale suivie d’une greffe conjonctivale soit actuellement le traitement de
choix, de nouveaux traitements ont été décrits, dont certains peuvent causer des
complications de la surface oculaire. Dans ce numéro d’Ophtalmologie – Con-
férences scientifiques, nous décrivons les facteurs de risque, la pathogenèse, les
symptômes et les options thérapeutiques au ptérygion et décrivons également la
technique chirurgicale de l’excision avec autogreffe conjonctivale.
Définition et morphologie
Un ptérygion primitif est défini comme une croissance fibrovasculaire en triangle
qui se développe à partir de la conjonctive bulbaire pour envahir la cornée (figure 1).
Un ptérygion récidivant est généralement une lésion plus agressive qui peut apparaître
rapidement quelques semaines ou quelques mois après l’excision d’un ptérygion pri-
maire (figure 2). Il faut distinguer un pseudoptérygion d’un ptérygion réel. Il représente
une cicatrice conjonctivale fibrovasculaire ou un pannus dû à un traumatisme
mécanique ou chimique, ou des dégénérescences cornéennes périphériques, telles que
la dégénérescence marginale de Terrien (figure 3). Bien que similaire sur le plan
histologique, un pinguécula est distinguable d’un ptérygion par sa localisation sur la
conjonctive loin du limbe cornéen et par le fait que les tissus fibrovasculaires présents
dans le pinguécula ne sont pas orientés radialement vers l’apex cornéen.
Épidémiologie du ptérygion
La distribution du ptérygion est mondiale, mais sa prévalence est plus élevée dans
les climats chauds et secs
1
. Le facteur commun est la latitude, étant donné que le ptéry-
gion s’observe principalement dans les régions péri-équatoriales aux latitudes de 37
o
au
nord et au sud de l’équateur. Plusieurs études ont montré que la prévalence du ptéry-
gion augmente avec l’âge
2-4
. L’âge d’apparition le plus fréquent est la vingtaine et la
trentaine
2,5
.
Facteurs de risque
Les facteurs de risque les plus importants sont de nature environnementale, à savoir
les rayonnements solaires et ultraviolets (UV) et l’irritation chronique par des particules
dans l’air.
Rayonnements ultraviolets
Le principal facteur de risque environnemental causant l’apparition du ptérygion est
l’exposition aux rayonnements UV
6
. La lumière UV absorbée par la cornée et la
MC
Département
d’ophtalmologie et des
sciences de la vision
FACULTY OF MEDICINE
University of Toronto
Disponible sur Internet à :
www.ophtalmologieconferences.ca
conjonctive favorise les lésions cellulaires et la pro-
lifération cellulaire subséquente
7
. La quantité de
lumière UV absorbée dépend de la latitude (région
de haute incidence), du terrain réfléchissant et du
temps passé à l’extérieur. L’utilisation de lunettes pro-
tectrices et d’une visière peut atténuer certains de
ces facteurs de risque
8
.
Facteurs génétiques
Plusieurs rapports de cas ont décrit des membres
d’une même famille atteints du ptérygion, et une
étude cas-témoins au sein d’un hôpital a montré que
les antécédents familiaux sont significatifs, ce qui
indique une possibilité de transmission autosomique
dominante.
Autres facteurs de risque
L’irritation ou l’inflammation chronique du limbe
ou de la cornée périphérique a été citée comme
facteur de risque par les défenseurs de la théorie
de la « kératite chronique »
11
. Cette inflammation
chronique serait une cause importante de la défi-
cience des cellules souches limbiques et est exa-
minée ci-après
12
. Wong a également suggéré la
présence d’un facteur angiogénique lié au ptérygion
et par conséquent, on a signalé que l’utilisation d’une
pharmacothérapie angiogénique était une option
thérapeutique
13
. La poussière, un faible taux d’hu-
midité et des microtraumatismes provenant de par-
ticules, la sécheresse des yeux et le papillomavirus
ont également été mis en cause
14-17
.
Pathogenèse du ptérygion
Les mécanismes pathophysiologiques précis à la
base de l’apparition du ptérygion, de son évolution
et de sa récidive font encore l’objet de débats
18
.
Dégénérescence vs trouble prolifératif
Décrit classiquement comme une « dégénéres-
cence élastique » à la microscopie optique, le ptéry-
gion consiste en du tissu subépithélial anormal
contenant des fibres de collagène altérées qui sont
visibles avec des colorants élastiques. On pense
qu’il s’agit de processus purement dégénératifs
causés par l’exposition au soleil
19
. Cliniquement, le
ptérygion a des caractéristiques comportementales
qui suggèrent un trouble entraînant une crois-
sance proliférative
20
. Un ptérygion primaire est
localement invasif, s’étendant vers l’apex cornéen.
Le lien existant entre les rayonnements UV et le
cancer est bien connu, et la lumière UV peut
causer des mutations dans la kératose solaire et
les carcinomes cutanés
21
. Le ptérygion a une
propension élevée à récidiver agressivement après
une excision chirurgicale, et les modalités
thérapeutiques sont donc semblables aux traite-
ments anticancéreux.
2
Figure 1 : Ptérygion primaire – croissance épaisse
affectant l’axe visuel
Figure 2 : Ptérygion récidivant
Figure 3 : Pseudoptérygion, secondaire à
un ulcère de Morren
l’échec de l’intervention. Les taux de récidive sig-
nalés varient considérablement de 0 % à 89 %
22-30
.
Chirurgie
La chirurgie du ptérygion peut être divisée en
quatre principaux groupes dans un ordre de com-
plexité croissante :
• Excision de la sclère nue
• Excision avec fermeture/transposition
conjonctivale
• Excision avec traitements d’appoint
antimitotiques
• Techniques de greffe sur la surface oculaire
Excision de la sclère nue
La technique de l’excision de la tête et du corps
du ptérygion jusqu’à la région canthale nasale en
laissant le lit scléral nu pour qu’il se réépithélialise a
été décrite pour la première fois en 1948 par D’Om-
brain
22,30
. Bien que de nombreuses études initiales
aient rapporté le succès de cette intervention, son
principal désavantage est que l’excision de la sclère
nue est associée à un taux élevé de récidive (24 % à
89 %) et pour cette raison, elle n’est pas recom-
mandée pour le traitement du ptérygion primitif ou
récidivant
24,25
.
Excision avec fermeture/transposition
conjonctivale
Plusieurs interventions décrivant la fermeture de
la plaie conjonctivale du lit du ptérygion ont été rap-
portées. La fermeture de la plaie peut être une simple
approximation des marges conjonctivales décollées.
Ou bien, on peut effectuer une transposition con-
jonctivale au moyen d’un lambeau pédiculaire
supérieur ou inférieur ayant fait l’objet d’une rota-
tion pour fermer le lit du ptérygion. Cependant, le
taux de récidive ne semble pas être significativement
plus faible que pour l’excision de la sclère nue. Deux
études récentes utilisant la fermeture simple ou un
lambeau supérieur ayant fait l’objet d’une rotation
montrent un taux élevé de récidive de 37 % et de
29 %, respectivement
26-27
.
Excision avec un traitement médical d’appoint
Un certain nombre de traitement d’appoint ont
été décrits pour réduire le risque de récidive après
l’excision chirurgicale du ptérygion. Chacun a ses
avantages, mais ses inconvénients également.
Rayonnement bêta : Les rayonnements ionisants
inhibent la mitose des cellules qui se divisent rapide-
ment et les tissus proliférant activement sont donc
Déficience des cellules souches limbiques
Les signes classiques ou les caractéristiques
cliniques d’une déficience limbique comprennent
l’épaississement, la vascularisation, l’inflammation
chronique de la conjonctive, la destruction de la
membrane basale et une croissance fibreuse
12
. Ces
signes, qui sont également les caractéristiques d’un
ptérygion, font suggérer à plusieurs chercheurs que
le ptérygion serait la manifestation d’une dysfonction
ou d’une déficience localisée, interpalpébrale des cel-
lules souches limbiques étant peut-être la con-
séquence de la destruction des cellules souches liée à
l’exposition à la lumière UV
12
.
Ces nouvelles études sur les mécanismes
moléculaires et cellulaires survenant dans le ptéry-
gion seront importantes, car de nouvelles connais-
sances sur les mécanismes pathophysiologiques du
ptérygion et la récidive de cette pathologie peuvent
modifier notre approche et offrir de nouvelles straté-
gies pour son traitement médical et chirurgical.
Symptôme du ptérygion
Le ptérygion au stade précoce peut être asympto-
matique ou peut causer des symptômes occasionnels
de sécheresse des yeux, tels qu’une sensation de
brûlure, des démangeaisons ou des larmoiements,
étant donné que les lésions causent une humidifica-
tion irrégulière de la surface oculaire. À mesure que
la lésion se développe, une inflammation ou une
irritation récidivante ou l’apparition de la lésion
peuvent gêner le patient. Des troubles visuels peu-
vent apparaître en raison de l’astigmatisme causé par
le ptérygion ou d’une obstruction directe lorsque la
lésion couvre l’axe optique.
Options thérapeutiques pour le ptérygion
Le traitement symptomatique avec des lubrifiants
oculaires pour traiter la sécheresse des yeux est
habituellement suffisant au stade initial de la mala-
die. Le traitement chirurgical est indiqué lorsque la
lésion est importante, menace ou affecte l’axe visuel
ou cause un astigmatisme important, une irritation,
une rougeur, des larmoiements ou une douleur. La
gêne par le caractère inesthétique de la lésion est
une indication relative d’ablation.
La chirurgie actuelle du ptérygion varie de la
simple excision de la sclère nue à des techniques
chirurgicales plus complexes, telles que la kérato-
plastie lamellaire et la greffe de membrane amnio-
tique. La récidive du ptérygion après son excision
chirurgicale est l’unique cause la plus fréquente de
Ophtalmologie
Conférences scientifiques
3
les plus sensibles. Les rayonnements ionisants avec
le strontium-90 ont été utilisés à des doses allant de
1000 à 7000 cGy. Bien que les rayonnements bêta
soient utilisés depuis plus d’un demi siècle, les
études sur leur efficacité et leur innocuité sont
généralement insuffisantes, les périodes de suivi ne
sont pas suffisamment longues et il existe peu d’é-
tudes prospectives randomisées
31,32
. Cependant, la
plupart des études montrent que les taux de récidive
sont faibles, de l’ordre de 10 %.
On pense que les événements indésirables asso-
ciés à la chirurgie par les rayonnements bêta sont
fonction de la dose et comprennent des complica-
tions graves (p. ex. formation d’une cataracte secto-
rielle, atrophie de l’iris, nécrose de la sclère,
formation de plaques sclérales calcifiée
33,34
). Les com-
plications moins graves comprennent la conjonc-
tivite, la cicatrisation conjonctivale, la kératite, la
photophobie et la ptose. Étant donné les complica-
tions graves potentielles et l’existence d’autres straté-
gies thérapeutiques efficaces, l’utilisation conjointe
de rayonnements bêta n’est pas recommandée.
Mitomycine C (MMC) : La MMC est un antibiotique-
agent anticancéreux qui inhibe l’ADN, l’ARN et la
synthèse des protéines et a un effet à long terme sur
la prolifération cellulaire. La MMC a été utilisée
comme traitement d’appoint de la chirurgie du glau-
come et du ptérygion, où elle induit l’inhibition locali-
sée et prolongée des fibroblastes de la capsule de
Tenon. Cela réduit les tissus cicatriciels boursouflés
associés à la trabéculectomie et la récidive du ptéry-
gion. La MMC topique à 0,02 % a été utilisée après la
chirurgie du ptérygion deux fois par jour pendant 5
jours. Les effets indésirables de la MMC topique peu-
vent être associés à des complications importantes et
potentiellement menaçants pour la vision, com-
prenant l’iritis, l’avascularité limbique, la fusion de la
cornée (figures 4 et 5), la fusion de la sclère ou la for-
mation de plaques calcifiées, la décompensation
cornéenne, la perforation sclérale ou cornéenne, le
glaucome secondaire et la cataracte
25-38
.
Afin de réduire la toxicité et les complications
associées à l’utilisation de collyres de MMC,
plusieurs études recommandent maintenant une
seule application peropératoire de MMC (comme elle
est utilisée dans la chirurgie filtrante du glau-
come)
27,28,38,39
. Les taux de récidive signalés avec
l’application peropératoire de MMC varient de 3 % à
43 % et sont généralement comparables à ceux notés
avec les collyres de MMC. Des complications ont
également été signalées avec l’utilisation peropéra-
toire de MMC, comprenant la kératite épithéliale
ponctuée précoce, le chémosis, le retard dans la
guérison de la plaie conjonctivale et les granulomes
conjonctivaux. Un cas de fusion cornéenne après
l’application peropératoire de MMC a également été
rapporté
40,41
. Nous utilisons actuellement la MMC
pendant la période peropératoire uniquement pour
le ptérygion récidivant. On applique 0,02 mg/mL de
MMC avec une éponge chirurgicale Weck Cell pen-
dant 2 minutes. Le produit est ensuite rincé abon-
damment au moyen de 2 flacons de solution saline
équilibrée (20 mL chacun). Le site scléral nu est
ensuite fermé par une autogreffe conjonctivale.
Techniques de la greffe sur la surface oculaire
Étant donné que le ptérygion est considéré main-
tenant comme une forme localisée de pathologie de
la surface oculaire, des interventions au niveau de la
surface oculaire pour la chirurgie du ptérygion ont
été mises au point
42
. Afin de réparer la surface ocu-
laire à la suite d’une chirurgie du ptérygion, on
utilise les greffes suivantes :
• Autogreffe conjonctivale
• Autogreffe limbo-conjonctivale
• Greffe de membrane amniotique
Autogreffe conjonctivale
L’autogreffe conjonctivale est l’intervention de
choix pour le traitement du ptérygion primitif et est
4
Figures 4 et 5 : Fusion cornéo-sclérale
après l’excision du ptérygion avec l’aide de
la mitomycine-C
utilisée pendant la période peropératoire conjointe-
ment à 0,02 mg/mL de MMC pendant 2 minutes
dans les cas de ptérygion récidivant. C’est une inter-
vention relativement sûre et efficace qui sert d’étalon
par rapport auquel on se réfère pour toutes les inter-
ventions du ptérygion. Cette intervention fournit
souvent au patient un excellent résultat sur le plan
esthétique (figure 6).
L’intervention consiste à obtenir une autogreffe
conjonctivale libre (habituellement de la conjonctive
bulbaire supérieure temporale dans le cas d’un ptéry-
gion nasal) et à suturer la greffe sur le lit scléral nu
après l’excision du ptérygion. Cette intervention est
décrite en détail ultérieurement. Bien qu’elle soit très
répandue, elle est techniquement exigeante. Par
conséquent, on a rapporté des variations importantes
de son taux de succès, allant d’un taux aussi faible
que 2 % à un taux aussi élevé que 39 %
24
. Conjointe-
ment à la description de l’autogreffe conjonctivale,
on a décrit des modifications de cette technique,
comprenant l’autogreffe conjonctivale rotationnelle
et l’autogreffe conjonctivale annulaire
25
.
Autogreffe limbo-conjonctivale
Étant donné que l’on a suggéré qu’une déficience
des cellules souches limbiques est une cause étio-
logique du ptérygion, on a proposé l’autogreffe
limbique (appelée également autogreffe limbo-con-
jonctivale) comme modalité thérapeutique
13,42
. Cette
intervention est similaire à l’autogreffe conjonctivale
excepté que la limite limbique du greffon du don-
neur est prolongée pour inclure l’épithélium lim-
bique, soit par une kératectomie superficielle soit par
une dissection lamellaire superficielle. Ce côté du
greffon est ensuite placé sur le bord limbique du lit
scléral du receveur, afin d’assortir et de reconstruire
le limbe avec de l’épithélium contenant des cellules
souches. Malgré l’avantage théorique de l’autogreffe
limbique, il semble qu’elle n’entraîne pas une réduc-
tion significative du taux de récidive comparative-
ment à l’autogreffe conjonctivale conventionnelle.
Greffe de membrane amniotique
Il existe des rapports indiquant que la membrane
amniotique humaine préservée peut être utilisée
comme substrat de la membrane basale dans les
interventions de la surface de la cornée (p. ex.
chirurgie du ptérygion par allogreffe limbique)
44,45
.
Le recours à la greffe de membrane amniotique a
réduit la récidive du ptérygion. La membrane amnio-
tique permet de réduire la cicatrisation et la fibrose
associées à la chirurgie de la surface oculaire. Tout
récemment, on a également démontré qu’elle suppri-
mait la signalisation du TGF-ß dans les fibroblastes
de la conjonctive et du ptérygion
46,47
. Bien que moins
efficace que l’autogreffe conjonctivale pour prévenir
les récidives (14,8 % vs 4,8 % dans une étude com-
parative)
26
, l’intervention entraîne souvent d’excel-
lents résultats sur le plan esthétique. Elle offre
certains avantages par rapport à l’autogreffe conven-
tionnelle, car la conjonctive supérieure n’est pas utili-
sée et l’intervention est relativement simple à
réaliser. Les principaux désavantages sont le coût et
l’accessibilité de la greffe de membrane amniotique.
Autres traitements pour le ptérygion
En plus des interventions décrites ci-dessus,
d’autres modalités thérapeutiques d’ablation du
ptérygion méritent d’être mentionnées. Celles-ci
incluent la kératoplastie lamellaire, la kératectomie
photothérapeutique au laser Excimer et un nouveau
traitement pharmacologique pour le ptérygion utili-
sant un stéroïde angiostatique. On a encouragé
le recours à la kératoplastie lamellaire du fait que le
tissu lamellaire cornéen de l’allogreffe présente une
barrière limitant la progression du ptérygion. La
kératectomie photothérapeutique (PTK) a été utilisée
pour « lisser » le lit scléral et la surface cornéenne
après l’excision du ptérygion, afin de réduire le tissu
cicatriciel et les irrégularités de la surface qui
peuvent augmenter le risque de récidive
48
.
Technique chirurgicale : excision du
ptérygium avec autogreffe conjonctivale
L’intervention peut être réalisée en utilisant une
anesthésie topique et régionale dans une salle
d’opérations pour interventions mineures. De
Ophtalmologie
Conférences scientifiques
5
Figure 6 : Excision du ptérygion réussie avec
autogreffe conjonctivale 8 semaines
après la chirurgie
l’Ativan
MC
en
sublingual (1 mg) associé à la tétracaïne
topique 0,5% sont administrés au patient avant l’in-
tervention. Une dose supplémentaire de tétracaïne
est administrée pendant la période peropératoire, si
nécessaire. De la lidocaïne intralésionnelle à 2 %
avec de l’épinéphrine, injectées dans le lit du ptéry-
gion et le site du donneur pour l’autogreffe conjonc-
tivale sont très efficaces pour soulager la douleur du
patient durant l’intervention.
Si les mouvements oculaires présentent un pro-
blème, un fil de traction en soie de calibre 8-0 peut
être placé à travers la cornée supérieure pour posi-
tionner l’œil dans la direction nécessaire pendant
l’intervention et pour réduire les mouvements
involontaires de l’œil. Ensuite, la partie conjonctivale
du ptérygion est marquée avant l’intervention avec
un marqueur chirurgical.
Une lame Beaver 69 ou 57 est utilisée pour
réaliser une dissection lamellaire de la tête du ptéry-
gion, en vue de l’excision avasculaire complète de
tout le tissu du ptérygion jusqu’au niveau de la
membrane de Bowman (figure 7). Dans ce plan, la
chirurgie est remarquablement avasculaire jusqu’à
ce que l’on atteigne le système vasculaire limbique.
Des ciseaux mousses de Wescott sont utilisés pour
décoller la partie conjonctivale du ptérygion (figure
8). Une dissection à l’aide d’un instrument tranchant
est ensuite réalisée pour extraire le corps de ptéry-
gion. Une lame Beaver 69 ou une fraise égrisée est
utilisée pour polir le limbe, en s’assurant que tout
tissu fibrovasculaire résiduel du ptérygion est enlevé
et que la région limbique est lisse. Les gros vaisseaux
épiscléraux incisés durant l’intervention sont
cautérisés, si nécessaire. Les dimensions verticale et
horizontale du lit scléral nu sont mesurées avec un
calibre de Castrovejo.
Ensuite, on prélève l’autogreffe conjonctivale.
L’œil fait l’objet d’une rotation dans le quadrant nasal
inférieur et le greffon de taille appropriée est marqué
sur la conjonctive bulbaire temporale supérieure.
Des ciseaux mousses de Wescott sont utilisés pour
obtenir un greffon conjonctival mince n’incluant pas
le tissu de la capsule de Tenon (figure 9). Il faut
veiller à incorporer uniquement la conjonctive dans
ce greffon, en n’incluant pas le tissu de la capsule de
Tenon. Des pinces sans griffes sont utilisées pour
saisir la conjonctive, afin d’éviter de la percer ou de
la déchirer. Lors de la dissection du greffon conjonc-
tival du donneur, on doit voir l’extrémité des ciseaux
mousses de Wescott à travers la conjonctive pour
éviter de percer celle-ci. Avec ce type de dissection
conjonctivale atraumatique, la formation d’un granu-
lome postopératoire dans le site donneur est très rare
et il est habituellement possible de prélever à nou-
veau la conjonctive dans le même site à une date
ultérieure au cas où le ptérygion récidiverait.
6
Figure 9 : Dissection de la greffe conjonctivale
après que le marquage ait été effectué
Figure 7 : Dissection de la tête du ptérygion avec
une lame Beaver
Figure 8 : Dissection mousse du corps du
ptérygion avec des ciseaux de Wescott
Le greffon conjonctival du donneur doit être suf-
fisamment grand pour incorporer les marques
chirurgicales placées au préalable. Lorsque le greffon
conjonctival libre est disséqué, il fait l’objet d’une
rotation dans le lit scléral nu et l’on doit s’assurer
d’aligner le côté limbique du greffon prélevé avec le
limbe sur le site du receveur (c’est le seul côté qui
n’est pas marqué avec le marqueur chirurgical). On
réalise ensuite la suture du greffon sur le limbe par
points séparés à l’aide de trois fils de nylon 10-0. Des
sutures en boucle sont utilisées aux deux extrémités,
fixant la conjonctive du donneur et du receveur à
l’épisclère. Une suture en matelas est utilisée sur la
partie médiane pour éviter la rétraction de l’auto-
greffe conjonctivale. Les extrémités des fils de nylon
demeurent longues pour réduire l’irritation et ceux-
ci sont enlevés sous une lampe à fente 10 jours après
l’intervention. Le reste du greffon est fixé avec des
fils de Vicryl 10-0 ou 9-0, en utilisant plusieurs
sutures à points séparés ou une suture à points
continus (figure 10).
Conclusion
Un ptérygion est une pathologie relativement
fréquente. Parmi les divers facteurs de risque, l’expo-
sition aux rayons UV est la plus fréquente. Bien que
les symptômes au stade initial de la maladie puis-
sent être légers, ils peuvent être incapacitants pour
la vision aux stades ultérieurs. Il existe de nom-
breuses méthodes pour traiter cette pathologie, mais
certaines peuvent causer des complications graves
au niveau de la surface oculaire. L’excision suivie
d’une greffe conjonctivale est actuellement le traite-
ment de référence, en choisissant la bonne tech-
nique pour obtenir un bon résultat et un faible taux
subséquent de récidive. L’autogreffe conjonctivale
avec l’utilisation, pendant la période peropératoire,
de MMC 0,02 mg/mL pendant 2 minutes suivie
d’une irrigation importante est sûre et efficace pour
traiter le ptérygion récidivant.
Allan R. Slomoric, MA, M.D., FRCS(C) est directeur clinique du
Corneal/External Disease Service au Toronto Western Hospi-
tal, Réseau universitaire de santé et président de la
Cornea/External Disease and Refractive Society. Il est égale-
ment professeur agrégé d’ophtalmologie à l’Université de
Toronto.
Sao Bing Lee, M.D., était boursier spécialisé dans le domaine
des maladies de la cornée dans le Service d’ophtalmologie et
des sciences de la vision.
Références
1. Saw SM, Tan D. Pterygium: prevalence, demography and risk factors.
Ophthalmic Epidemiol 1999;6(3):219-28.
2. Moran DJ, Hollows FC. Pterygium and ultraviolet radiation: a positive
correlation. Br J Ophthalmol 1984;68:343-346.
3. Hill JC, Maske R. Pathogenesis of pterygium. Eye 1989;3:218-226.
4. Coroneo M. Pterygium as an early indicator of ultraviolet insolation:
a hypothesis. Br J Ophthalmol 1993;77:734-739.
5. Hirst LW. Distribution, risk factors, and epidemiology of pterygium.
In: Taylor HR, ed. Pterygium. The Netherlands: Kugler Publica-
tions;2000:15-28.
6. Cameron M. Ultra-violet radiation. In: Pterygium Throughout the
World. Springfield, IL:Thomas;1965;41-54.
7. Lippincott S, Blum H. Neoplasms and other lesions of the eye
induced by ultra-violet radiation in Strain A mice. J Natl Cancer Inst
1943;3:545-554.
8. Coroneo M. Albedo concentration in the anterior eye: a phenomenon
that locates some solar diseases. Ophthalmic Surg 1990;20:60-6.
9. Zhang J-D. An investigation of aetiology and heredity of pterygium.
Report of 11 cases in a family. Acta Ophthalmologica 1987;65:413-
416.
10. Hilgers JHCh. Pterygium: Its incidence, heredity and etiology. Am J
Ophthalmol 1960;635-644.
11. Pinkerton OD, Hokama Y, Shigemura LA. Immunologic basis for the
pathogenesis of pterygium. Am J Ophthalmol 1984;98:225-228.
12. Tseng SCG, Lee S-B, Li D-Q. Limbal stem cell deficiency in the patho-
genesis of pterygium. In: Taylor HR, ed. Pterygium The Netherlands:
Kugler Publications; 2000:41-56.
13. Wong WW. A hypothesis on the pathogenesis of pterygiums. Ann
Ophthalmol 1978;10:303-309.
14. Goldberg L, David R. Pterygium and its relationship to the dry eye in
the Bantu. Br J Ophthalmol 1976;60:721-731.
15. Biedner B, Biger Y, Roghkoff L. Pterygium and basic tear secretion.
Ann Ophthalmol 1979;II:1235.
16. Dimitry T. The dust factor in the production of pterygium. Am J Oph-
thalmol 1937;20:40-45.
17. Varinli S, Varinli I, Erkisi M, Doran F. Human papillomavirus in ptery-
gium. Central Afr J Med 1994;40:24-26.
18. Youngson RM. Recurrence of pterygium after excision. Br J Ophthal-
mol 1972;56:120-125.
19. Austin P, Jakobiec FA, Iwamoto T. Elastodysplasia and elastodystro-
phy as the pathologic bases of ocular pterygia and pinguecula. Oph-
thalmology 1983;90(1):96-109.
20. Clear AS, Chirambo MC, Hutt MSR. Solar keratosis, pterygium and
squamous cell carcinoma of the conjunctiva in Malawi. Br J Ophthal-
mol 1979;63:102-109.
21. Greenblatt MS, Bennett W, Hollstein M, Harris CC. Mutations in the
p53 tumor suppressor gene: Clues to cancer etiology and molecular
pathogenesis. Cancer Research 1994;54:4855-4878.
Ophtalmologie
Conférences scientifiques
7
Figure 10 : Fin de la chirurgie avec les sutures
en place
43. Tan DTH, Chee SP, Dear KBG, Lim ASM. Effect of pterygium mor-
phology on pterygium recurrence in a controlled trial comparing
conjunctival autografting with bare sclera excision. Arch Ophthalmol
1997;115:1235-1240.
44. Shimazaki J, Shinozaki N, Tsubota K. Transplantation of amniotic
membrane and limbal autograft for patients with recurrent ptery-
gium associated with symblepharon. Br J Ophthalmol 1998;82:235-
240.
45. Lee S, Tseng S. Amniotic membrane transplantation for persistent
epithelial defects with ulceration. Am J Ophthalmol 1997;123:303-
312.
46. Shimazaki J, Yang H-Y, Tsubota K. Amniotic membrane transplanta-
tion for ocular surface reconstruction in patients with chemical and
thermal burns. Ophthalmology 1997;104(12): 2068-2076.
47.Tseng SCG, Prabhasawat P, Barton K, Gray T, Meller D. Amniotic
membrane transplantation with or without limbal allografts for
corneal surface reconstruction in patients with limbal stem cell defi-
ciency. Arch Ophthalmol 1998;116:431-441.
48.Talu H, Tasindi E, Ciftci F, Yildiz TF. Excimer laser phototherapeutic
keratectomy for recurrent pterygium. J Cataract Refract Surg
1998;24:1326-1332.
Réunion scientifique à venir
16 au 19 novembre 2004
Réunion annuelle de
l’American Academy of Ophthalmology
Nouvelle-Orléans, Louisianne
Renseignements : Tél. : 415-561-8500
Fax : 415-561-8533
Courriel :
Evénements futurs dans le département
3 au 4 décembre 2004
Walter Wright Day « Ocular Emergencies »
Coordinateur – Dr Dan DeAngelis
Note : Adresse du site du Programme pour les professeurs
invités (PPI) : Toronto Western Hospital, West Wing, Room
2-401, 399 Bathurst Street, Toronto
En septembre 2004, le PPI aura lieu à l’Hôpital St Michael,
30 Bond Street, Toronto – Paul Marshall Lecture Theatre,
B1-Queen, entrée Queen Street (près du Second Cup).
22. King JH. The pterygium - Brief review and evaluation of certain
methods of treatment. Arch Ophthalmol 1950;44:854-869.
23. Jap A, Chan C, Lim L, Tan DTH. Conjunctival rotation autograft for
pterygium. Ophthalmology 1999;106:1:67-71.
24. Chen PP, Ariyasu RG, Kaza V, LaBree LD, McDonnell PJ. A random-
ized trial comparing mitomycin C and conjunctival autograft after
excision of primary pterygium. Am J Ophthalmol 1995;120.2:151-
160.
25. Lewallen S. A randomized trial of conjunctival autografting for ptery-
gium in the tropics. Ophthalmology 1989;96(11):1612-1614.
26. Prabhasawat P, Barton K, Burkett G, Tseng SCG. Comparison of con-
junctival autografts, amniotic membrane grafts, and primary closure
for pterygium excision. Ophthalmology 1997;104(6):974-985.
27. Cardillo JA, Alves MR, Ambrosio LE, Poterio MB, Jose NK. Single
intraoperative application versus postoperative mitomycin C eye
drops in pterygium surgery. Ophthalmology 1995;102(12): 1949-
1952.
28.Yanyali AC, Talu H, Alp BN, Karabas L, Ay GM, Caglar Y. Intra-opera-
tive mitomycin C in the treatment of pterygium. Cornea 2000;19:
471-473.
29.Twelker JD, Bailey IL, Mannis MJ, Satatiano WA. Evaluating ptery-
gium severity – a survey of corneal specialists. Cornea 2000;19:292-
296.
30. Snibson GR, Luu CD, Taylor HR. Pterygium surgery in Victoria: a sur-
vey of ophthalmologists. Aust NZ J Ophthalmol 1998; 26:271-276.
31. Sebban A, Hirst LW. Treatment of pterygia in Queensland. Aust NZ J
Ophthalmol 1991;19(2):123-127.
32. Snibson GR. An evidence-based appraisal of treatment options. In:
Taylor HR, ed. Pterygium. The Netherlands: Kugler Publications;
2000:125-140.
33. MacKenzie FD, Hirst LW, Kynaston B, Bain C. Recurrence rate and
complications after beta irradiation for pterygia. Ophthalmology
1991:98(12):1776-1781.
34. Moriarty AP, Crawford GJ, McAllister IL, Constable IJ. Severe cor-
neoscleral infection: a complication of beta irradiation scleral necro-
sis following pterygium excision. Arch Ophthalmol 1993;
111:947-951.
35. Rubinfeld RS, Pfister RR, Stein RM, et al. Serious complications of top-
ical mitomycin-c after pterygium surgery. Ophthalmology 1992;
99(11):1647-1654.
36. Dunn JP, Seamone CD, Ostler HB, Nickel BL, Beallo A. Development
of scleral ulceration and calcification after pterygium excision and
mitomycin therapy. Am J Ophthalmol 1991;112(3): 343-344.
37. Lin C-P, Shih M-H, Tsai M-C. Clinical experiences of infectious scleral
ulceration: A complication of pterygium operation. Br J Ophthalmol
1997;81:980-983.
38. Frucht-Pery J, Siganos CS, Ilsar M. Intraoperative application of topi-
cal mitomycin C for pterygium surgery. Ophthalmology 1996;103(4):
674-677.
39.Potério MB, Alves MR, Cardillo JA, José NK. An improved surgical
technique for pterygium excision with intraoperative application of
mitomycin-C. Ophthalmic Surg Lasers 1998;29:685-687.
40. Dougherty PJ, Hardten DR, Lindstrom RL. Corneoscleral melt after
pterygium surgery using a single intraoperative application of mito-
mycin-C. Cornea 1996;15:537-540.
41. Helal M, Messiha N, Amayem A, El-Maghraby A, Elsherif Z, Dabees
M. Intraoperative mitomycin C versus postoperative mitomycin C for
the treatment of pterygium. Ophthalmic Surg Lasers 1996;27:674-678.
42. Holland EJ, Schwartz GS. The evolution of epithelial transplantation
for severe ocular surface disease and a proposed classification sys-
tem. Cornea 1996;15:549-556.
© 2004 Département d’ophtalmologie et des sciences de la vision, Faculté de médecine, Université de Toronto, seul responsable du contenu de cette publication. Édition : SNELL Communication
Médicale Inc. avec la collaboration du Département d’ophtalmologie et des sciences de la vision, Faculté de médecine, Université de Toronto.
MD
Ophtalmologie – Conférences scientifiques est une marque
de commerce de SNELL Communication Médicale Inc.Tous droits réservés. L’administration d’un traitement thérapeutique décrit ou mentionné dans Ophtalmologie – Conférences scientifiques doit
toujours être conforme aux renseignements d’ordonnance approuvés au Canada. SNELL Communication Médicale se consacre à l’avancement de l’éducation médicale continue de niveau supérieur.
L’élaboration de cette publication a bénéficié d’une subvention à l’éducation de
Novartis Ophthalmics
130-010F
La version française a été révisée par le professeur Pierre Lachapelle,
Montréal.
Les avis de changement d’adresse et les demandes d’abonne-
ment pour Ophtalmologie – Conférences Scientifiques doivent
être envoyés par la poste à l’adresse C.P. 310, Succursale H,
Montréal (Québec) H3G 2K8 ou par fax au (514) 932-5114 ou
par courrier électronique à l’adresse
Veuillez vous référer au bulletin Ophtalmologie – Conférences
Scientifiques dans votre correspondence. Les envois non
distribuables doivent être envoyés à l’adresse ci-dessus.
Poste-publications #40032303
SNELL
Ophtalmologie
Conférences scientifiques
OCTOBRE 2004
Volume 2, numéro 8
COMPTE RENDU DES CONFÉRENCES
SCIENTIFIQUES DU DÉPARTEMENT
D’OPHTALMOLOGIE ET
DES SCIENCES DE LA VISION,
FACULTÉ DE MÉDECINE,
UNIVERSITÉ DE TORONTO
Département d’ophtalmologie
et des sciences de la vision
Faculté de médecine
Université de Toronto
60 Murray St.
Bureau 1-003
Toronto (Ontario) M5G 1X5
Le contenu rédactionnel d’Ophtalmologie –
Conférences scientifiques est déterminé
exclusivement par le Département
d’ophtalmologie et des sciences de la vision,
Faculté de médicine, Université de Toronto.
Département d’ophtalmologie
et des sciences de la vision
Jeffrey Jay Hurwitz, M.D., Rédacteur
Professeur et président
Martin Steinbach, Ph.D.
Directeur de la recherche
The Hospital for Sick Children
Elise Heon, M.D.
Ophtalmologiste en chef
Mount Sinai Hospital
Jeffrey J. Hurwitz, M.D.
Ophtalmologiste en chef
Princess Margaret Hospital
(Clinique des tumeurs oculaires)
E. Rand Simpson, M.D.
Directeur, Service d’oncologie oculaire
St. Michael’s Hospital
Alan Berger, M.D.
Ophtalmologiste en chef
Sunnybrook and Women’s College
Health Sciences Centre
William S. Dixon, M.D.
Ophtalmologiste en chef
The Toronto Hospital
(Toronto Western Division and
Toronto General Division)
Robert G. Devenyi, M.D.
Ophtalmologiste en chef
Les dystrophies cornéennes vues
d’une perspective génétique
PAR ELISE
HÉON, M.D., FRCSC
Les dystrophies cornéennes représentent un groupe de maladies de la cornée qui sont
génétiquement déterminées. Elles ont été traditionnellement classifiées et décrites selon la
couche de la cornée atteinte et les modifications pathologiques observées, respectivement. Il est
maintenant connu que cette classification ne reflète pas la pathologie biologique sous-jacente
ou les anomalies génétiques en cause. La plupart des dystrophies cornéennes se transmettent
selon le mode autosomique dominant ou récessif, avec des degrés variables de gravité clinique
et de pénétrance. Cependant, dans certains cas (p. ex. le kératocône), le type de transmission
héréditaire n’est pas toujours évident et est considéré comme « complexe ». L’âge d’apparition
de la maladie est variable et ne reflète pas l’anomalie pathogénique sous-jacente. Nos connais-
sances sur les dystrophies cornéennes ont été révolutionnées depuis la découverte que plus de
12 chromosomes sont associés à ces maladies et l’identification de mutations dans au moins 14
gènes (si l’on inclut la dysgénésie du segment antérieur dans ce groupe de maladies). Cepen-
dant, pour plusieurs dystrophies, aucun gène ou site génétique (locus) responsable n’a été iden-
tifié et d’autres études génétiques sont donc nécessaires. Les nouvelles découvertes
moléculaires remettent en question les connaissances traditionnelles sur ces maladies qui
étaient généralement fondées sur les observations histopathologiques. L’élucidation des
mécanismes biochimiques sous-jacents permettra peut-être à l’avenir de moduler ces phéno-
types. Dans ce numéro d’Ophtalmologie – Conférences scientifiques, nous présentons de nouvelles
informations moléculaires sur les dystrophies cornéennes les plus courantes (tableau 1). Pour
une revue clinique et historique plus complète des dystrophies cornéennes, nous encourageons
le lecteur à se référer à des textes classiques
1-3
. Afin que le lecteur apprécie de façon optimale la
portée de ces nouvelles connaissances, nous lui présentons également un bref rappel du
développement de la cornée.
Développement, structure et fonction
La cornée est composée de 6 couches concentriques qui se forment pendant la période entre
la 5
e
et la 6
e
semaine de grossesse. L’épithélium extérieur est ancré à une membrane basale, sur la
membrane de Bowman acellulaire située sur la face antérieure du stroma. On pense que les com-
posants de la membrane de Bowman sont synthétisés et sécrétés par les cellules épithéliales et les
kératocytes du stroma. Le stroma cornéen postérieur est recouvert de la membrane de Descemet com-
posée de fibres collagènes, qui est sécrétée et recouverte par une monocouche de cellules
endothéliales. Ces cellules jouent un rôle important dans le passage des nutriments de l’humeur
aqueuse dans la cornée et sont responsables du maintien du taux relativement faible d’hydratation du
stroma par l’activation des pompes ioniques dans la membrane plasmatique des cellules endothéliales.
La cornée adulte a un diamètre moyen de 12,6 mm horizontalement et de 11,7 mm verticale-
ment. On définit généralement la microcornée par un diamètre cornéen horizontal inférieur à
11 mm
4,5
. Au centre, l’épaisseur est de 0,52 mm, celle-ci augmentant vers la périphérie. La résis-
tance à la rupture et la transparence de la cornée entraînent une forte interaction entre une série
complexe de protéines et de filaments. Les principaux types de filaments cytoplasmiques sont la
kératine (filaments intermédiaires), l’actine et les microtubules, la kératine étant prédominante. Le
stroma représente 90 % de l’épaisseur de la cornée et consiste en des fibrilles de collagène
extrêmement uniformes (22,5 à 32 mm de diamètre), qui sont principalement des réseaux réticu-
laires de microfibrilles formant le collagène de type I, III, V, VI, XII et XIV entre lesquelles se trou-
vent des kératocytes
6
. Les kératocytes sécrètent la matrice extracellulaire autour du collagène
consistant en des protéoglycanes acides à charge négative, avec une prédominance de kératane
sulfate et de dermatane sulfate
6,7
. Les protéoglycanes jouent un rôle dans le maintien de l’espace-
ment régulier des fibrilles de collagène. Les principales fonctions du stroma sont de maintenir la
courbure appropriée de la cornée, de fournir une résistance mécanique à la pression intraoculaire
et de transmettre la lumière dans l’œil sans absorbance importante. La membrane de Descemet
MC
Département
d’ophtalmologie et des
sciences de la vision
FACULTY OF MEDICINE
University of Toronto
Disponible sur Internet à :
www.ophtalmologieconferences.ca
adulte contient de la fibronectine, de la laminine, du col-
lagène de type IV et de type VIII, de l’héparane sulfate et un
protéoglycane dermatane sulfate
6
.
Les dystrophies
Les informations moléculaires dont nous disposons
depuis peu sur les dystrophies cornéennes démontrent que
les dystrophies touchant différentes couches de la cornée
qui subissent des changements histopathologiques dis-
tincts peuvent avoir une base génétique commune.
Dystrophie cornéenne de Reis-Bückler
(« géographique »), CDBI (OMIM121900)
La dystrophie cornéenne de Reis-Bückler est une mal-
adie à transmission autosomique dominante caractérisée
par une pénétrance complète, mais une gravité variable.
Cette affection apparaît généralement durant la première
décennie de la vie, avec des formes variables d’opacités
réticulaires blanc-grisâtres au niveau de la membrane de
Bowman et une apparence de verre dépoli dans les zones
limitrophes (figure 1). Toute la cornée est atteinte, mais elle
est la plus dense dans la région centrale. Des irrégularités
sur la surface cornéenne peuvent entraîner des érosions
cornéennes récidivantes avec une sensibilité cornéenne
réduite. Les épisodes récidivants de photophobie et l’irrita-
tion deviennent moins fréquents avec l’âge. Cependant, il
se produit une baisse progressive de l’acuité visuelle due à
des opacités cornéennes secondaires. Le traitement consiste
en un débridement, en une kératectomie superficielle ou en
une kératectomie photothérapeutique
8
. En cas d’atteinte
sévère, une kératoplastie lamellaire ou transfixiante peut
être indiquée, mais il peut se produire une récidive précoce
dans le greffon. La membrane de Bowman opacifiée est
remplacée par un fragment éosinophilique PAS-positif
(Masson) stratifié se projetant dans l’épithélium et le stroma
antérieur
9
, mais n’impliquant pas la membrane basale
épithéliale. Au microscope électronique (MÉ), on observe
des microfibrilles tubulaires qui sont des corps en forme de
croissant ou allongés intercalés entre les fibrilles de
collagène dans la membrane de Bowman. Dans cette
maladie, des mutations du gène TGFBI ou bIGH3 (trans-
forming growth factor, beta-induced) (OMIM 601692) ont
été identifiées sur le chromosome 5q31
10
. Malgré une
importante hétérogénéité allélique (> 1 mutation dans
le même gène), de fortes corrélations phénotype-génotype
sont observées pour des mutations telles que R124L qui est
spécifique au phénotype de la dystrophie de Reis-Bückler.
Différentes mutations dans le gène TGFBI peuvent
également causer la dystrophie cornéenne granulaire de
type I (DCGI), la DCGII et la DCGIII, la dystrophie
cornéenne grillagée de type I (DCGI), la DCGIIIa, la
DCGI/DCGIII de type intermédiaire et la DCG-stroma pro-
fond ainsi que la dystrophie de Thiel-Behnke
11
(voir ci-
dessous). Les mutations impliquent les dinucléotides CpG.
Le gène TGFbI est exprimé dans les kératocytes et code
pour la kératoépithéline, une protéine formée de 683 acides
aminés hautement conservée. Cette protéine contient un
signal sécrétoire N-terminal, 4 domaines d’homologie
interne, et un motif arg-gly-asp (RGD) à l’extrémité C-termi-
nale, qui est présent dans de nombreuses protéines de la
matrice extracellulaire. Le motif RGD module l’adhésion
cellulaire et agit comme une séquence de reconnaissance
pour sa liaison à l’intégrine. Les mutations de ce gène
entraînent l’accumulation progressive de dépôts cornéens
qui contiennent de la kératoépithéline. L’agrégation d’iso-
formes anormaux de la kératoépithéline est associée aux
dépôts amyloïdes et autres dépôts non fibrillaires selon le
site et la nature de la mutation.
Dystrophie « en nid d’abeille »/dystrophie de
Thiel-Behnke (CDBII) (OMIM 602082)
Cette dystrophie à transmission autosomique domi-
nante se manifeste généralement durant la deuxième
décennie avec des opacités subépithéliales au centre
ressemblant à des nids d’abeilles avec une cornée transpar-
ente à la périphérie. Des érosions cornéennes récidivantes
peuvent se manifester jusqu’à la 4
e
à la 6
e
décennie. La
baisse secondaire de l’acuité visuelle peut progresser à
20/100. Cependant, la surface cornéenne est habituelle-
ment lisse et la sensibilité cornéenne est normale. Toutefois,
la membrane basale épithéliale et la membrane de Bowman
peuvent être focalement absentes. Les fibres de collagène
spiralées observées au microscope électronique (MÉ) corres-
pondent aux dépôts fibrocellulaires épithéliaux et subép-
ithéliaux irréguliers PAS-positifs. Une kératectomie
superficielle ou une kératoplastie lamellaire ou transfixi-
ante peut être indiquée. Cette maladie peut récidiver dans
le greffon, mais plus tardivement que dans la dystrophie
cornéenne de Behnke de type I.
Ce phénotype de « dystrophie en nid d’abeille » est
génétiquement hétérogène avec des mutations R555Q dans
le gène TGFBI, alors que pour certaines familles, on a établi
un lien avec le chromosome 10q24
12
pour lequel le gène n’a
pas encore été identifié.
Dystrophie granulaire (Groenouw type 1)
(OMIM 121900)
Cette dystrophie à transmission autosomique domi-
nante est caractérisée par une pénétrance complète et une
gravité clinique variable. Les signes commencent à se man-
ifester durant la première et la deuxième décennie avec
l’apparition d’opacités granulaires blanches discrètes au
centre de la cornée dans le stroma antérieur, qui peuvent
ressembler à des miettes de pain, avec un stroma par
ailleurs transparent (figure 2). Avec le temps, les opacités
augmentent en nombre, en taille et en profondeur. La
cornée périphérique demeure transparente, alors que le
reste de la cornée présente un aspect de verre dépoli.
La cornée périphérique demeure transparente, alors que la
cornée intermédiaire prend l’apparence de verre dépoli.
Des irrégularités à la surface peuvent apparaître et entraî-
nent parfois des érosions cornéennes et une douleur
intense. L’acuité visuelle diminue progressivement en rai-
son des cicatrices et de l’augmentation de la densité des
dépôts, habituellement durant la quatrième ou la
cinquième décennie. Une kératoplastie lamellaire ou
Figure 1 : phénotypes liés à bIGH3 ; exemple de
dystrophie cornéenne de Reis-Bückler mise en
évidence à la lampe à fente
lagées sont moins nombreuses que dans le cas de la DCGI
et ont une orientation plus radiale en périphérie, le centre
étant relativement épargné. On note une sensibilité
cornéenne réduite et des érosions épithéliales récidivantes
après l’âge de 40 ans, avec la présence éventuelle de cicatri-
ces réduisant l’acuité visuelle. Une sécheresse oculaire, une
douleur et des larmoiements sont associés aux érosions.
Dans l’ensemble, les symptômes sont moins sévères que
ceux observés dans la DCGI. Des signes systémiques sont
présents et comprennent la peau flasque, la neuropathie
périphérique et la cardiomyopathie.
La formation de tissu cicatriciel subépithélial est asso-
ciée à la présence de matière amyloïde linéaire sous la mem-
brane de Bowman, dans le stroma antérieur et dans le
stroma moyen
13
. Les fibrilles amyloïdes correspondent à un
produit de dégradation interne de la gelsoline, entraînant la
perte progressive des nerfs sensoriels de la cornée et une
diminution de la sensibilité de la cornée, de la peau et des
nerfs crâniens principalement. La DCGII est liée au chromo-
some 9q34 et le résidu D187 du gène de la gelsoline (GSN)
(OMIM 137350) représente un point chaud au niveau
duquel des mutations causant la maladie se produisent
(D87N, D187Y). Le gène GSN est largement exprimé et code
pour une protéine de modulation des filaments d’actine (sec-
tionnement et coiffage)
14
, qui exerce son action en présence
de calcium submicromolaire. La protéine amyloïde dans le
type finlandais est un fragment de région de liaison au fila-
ment d’actine d’une variante de la molécule de gelsoline
15,16
.
Dystrophie cornéenne d’Avellino (DCA)
La DCA se transmet suivant le mode autosomique
dominant. Elle est caractérisée par une pénétrance com-
plète et montre une expressivité extrêmement variable. Elle
se manifeste durant la deuxième décennie par des dépôts
granulaires et amyloïdes avec ramifications linéaires dans le
stroma. Les opacités granulaires apparaissent plus tôt que
les dépôts myéloïdes et sont plus superficielles (figure 3).
L’opacification progressive de l’axe visuel central par des
dépôts peut suffisamment diminuer l’acuité visuelle pour
nécessiter une kératectomie photothérapeutique ou une
kératoplastie transfixiante. Les dépôts granulaires subépi-
théliaux à midstromaux se colorent au trichrome de Mas-
son. Les dépôts fibrillaires ou fusiformes dans le stroma
profond contenant de l’amyloïde se colorent au rouge
Congo (biréfringents)
17,18
. La mutation R124H dans le gène
TGFbI est spécifique à cette maladie
11
.
Dystrophie maculaire
(DCMI (OMIM 217800), DCMIa, DCMII)
La dystrophie maculaire est examinée ici, non pas parce
qu’elle est fréquente, mais parce que les découvertes géné-
tiques récentes la concernant (tel que ci-dessus) sont
intéressantes. Les différents sous-types de dystrophie macu-
laire sont génétiquement et biochimiquement déterminés.
Ils se transmettent suivant le mode autosomique récessif et
apparaissent durant la première décennie de la vie. Il n’ex-
iste pas de variabilité importante dans le phénotype. Au
début de la maladie, les fines opacités ont des limites indis-
tinctes, débutant axialement dans le stroma superficiel. Le
stroma limitrophe présente un aspect de verre dépoli.
Ultérieurement, les opacités s’étendent en périphérie et en
profondeur dans le stroma et la surface cornéenne devient
irrégulière avec une sensibilité cornéenne réduite et finale-
ment, un amincissement de la cornée. L’irritation et la
diminution progressive de l’acuité visuelle peuvent devenir
sévères à la troisième décennie et nécessiter une greffe
transfixiante peut être nécessaire, mais des récidives peu-
vent survenir de façon précoce.
Les dépôts décrits comme « hyalins » se colorent en
rouge vif avec le trichrome de Masson. Au MÉ, les dépôts de
forme allongée et trapézoïde s’étendent dans les couches
plus postérieures. Les mutations dans le gène TGFBI mon-
trent de fortes corrélations phénotype-génotype. R555W est
de tout évidence un point chaud, mais on a identifié égale-
ment R124S chez ces patients
10,11
.
Dystrophie cornéenne grillagée
Divers sous-types de dystrophie cornéenne grillagée
ont été distingués sur la base de leur gravité clinique et de
la présence de signes systémiques associés. Ces distinctions
sont maintenant génétiquement déterminées
10,11
.
Dystrophie cornéenne grillagée de type I DCGI
(OMIM 122200)
La DCG1 est une maladie à transmission autosomique
dominante caractérisée par une pénétrance complète et une
variabilité phénotypique. Elle se manifeste généralement
durant la première décennie avec l’apparition de points
blancs sub-épithéliaux antérieurs et des dépôts amyloïdes
linéaires filamenteux réfractiles avec ou sans nodules dans
le stroma. Par la suite, les lignes filamenteuses s’épaississent
avec une orientation radiale et deviennent plus profondes
dans le stroma. L’opacification progressive dans l’axe visuel
central entraîne la formation d’un flou dans le stroma limi-
trophe. Des érosions récidivantes fréquentes peuvent se
présenter à un jeune âge et on peut les traiter avec un lubri-
fiant oculaire topique, un pansement occlusif ou des verres
de contact thérapeutiques. En présence de cicatrices, une
kératectomie photothérapeutique et une kératoplastie trans-
fixiante peuvent améliorer la vision, mais des récidives dans
la cornée greffée sont fréquentes.
Au microscope optique, l’épithélium est irrégulier avec
une membrane basale épaissie et une membrane de Bow-
man fragmentée. Des dépôts fibrillaires dans les couches
stromales antérieures s’étendent postérieurement, se colo-
rent intensément avec le rouge Congo et montrent une
biréfringence et un dichroïsme. Les mutations R124C dans
le gène TGFBI sont spécifiques à la maladie
11
.
Dystrophie cornéenne grillagée de type II DCG II
(Amyloïdose familiale, syndrome de Meretoja, type
finlandais, OMIM 105120)
Cette dystrophie rare, se transmettant suivant le mode
autosomique dominant, se manifeste à l’âge de jeune adulte
et présente des signes systémiques contrairement à d’autres
formes de dystrophie grillagée. Les lignes cornéennes gril-
Figure 2 : phénotypes liés à bIGH3 ; exemple de
dystrophie cornéenne granulaire mise en évidence à
la lampe à fente
cornéenne qui donne de bons résultats. L’accumula-
tion caractéristique des glycosaminoglycanes (GAG) se
colore au bleu Alcian et au fer colloïdal.
La DCMI est caractérisée par l’absence de sulfata-
tion des chaînes de kératane (SCK) dans la cornée et le
cartilage et par une SCK non appréciable dans le
sérum. Cependant, dans la DCMII, le kératane sulfate
sérique et cornéen est détectable et peut être réduit,
mais son taux est souvent normal. Le gène CHST6
(OMIM 603797) dont les mutations causent la DCM a
été identifié sur le chromosome 16q22. Le gène CHST6
code pour le carbohydrate sulfotransférase
19
, qui est
exprimé dans la cornée et également dans la trachée et
la colonne vertébrale. Le produit génique – N-acétyl-
glucosamine-6-sulfotransférase (C-G1cNAc6ST) – ini-
tie la sulfatation du kératane sulfate dans la cornée
20
.
La DCMI est due à des mutations (mutation faux-sens,
délétion, insertions, décalage du cadre de lecture) dans
les régions codantes de CHST6
19,21
. Celles-ci entraînent
la synthèse d’une enzyme inactive avec la synthèse et
la sécrétion de protéoglycanes remplacés par la poly-
lactosamine et non par le kératane sulfate. Les porteurs
de la maladie sont nombreux en Islande
20
.
On observe la DCMIa dans des familles d’Arabie
Saoudite chez qui le kératane sulfate est absent dans le
stroma cornéen et le sérum, mais présent dans les
kératocytes. Les changements génétiques dans la DCM
II impliquent des délétions/réarrangements des
régions en aval de CHST6 qui contiendraient des élé-
ments régulateurs du gène. Ces changements affectent
la transcription de CHST6
19
et réduisent la sulfatation,
ce qui entraîne la terminaison prématurée de la chaîne
de kératane sulfate
20
.
Dans la DCMI et II, on note une accumulation
d’autres GAG (chondroïtine/dermatane-sulfate/
hyaluron). Par conséquent, l’opacité cornéenne peut
être due non seulement à un manque de SCK, mais
également au dépôt d’autres GAG qui peuvent
entraver l’arrangement des fibrilles de collagène
20
. Il
est important de noter que les phénotypes de la DCMI
(absence systémique de SCK) et II (SCK détectables
mais réduits dans la cornée et le sérum) peuvent être
présents dans la même famille
19,22
. Dans ces cas,
lorsqu’un individu possède les deux types de muta-
tion, le génotype de la DCMII est dominant par
rapport à la DCMI si un hétérozygote composé pos-
sède une mutation codante et une mutation du gène
en aval.
Dystrophie polymorphe postérieure (DPP)
(OMIM 122000, 120252, 605020)
Cette dystrophie transmise suivant le mode auto-
somique dominant a une expression variable et l’âge
de son apparition est variable. Bien que la DPP se
déclare généralement à l’âge adulte (figure 4a), elle
peut se déclarer sous une forme sévère à la naissance
(figure 4b). Les changements consistent en un degré
variable de lésions endothéliales vésiculaires et/ou d’é-
paississement de la membrane basale qui peuvent être
localisés ou plus diffus et associés à un œdème
cornéen. La baisse de l’acuité visuelle n’est habituelle-
ment pas importante, mais elle est extrêmement varia-
ble. L’œdème cornéen peut se développer à un degré
nécessitant une greffe cornéenne. Il y a également un
risque accru de glaucome et de kératocône
23
.
Initialement, la couche antérieure en bande anor-
male de la membrane de Descemet est revêtue d’une
couche de collagène anormale sur sa face postér-
ieure. On observe des couches multiples de cellules
endothéliales en périphérie avec une métaplasie et
une épithélialisation des cellules endothéliales
24,25
.
On note une mosaïque variable et imprévisible de
cellules endothéliales en couches multiples, dystro-
phiques et mieux préservées en présence ou en l’ab-
sence de composants normaux de la membrane de
Descemet.
La DPP est génétiquement hétérogène avec des
mutations identifiées dans le gène VSX-1 (chromo-
some 20p11.2-20q11.2)
26,27
et le gène COL8A2 (chro-
mosome 1p34.3-p32)
28
. Les données suggèrent que la
DPP liée au chromosome 20 est une variante allélique
du kératocône. VSX1 semble jouer un rôle dans envi-
ron 9 % des cas de DPP et dans 4,7 % des cas de kéra-
tocône. La DPP liée au chromosome 1 est également
une variante allélique de la dystrophie endothéliale de
Fuchs. Col8A2 pourrait jouer un rôle dans environ
6% des cas de DPP. Le rôle de Col8A2 dans le kéra-
tocône n’a pas encore été démontré. Des changements
dans VSX1 ont également été associés à une atténua-
tion asymptomatique de la fonction des cônes bipo-
laires dans la rétine
27
.
Ophtalmologie
Conférences scientifiques
Figure 3 : Phénotypes liés à bIGH3 ; exemple de
dystrophie cornéenne grillagée mise en évidence
à la lampe à fente
Figure 4 : Dystrophie polymorphe postérieure
(DPP)
A) Photographie d’un cas léger de DPP montrant
le signe particulier d’une « trace d’escargot »
à la lampe à fente
B) Photographie d’un cas plus grave de DPP
montrant une opacification cornéenne à la
lampe à fente
AB
Dystrophie endothéliale de Fuchs
(OMIM 136800)
La dystrophie endothéliale de Fuchs (DCEF) est
l’affection primaire de l’endothélium cornéen la plus
fréquente et peut être sporadique ou à transmission
autosomique dominante
29
avec une expression vari-
able. Les signes et les symptômes apparaissent
habituellement à partir de la quarantaine avec une
cornea guttata centrale, de petites protrusions ressem-
blant à des verrues de la membrane de Descemet, une
apparence en métal battu évoluant vers des plis au
niveau du stroma, un œdème cornéen et un polymé-
gatisme endothélial. Ultérieurement, la baisse de
l’acuité visuelle peut être significative et douloureuse
en raison de la décompensation cornéenne. La kérato-
plastie transfixiante dans les cas de DCEF représente
jusqu’à 19 % des greffes cornéennes avec un taux de
succès de plus de 90 % chez ces patients.
Chez certaines familles affectées par la DCEF, on a
effectué la cartographie du chromosome 1p34.3-p32,
dans lequel on a identifié des mutations du gène
COL8A2 (3,4 %)
28
. La sous-unité alpha-2 du collagène
de type VIII appartient à la famille des protéines de la
matrice extracellulaire
30
et contient une séquence
importante d’ADN répétée formant une triple hélice,
une région riche en proline qui est un site d’hydroxyla-
tion. Les mutations dans le domaine de la triple hélice
entravent théoriquement la stabilité de l’assemblée
supramoléculaire
28
et ont été associées à la DPP (env. 6
%) et à la DCEF (env. 3,4 %). La corrélation phénotype-
génotype est faible, étant donné que la même muta-
tion peut entraîner différents phénotypes. Des
mutations mitochondriales ont été documentées dans
un cas également affecté par une surdité de percep-
tion, le diabète, des anomalies de la conduction car-
diaque, l’ataxie et l’hyperréflexie
31
. La signification de
ces associations n’a pas encore été élucidée.
Dystrophies du développement et autres
dystrophies cornéennes
L’opacification de la cornée, centrale (leucome) ou
périphérique (sclérocornée), peut se manifester sous
diverses formes de dysgénésie du segment antérieur.
Un exemple est l’anomalie de Peters, dans laquelle des
mutations sont identifiées dans les gènes du
développement de l’œil (p. ex. PAX6
32
, PITX2
33
,
FOXC1
34
et CYP1B1
35
. Les mutations dans le gène
PAX6 peuvent également produire la kératite à trans-
mission autosomique dominante
36
.
Kératocône (OMIM 148300)
Le kératocône peut être sporadique ou se transmet
suivant le mode autosomique dominant dans 6 à 8 %
des cas
37
. Sa prévalence chez les parents de premier
degré est de 15 à 67 fois plus élevée que dans la popu-
lation générale
38
et on l’a observée chez des jumeaux
monozygotes
39
. Il apparaît vers la puberté avec une
dystrophie ectatique progressive entraînant l’amin-
cissement de la cornée et un astigmatisme myopique
irrégulier induit qui peut être très asymétrique
(figure 5)
40
. La topographie de la cornée est utile pour
le diagnostic et démontre une augmentation du K cen-
tral. Dans les cas avancés, on peut observer du tissu
cicatriciel sur la couche antérieure et une hydropisie
de la cornée peut se produire suite à la rupture de la
membrane de Descemet avec un œdème épithélial et
stromal subséquent. La baisse de la vision associée à
l’hydropisie de la cornée ou au tissu cicatriciel cornéen
peut nécessiter une greffe de la cornée. Pour une revue
complète du sujet, voir l’étude de Rabinowitz
40
. Le
kératocône est une affection génétiquement déter-
minée caractérisée par une combinaison de change-
ments biochimiques, structurels et cellulaires
41-44
. Il a
été associé à plusieurs anomalies chromosomiques,
comprenant la trisomie 21, le syndrome de Turner, le
chromosome 13 en anneau, la translocation du chro-
mosome 7 ;11, les troubles du tissu conjonctif, le syn-
drome d’Ehlers-Danlos, le syndrome de Marfan, la
dysplasie périostale, le prolapsus de la valve mitrale et
d’autres maladies oculaires (p. ex. l’amaurose congéni-
tale et l’atopie)
40
. Comme nous l’avons mentionné ci-
dessus, des mutations dans le facteur de transcription
VSX-1 ont été identifiées chez 4,7 % des patients
atteints de kératocône isolé
27
. Ce gène joue également
un rôle dans la dystrophie polymorphe postérieure
(voir ci-dessus).
Conclusion
L’ophtalmologie moléculaire apporte actuellement
un nouvel éclairage sur les maladies cornéennes
héréditaires. Ces nouvelles informations montrent que
bien que ces diverses maladies soient cliniquement
distinctes, elles peuvent avoir une base génétique
commune. On a identifié plusieurs catégories de gènes
qui jouent un rôle dans la détermination de la trans-
parence cornéenne et des maladies cornéennes (y
compris ceux intervenant dans la régulation du
développement de l’œil et de la cornée). Ils peuvent
également jouer un rôle dans la détermination et le
maintien de l’arrangement ultrastructurel de la cornée
et dans l’homéostasie métabolique. Ces gènes font par-
tie des voies moléculaires qui sont actuellement carac-
térisées, dont certaines jouent un rôle au-delà de la
cornée. De plus, certains de ces gènes (VSX1 et Col8A2)
lient différents processus biologiques, tels que le
développement et le vieillissement des yeux, du fait de
la vaste gamme de phénotypes impliqués. La com-
préhension de ces voies est essentielle à la modulation
Ophtalmologie
Conférences scientifiques
Figure 5 : Photographie montrant le signe de
Munson, caractéristique du kératocône à la
lampe à fente
26. Héon E, Mathers WD, Alward WL, et al. Linkage of posterior polymorphous
corneal dystrophy to 20q11. Hum Mol Genet 1995;4:485-8.
27.Héon E, Greenberg A, Kopp KK, et al. VSX1: A gene for posterior polymorphous
dystrophy and keratoconus. Hum Mol Genet 2002;11:1029-1036.
28.Biswas S, Munier FL, Yardley J, et al. Missense mutations in COL8A2, the gene
encoding the alpha2 chain of type VIII collagen, cause two forms of corneal
endothelial dystrophy. Hum Mol Genet 2001;10:2415-2423.
29.Cross HE, Maumenee AE, Cantolino SJ. Inheritance of Fuchs’ endothelial dystro-
phy. Arch Ophthalmol 1971;85:268-72.
30. Muragaki Y, Jacenko O, Apte S, et al. The alpha 2(VIII) collagen gene. A novel
member of the short chain collagen family located on the human chromosome 1.
J Biol Chem 1991;266:7721-7.
31. Albin RL. Fuchs’ corneal dystrophy in a patient with mitochondrial DNA muta-
tions. J Med Genet 1998 ;35:258-9.
32. Hanson IM, Fletcher JM, Jordan T, et al. Mutations at the PAX6 locus are found in
heterogeneous anterior segment malformations including Peters’ anomaly.
Nat Genet 1994;6:168-73.
33. Doward W, Perveen R, Lloyd IC, et al. A mutation in the RIEG1 gene associated
with Peters’ anomaly. J Med Genet 1999;36:152-5.
34.Nishimura DY, Searby CC, Alward WL, et al. A spectrum of FOXC1 mutations
suggests gene dosage as a mechanism for developmental defects of the anterior
chamber of the eye. Am J Hum Genet 2001;68:364-72.
35. Vincent A, Billingsley G, Priston M, et al. Phenotypic heterogeneity of CYP1B1:
mutations in a patient with Peters’ anomaly. J Med Genet 2001;38:324-6.
36. Mirzayans F, Pearce WG, MacDonald IM, et al. Mutation of the PAX6 gene in
patients with autosomal dominant keratitis. Am J Hum Genet 1995;57:539-48.
37. Edwards M, McGhee CN, Dean S. The genetics of keratoconus. Clin Experiment
Ophthalmol 2001;29:345-51.
38.Wang Y, Rabinowitz YS, Rotter JI, et al. Genetic epidemiological study of kerato-
conus: evidence for major gene determination. Am J Hum Genet 2000;93:403-9.
39. Bechara SJ, Waring GO, 3rd, Insler MS. Keratoconus in two pairs of identical twins.
Cornea 1996;15:90-3.
40.Rabinowitz YS, McDonnell PJ. Computer-assisted corneal topography in kerato-
conus. Refract Corneal Surg 1989;5:400-8.
41. Critchfield JW, Calandra AJ, Nesburn AB, et al. Keratoconus: I. Biochemical studies.
Exp Eye Res 1988;46:953-63.
42. Kim WJ, Rabinowitz YS, Meisler DM, et al. Keratocyte apoptosis associated with
keratoconus. Exp Eye Res 1999;69:475-81.
43. Collier SA, Madigan MC, Penfold PL. Expression of membrane-type 1 matrix metal-
loproteinase (MT1-MMP) and MMP-2 in normal and keratoconus corneas. Curr
Eye Res 2000;21:662-8.
44. Cheng EL, Maruyama I, Sundar Raj N, et al. Expression of type XII collagen and
hemidesmosome-associated proteins in keratoconus corneas. Curr Eye Res
2001;22:333-40.
Réunion scientifique à venir
13 au 15 avril 2005
World Cornea Congress V
Washington, DC
Renseignements : Meeting Services
Tél. : 866 614-5502
Fax : 877878-3388
Courriel :
Site web : www.ascrs.org
Note du rédacteur : Dans le numéro d’août-septembre
d’Ophtalmologie – Conférences scientifiques (Le ptérygion), à la
page 4 sous le paragraphe Mitomycine C (MMC), à la 6
e
ligne à
partir de la fin du deuxième paragraphe, la dose de MMC util-
isée devrait être de 0,2 mg/mL.
potentielle des phénotypes. Les études génétiques des dys-
trophies cornéennes évoluent et sont une approche efficace
pour établir un lien entre ces voies et définir de nouvelles
opportunités thérapeutiques.
Adresse électronique
OMIM : />REMERCIEMENTS : Je remercie les D
rs
Andrea Vincent,
Francis Munier et David Rootman pour les discussions
importantes que j’ai eues avec eux qui ont mené à la rédac-
tion de cet article.
Le D
r
Elise Héon est médecin au sein du Service d’ophtal-
mologie et des sciences de la vision, The Hospital for Sick
Children, Université de Toronto, Ontario.
Références
1. Chang SW, Tuli S, Azar DT, eds. Corneal Dystrophies, 1
st
ed. New York: Oxford
University Press;1998:217-266.
2. Starck T, Hersch PS, Kenyon KR. Corneal Dysgeneses, Dystrophies, and Degenera-
tions. In: Albert DM, Jakobiec FA, eds. Principles and Practice of Ophthalmology,
Vol 2, 2
nd
ed. Philadelphia: W.B. Saunders Company;2000:695-755.
3. Vincent AL, Rootman D, Munier FL, et al. A molecular perspective on corneal dys-
trophies. Dev Ophthalmol 2003;37:50-66.
4. Duke-Elder S. System of Ophthalmology, St Louis: CV Mosby, Vol III;1963:497-539.
5. Easty DS. Oxford Textbook of Ophthalmology. 1
st
ed. Oxford University Press;
1999:1006-11.
6. Panjawi N. Cornea and Sclera. In:Harding J, ed. Biochemistry of the Eye. London,
UK: Chapman and Hall;1997:16-51.
7. Pepose J, Ubels J. The Cornea. In: Harts Jr W, ed. Adler’s Physiology of the Eye, 9
th
ed.
St Louis, MI: Mosby-Year Book Inc;1992:29-70.
8. Dinh R, Rapuano CJ, Cohen EJ, et al. Recurrence of corneal dystrophy after
excimer laser phototherapeutic keratectomy. Ophthalmology 1999;106:1490-7.
9. Kuchle M, Green WR, Volcker HE, et al. Reevaluation of corneal dystrophies of
Bowman's layer and the anterior stroma (Reis-Bucklers and Thiel-Behnke types): a
light and electron microscopic study of eight corneas and a review of the litera-
ture. Cornea 1995;14:333-54.
10. Munier FL, Schorderet DF. [Chromosome 5q31 linked corneal dystrophies: outline
for a new classification]. Klin Monatsbl Augenheilkd 2001;218:136-9.
11. Munier FL, Frueh BE, Othenin-Girard P, et al. BIGH3 mutations in Type IIIA and
Intermediate Type I/IIIA of lattice corneal dystrophies are Fas4-specific. Invest
Ophthalmol Vis Sci 2002;43:949-954.
12. Yee RW, Sullivan LS, Lai HT, et al. Linkage mapping of Thiel-Behnke corneal
dystrophy (CDB2) to chromosome 10q23-q24. Genomics 1997;46:152-4.
13. Rosenberg ME, Tervo TM, Gallar J, et al. Corneal morphology and sensitivity in
lattice dystrophy type II (familial amyloidosis, Finnish type). Invest Ophthalmol Vis
Sci 2001;42:634-41.
14. Tsujikawa M, Kurahashi H, Tanaka T, et al. Identification of the gene responsible
for gelatinous drop-like corneal dystrophy. Nat Genet 1999;21:420-3.
15. Maury CP, Baumann M. Isolation and characterization of cardiac amyloid in famil-
ial amyloid polyneuropathy type IV (Finnish): relation of the amyloid protein to
variant gelsolin. Biochim Biophys Acta 1990;1096:84-6.
16. Maury CP, Alli K, Baumann M. Finnish hereditary amyloidosis. Amino acid
sequence homology between the amyloid fibril protein and human plasma gelso-
line. FEBS Lett 1990;260:85-7.
17. Santo RM, Yamaguchi T, Kanai A, et al. Clinical and histopathologic features of
corneal dystrophies in Japan. Ophthalmology 1995;102:557-67.
18. Konishi M, Yamada M, Nakamura Y, et al. Immunohistology of kerato-epithelin in
corneal stromal dystrophies associated with R124 mutations of the BIGH3 gene.
Curr Eye Res 2000;21:891-6.
19. Akama TO, Nishida K, Nakayama J, et al. Macular corneal dystrophy type I and
type II are caused by distinct mutations in a new sulphotransferase gene.
Nat Genet 2000;26:237-41.
20. Plaas AH, West LA, Thonar EJ, et al. Altered fine structures of corneal and skeletal
keratan sulfate and chondroitin/dermatan sulfate in macular corneal dystrophy.
J Biol Chem 2001;276:39788-96.
21. Liu NP, Dew-Knight S, Rayner M, et al. Mutations in corneal carbohydrate sulfo-
transferase 6 gene (CHST6) cause macular corneal dystrophy in Iceland. Mol Vis
2000;6:261-4.
22. Liu NP, Baldwin J, Lennon F, et al. Coexistence of macular corneal dystrophy types
I and II in a single sibship. Br J Ophthalmol 1998;82:241-4.
23. Cibis GW, Krachmer JA, Phelps CD, et al. The clinical spectrum of posterior poly-
morphous dystrophy. Arch Ophthalmol 1977;95:1529-37.
24. Sekundo W, Lee WR, Kirkness CM, et al. An ultrastructural investigation of
an early manifestation of the posterior polymorphous dystrophy of the cornea.
Ophthalmology 1994;101:1422-31.
25. Sekundo W, Marshall GE, Lee WR, et al. Immuno-electron labelling of matrix com-
ponents in congenital hereditary endothelial dystrophy. Graefes Arch Clin Exp
Ophthalmol 1994;232:337-46.
© 2004 Département d’ophtalmologie et des sciences de la vision, Faculté de médecine, Université de Toronto, seul responsable du contenu de cette publication. Édition : SNELL Communication
Médicale Inc. avec la collaboration du Département d’ophtalmologie et des sciences de la vision, Faculté de médecine, Université de Toronto.
MD
Ophtalmologie – Conférences scientifiques est une marque
de commerce de SNELL Communication Médicale Inc.Tous droits réservés. L’administration d’un traitement thérapeutique décrit ou mentionné dans Ophtalmologie – Conférences scientifiques doit
toujours être conforme aux renseignements d’ordonnance approuvés au Canada. SNELL Communication Médicale se consacre à l’avancement de l’éducation médicale continue de niveau supérieur.
L’élaboration de cette publication a bénéficié d’une subvention à l’éducation de
Novartis Ophthalmics
130-011F
La version française a été révisée par le professeur Pierre Lachapelle,
Montréal.
Les avis de changement d’adresse et les demandes d’abonne-
ment pour Ophtalmologie – Conférences Scientifiques doivent
être envoyés par la poste à l’adresse C.P. 310, Succursale H,
Montréal (Québec) H3G 2K8 ou par fax au (514) 932-5114 ou
par courrier électronique à l’adresse
Veuillez vous référer au bulletin Ophtalmologie – Conférences
Scientifiques dans votre correspondence. Les envois non
distribuables doivent être envoyés à l’adresse ci-dessus.
Poste-publications #40032303
SNELL
Ophtalmologie
Conférences scientifiques
NOVEMBRE 2004
Volume 2, numéro 9
COMPTE RENDU DES CONFÉRENCES
SCIENTIFIQUES DU DÉPARTEMENT
D’OPHTALMOLOGIE ET
DES SCIENCES DE LA VISION,
FACULTÉ DE MÉDECINE,
UNIVERSITÉ DE TORONTO
Département d’ophtalmologie
et des sciences de la vision
Faculté de médecine
Université de Toronto
60 Murray St.
Bureau 1-003
Toronto (Ontario) M5G 1X5
Le contenu rédactionnel d’Ophtalmologie –
Conférences scientifiques est déterminé
exclusivement par le Département
d’ophtalmologie et des sciences de la vision,
Faculté de médicine, Université de Toronto.
Département d’ophtalmologie
et des sciences de la vision
Jeffrey Jay Hurwitz, M.D., Rédacteur
Professeur et président
Martin Steinbach, Ph.D.
Directeur de la recherche
The Hospital for Sick Children
Elise Heon, M.D.
Ophtalmologiste en chef
Mount Sinai Hospital
Jeffrey J. Hurwitz, M.D.
Ophtalmologiste en chef
Princess Margaret Hospital
(Clinique des tumeurs oculaires)
E. Rand Simpson, M.D.
Directeur, Service d’oncologie oculaire
St. Michael’s Hospital
Alan Berger, M.D.
Ophtalmologiste en chef
Sunnybrook and Women’s College
Health Sciences Centre
William S. Dixon, M.D.
Ophtalmologiste en chef
The Toronto Hospital
(Toronto Western Division and
Toronto General Division)
Robert G. Devenyi, M.D.
Ophtalmologiste en chef
Progrès effectués dans
la chirurgie réfractive
PAR RAYMOND M. STEIN, M.D., FRCSC
Au cours des dernières années, des progrès technologiques importants ont été
effectués en chirurgie réfractive grâce auxquels ces interventions offrent une plus grande
innocuité, prédictibilité et satisfaction de la part du patient. Dans le passé, l’objectif était
d’obtenir une acuité visuelle non corrigée qui était similaire à la meilleure acuité visuelle
obtenue avec correction optique par le port de lentilles de contact ou de lunettes.
Aujourd’hui, on a la possibilité d’améliorer la meilleure acuité visuelle corrigée ainsi que
la qualité globale de la vision. Sur une période de 20 ans, la chirurgie au laser excimer de
la cornée a évolué d’une série d’expériences sur des animaux à plus de 5 millions
d’interventions cliniques. Grâce aux progrès effectués dans la correction de la vision au
laser et à l’évolution d’autres interventions (p. ex. l’implantation de lentilles
intraoculaires phakiques, l’échange du cristallin à but réfractif), la plupart des patients
ont la possibilité de ne plus avoir à utiliser d’aides visuelles pour la vision de loin et des
innovations sont également mises au point actuellement pour corriger la vision de près.
Les patients qui subissent une intervention de chirurgie réfractive sont différents des
patients typiques qui nous consultent. Ce sont des personnes en bonne santé, actives et
qui travaillent, qui n’ont pas le temps ni le désir d’attendre dans une salle d’attente. Étant
donné que la correction de la vision au laser, l’implantation de lentilles intraoculaires
(LIO) phakiques et l’échange du cristallin à but réfractif sont des interventions électives,
ces patients ont donc le choix du chirurgien qui les réalisera. Le respect de leur temps et
de toute inquiétude qu’ils pourraient avoir au sujet des interventions de chirurgie
réfractive est essentiel au succès des professionnels des soins ophtalmologiques. Grâce à
la bonne gestion de l’expérience du patient par le cabinet d’ophtalmologie – du premier
appel téléphonique à la dernière visite de suivi – la chirurgie réfractive sera profitable
tant pour le patient que pour le praticien. Dans ce numéro d’
Ophtalmologie – Conférences
scientifiques
, nous explorons les innovations faites dans la chirurgie réfractive, la
sélection des patients et les soins postopératoires.
Indications
Les patients sélectionnés pour la chirurgie réfractive doivent être âgés ≥ 18 ans et
présenter un trouble réfractif stable. Il existe une exception à cette règle : si le patient
désire subir une intervention de chirurgie réfractive pour répondre à des obligations
professionnelles (p. ex. un pompier ou un agent de police), une légère modification de
la réfraction d’une année à l’autre n’a pas d’importance. Il ne sera congédié simplement
parce que plusieurs années après s’être qualifié pour son emploi, la réfraction se situe à
-1,00 dioptrie (D). Les interventions indiquées pour les troubles réfractifs sont le LASIK
(laser in situ keratomileusis), la photokératectomie réfractive (PKR) ou laser excimer de
surface, les interventions de la cornée visant une rétraction thermique du collagène, les LIO
phakiques et l’échange du cristallin à but réfractif (voir les tableaux 1 et 2).
Correction de la vision au laser
Bien que les chirurgiens spécialisés dans la chirurgie réfractive aient leurs propres limites
inférieure et supérieure, la gamme de correction pour le LASIK et la PKR est d’environ
+5,00 D à -10,00 D. L’astigmatisme entre 0,25 D et -6,00 D peut également être corrigé au
laser. Les options en ce qui concerne la correction de la vision au laser par le LASIK et la PKR
incluent l’ablation conventionnelle ou l’ablation personnalisée (figure 1). On obtient la
MC
Département
d’ophtalmologie et des
sciences de la vision
FACULTY OF MEDICINE
University of Toronto
Disponible sur Internet à :
www.ophtalmologieconferences.ca
meilleure qualité de vision et la meilleure acuité visuelle
corrigée avec l’ablation personnalisée que l’on peut
réaliser par une ablation asphérique, une ablation
guidée par l’analyseur de front d’ondes ou par une abla-
tion guidée par topographie.
Une ablation asphérique utilise les mesures
obtenues par la kératométrie pour ajuster la fréquence à
laquelle le laser est appliqué sur la cornée semi-
périphérique, de façon à obtenir une courbure de la
cornée plus allongée
1
. Cette courbure ressemble à celle
de la cornée normale, qui est plus bombée au centre et
plus plate à la périphérie. Cela réduit l’induction d’une
aberration sphérique et améliore la qualité de la vision
nocturne.
Une ablation guidée par l’analyseur de front d’ondes
vise à réduire les aberrations d’ordre supérieur (coma,
trilobe et sphérique) qui peuvent affecter la qualité de la
vision
2
. En général, les patients présentant une faible
incidence d’aberrations d’ordre élevé obtiennent de
bons résultats avec une ablation sphérique, alors que
ceux qui présentent une incidence élevée d’aberrations
d’ordre élevé obtiennent un meilleur résultat avec l’ab-
lation guidée par l’analyseur de front d’ondes.
Une ablation guidée par topographie corrige les
cornées irrégulières et améliore la meilleure acuité
visuelle corrigée
4
. Contrairement à l’imagerie du front
d’ondes qui mesure 150 à 250 points réfractifs de l’œil,
un système topographique peut mesurer plus de 22 000
points sur la cornée. La transmission de ces données à
l’ordinateur du laser permet d’améliorer la meilleure
acuité visuelle corrigée par des lunettes chez les
patients atteints de kératocône, d’une forme fruste de
kératocône et d’autres formes d’astigmatisme irrégulier.
Récemment, on a obtenu de meilleurs résultats avec
la PKR (figure 2) grâce au développement du laser à
point lumineux mobile qui produit une ablation plus
lisse, de plus grandes zones optiques et de transition
permettant d’éviter le risque de formation de tissu cica-
triciel sur la cornée, aux techniques de refroidissement
(p. ex. la glace) qui réduisent l’inflammation
5
et aux
traitements pharmacologiques d’appoint (p. ex. mito-
mycine C topique
6
et vitamine C orale
7
) qui diminuent
le flou cornéen (haze).
Une technique Epi-LASIK, qui utilise un micro-
kératome dont la lame est émoussée pour créer un lam-
beau épithélial, est présentement mise au point
8
. Le
lambeau épithélial est soulevé, l’ablation au laser est
réalisée et le lambeau est remis en place sur la zone
traitée. Cette technique permet d’éviter les complica-
tions potentielles au niveau du lambeau associées au
LASIK (p. ex. un trou dans le lambeau, un lambeau
2
Tableau 1 : Interventions de chirurgie réfractive
myopique indiquées dans les troubles réfractifs
Échange du cristallin à but réfractif
0 -10 -2 -30 D
Photokératectomie réfractive ± mitomycine C
LASIK
LIO phakique
Tableau 2 : Interventions de chirurgie réfractive
hypermétropique indiquées dans les troubles
réfractifs
0 +5 +10 +20 D
Rétraction du collagène
Photokératectomie réfractive
LASIK
LIO phakique
Échange du cristallin à but réfractif
Figure 1 : La correction de la vision au laser
fournit aux patients l’option de réduire leur
dépendance aux lunettes ou aux lentilles
de contact
Figure 2 : Brosse rotative utilisée dans l’ablation
de surface au laser pour extraire l’épithélium
cornéen