Les troubles de l’intégration visuelle - part 9 pot
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (1021.47 KB, 19 trang )
O
ptions chirurgicales pour
le strabisme de l’adulte
Comme nous l’avons vu dans la partie 1, la chirurgie
du strabisme chez les adultes est « restauratrice », ce qui
signifie qu’elle est très efficace pour éliminer les symptômes
d’un patient et entraîne plusieurs avantages fonctionnels
41
.
Une pourcentage élevé d’adultes obtiennent un réaligne-
ment des yeux satisfaisant, défini généralement comme
une réduction de l’angle préopératoire à quelques DP
7,42,43
.
La chirurgie chez les adultes peut être réalisée sous anes-
thésie locale, bien que les progrès récents dans les anesthé-
siques généraux et la prise en charge des voies aériennes
aient amélioré le délai entre la fin de l’opération d’un
patient et la fin de l’induction du patient suivant.
Nouvelles avan cées en chirurgie: Au cours de dernières
années, d’importants progrès ont été réalisés dans la
chirurgie du strabisme, en termes de qualité technique et
de variété des interventions disponibles. Très peu de cas de
strabisme sont considérés actuellement comme intraitables
grâce à la myriade de possibilités offertes. Un paradigme
qui a changé au cours de ces dernières années est la
conception de la chirurgie du strabisme qui est actuelle-
ment individualisée pour chaque patient. Il n’est plus
acceptable de simplement planifier une correction pour
obtenir un réalignement en position primaire. L’objectif de
la chirurgie du strabisme devrait être de maximiser la VBS
(le champ de fusion) pour que le patient obtienne le champ
de vision le plus large possible et déplace ses yeux en
tandem. Idéalement, le patient devrait obtenir une vision
simple de 30 degrés à partir de la position primaire
41
. Cela
peut nécessiter une modification de la planification tradi-
tionnelle de l’intervention chirurgicale en termes de choix
des muscles et du dosage de la chirurgie.
Au cours de ces dernières années, des progrès chirurgi-
caux ont été réalisés dans la correction des diverses incli-
naisons de la tête dues au nystagmus
44
. Un autre domaine
est la transposition de muscles oculaires pour traiter diverses
affections, incluant la paralysie du sixième nerf et la dévia-
tion verticale dissociée (DVD)
45
. Les connaissances actuelles
des fonctions de la poulie des muscles oculaires ont mené à
l’adoption de nouvelles approches pour traiter les syndromes
A et V, le glissement des muscles oculaires et les anomalies
des mouvements des yeux dans le syndrome de Duane
46
.
Enfin, les nouvelles méthodes pour traiter la cyclotorsion ont
amélioré le taux de succès pour traiter la paralysie du
quatrième nerf, ainsi que le strabisme induit par la trans-
location maculaire et l’opération de plissement scléral.
Chirurgie avec suture ajustable:L’un des progrès majeurs
effectués dans la chirurgie du strabisme est l’utilisation de
sutures ajustables, popularisée par Jampolsky dans les
années 1960
2
. Cette option permet au chirurgien de placer
les yeux dans la position optimale désirée durant la période
postopératoire immédiate pour avoir la meilleure chance
d’obtenir un alignement réussi à long terme. Réciproque-
ment, elle permet au chirurgien d’éviter de laisser l’œil dans
une position non désirée
47
. Une étude a montré que la
chirurgie avec suture ajustable a eu un taux plus élevé de
succès que la chirurgie conventionnelle, bien qu’elle ait été
particulièrement avantageuse dans les cas de chirurgie
répétée du strabisme et pour corriger les mauvais aligne-
ments horizontaux et verticaux complexes
48
. Il existe deux
méthodes de base pour la chirurgie des muscles oculaires
avec sutures ajustables : l’une d’elles consiste à effectuer un
nœud formant une boucle pouvant être desserrée et resser-
rée selon les besoins. L’autre méthode utilise une anse qui
peut tirer vers le haut ou vers le bas les sutures du muscle
pour changer la position du muscle
49
(figures 2 et 3). Ces
sutures sont généralement ajustées le jour de l’intervention
chirurgicale ou jusqu’à 24 heures après, bien que l’utilisa-
tion de divers produits lubrifiants lors de l’intervention
permette l’ajustement des sutures jusqu’à 3 ou 4 jours plus
tard. Les sutures à fixation sclérale dont les brins sont
laissés sous la conjonctive peuvent être utilisées pour
augmenter une récession dans le strabisme restrictif sévère
et ces sutures peuvent être ajustées au besoin pendant une
période maximale de 10 jours après l’intervention
49
.
Des études sur des sutures ajustables utilisées en
chirurgie des muscles oculaires horizontaux ont montré
des taux d’alignement réussi à long terme de 83 % à
92 %
7,42,43,47,48
. Ces taux sont plus élevés que ceux pour la
chirurgie traditionnelle (suture non ajustable), dont les taux
de succès rapportés atteignent environ 75 % à 80 % dans
l’ensemble
48
. Une étude a révélé que le taux de succès de
la réparation de l’ésotropie et l’exotropie était équivalent à
celui des chirurgies primaires et répétées
47
. Le taux de
succès de plus de 85 % pour tous les groupes dépendait de
l’obtention d’une gamme étroite d’alignements postopéra-
toires immédiatement après la chirurgie pouvant se situer
entre 3 DP et 0 pour l’ésotropie et entre 3 et 7 DP de
surcorrection pour l’exotropie. Les taux de succès pour
d’autres formes de strabisme varient selon l’anomalie mais
dans l’ensemble, une majorité de patients peuvent béné-
ficier d’une amélioration importante de l’alignement de
Ophtalmologie
Conférences scientifiques
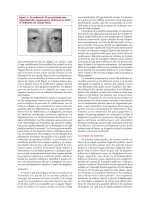
F
igure 2 : Diagramme d’une méthode uti lisant un fil de
s
uture ajustable formant un noeud en boucle p our la
r
écession du muscle droit. Une suture fixe est utilisée pour
le muscle et un nœud temporaire est effectué avec les
s
utures du muscle qui peut être défait lorsque la position
d
u muscle est ajustée plus tard dans la journée. À noter,
la suture sclérale temporaire formant une boucle près du
limbe, qui permet à l’assistant de fixer le globe pendant
q
ue le chirurgien ajuste la position du muscle
49
.
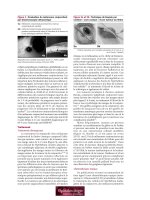
Figure 3 : Diagramme d’une méthode utilisant une suture
ajustable avec nœud de type coulissant pour la récession
du muscle droit. Une « anse » est faite autour des sutures
du muscle qui peut tirer vers le haut ou vers le bas les
sutures du muscle pour changer la position du muscle
au moment de l’ajustement
49
.
leurs yeux et une trốs grande majoritộ est satisfaite des rộsultats
postopộratoires.
Complications de la chirurgie du strabisme:Les complications
de la chirurgie du strabisme sont heureusement peu frộquentes
50
.
Le taux dinfections aprốs la chirurgie est faible grõce lutilisation
gộnộrale dantibiotiques topiques pendant la pộriode postopộra-
toire. Le taux dendophtalmite est extrờmement faible et estimộ
1 cas sur 20 000 30 000. Les rộactions la suture sont peu
frộquentes, ộtant donnộ que la plupart des sutures sont
rộsorbables et faites de matiốres synthộtiques. Ces rộactions sont
gộnộralement contrụlộes par des stộroùdes topiques. Un dellen
peut survenir si la conjonctive est oedộmateuse et celui-ci rộpond
aux lubrifiants. Il est parfois nộcessaire de faire lablation de kystes
conjonctivaux ou subconjonctivaux sils sont inesthộtiques ou irri-
tants pour le patient. Une ischộmie du segment antộrieur peut se
produire chez les patients prộsentant une altộration vasculaire qui
subissent une intervention sur plus de 2 muscles droits. Dautres
complications inhabituelles incluent les hộmorragies rộtrobul-
baires, la myosite, la sclộrite et les perforations sclộrales.
Conclusions
Le traitement des adultes atteints de strabisme inclut
plusieurs options chirurgicales et non chirurgicales qui offrent
de nombreux avantages fonctionnels. Chez de nombreux
patients, la chirurgie nest pas nộcessaire et on peut les traiter par
dautres moyens qui peuvent ờtre sỷrs et efficaces. La chirurgie
pour les adultes est restauratrice et a un excellent rapport coỷt-
efficacitộ. Elle est trốs efficace pour rộtablir un alignement satis-
faisant et chez une majoritộ de patients, les symptụmes
prộopộratoires se rộsorbent avec un faible risque de complica-
tions, incluant la diplopie.
Remerciements
L auteur dộsire remercier M
me
Frances Kraft et les D
rs
David
Smith, Brian Arthur et Michael Flanders pour avoir rộvisộ le
manuscrit et fait de prộcieuses suggestions. La D
r
Susan Tucker a
fait les dessins pour les Figures 2 et 3.
Le D
r
Kraft est ophtalmologiste au Hospital for Sick Children et au sein du
Rộseau universitaire de santộ, et professeur dans le Dộpartement dophtal-
mologie et des sciences de la vision lUniversitộ de Toronto, Toronto, Ontario.
Rộfộrences:
1. von Noorden GK. The History of Strabismology. Oostende, Belgium: JP Wayenborgh; 2002.
2. Jampolsky A. Strabismus reoperation techniques. Trans Am Acad Ophthalmol Otolaryngol
1975;79(5):704-17
3. Vộronneau-Troutman S. Prisms in the Medical and Surgical Management of Strabismus.
St. Louis: Mosby; 1994.
4. Jampolsky A, Flom M, Thorson JC. Membrane Fresnel prisms: a new therapeutic device. In:
Fells P, ed. The First Congress of the International Strabismological Association. London:
Kimpton; 1971:183-93.
5. Scott AB. Botulinum toxin injection of eye muscles to correct strabismus. Trans Am
Ophthalmol Soc 1981;79:738-68.
6. Coats DK, Stager DR, Beauchamp GR, et al. Reasons for delays in referrals for adult
strabismus surgery. Arch Ophthalmol 2005;123(4):497-9.
7. Scott WE, Kutschke PJ, Lee WR. Adult strabismus (20th Frank Costenbader Lecture). J Ped
Ophthalmol Strabismus 1995;32(6):348-52.
8. Beauchamp GR, Black BC, Coats DK, et al. The management of strabismus in adults: I.
Clinical characteristics and treatment. J of AAPOS 2003;7(4):233-40.
9. Hamed LM. Strabismus presenting after cataract surgery. Ophthalmology 1991;98(2):247-52.
10. Hamed LM, Helveston EM, Ellis FD. Persistent binocular diplopia after cataract surgery. Am J
Ophthalmol 1987;103(6):741-4.
11. Rose KM, Roper-Hall G. Differential diagnosis of diplopia following cataract extraction.
Am Orthoptic J 1999;49:99-104.
12. Catalano RA, Nelson LB, Calhoun JH, Schatz NJ, Harley RD. Persistent strabismus presenting
after cataract surgery. Ophthalmology 1987;94:491-4.
13. Rosenbaum AL. Strabismus following uncomplicated cataract surgery (Editorial). Arch
Ophthalmol 1997;115(2):253.
14. MacDonald IM, Reed GF, Wakeman BJ. Strabismus after regional anesthesia for cataract
surgery. Can J Ophthalmol 2004;39(3):267-71.
15. Sabetti L, Spadea L, DAlessandri L, Balestrazzi E. Photorefractive keratectomy and laser in
situ keratomileusis in refractive accommodative esotropia. J Cataract Refract Surg
2005;31(10):1899-903.
â 2007 Dộpartement dophtalmologie et des sciences de la vision, Facultộ de mộdecine, Universitộ de Toronto, seul responsable du contenu de cette publication. ẫdition : SNELL Communication
Mộdicale Inc. avec la collaboration du Dộpartement dophtalmologie et des sciences de la vision, Facultộ de mộdecine, Universitộ de Toronto.
MD
Ophtalmologie Confộrences scientiques est une marque
dộposộe de SNELL Communication Mộdicale Inc. Tous droits rộservộs. Ladministration dun traitement thộrapeutique dộcrit ou mentionnộ dans Ophtalmologie Confộrences scientiques doit toujours
ờtre conforme aux renseignements dordonnance approuvộs au Canada. SNELL Communication Mộdicale se consacre lavancement de lộducation mộdicale continue de niveau supộrieur.
Lộlaboration de cette publication a bộnộciộ dune subvention lộducation de
Novartis Ophthalmics
130-031F
Les avis de changement dadresse et les demandes dabonnement
pour Ophtalmologie Confộrences Scientiques doivent ờtre
envoyộs par la poste ladresse C.P. 310, Succursale H, Montrộal
(Quộbec) H3G 2K8 ou par fax au (514) 932-5114 ou par courrier
ộlectronique ladresse Veuillez vous
rộfộrer au bulletin Ophtalmologie Confộrences Scientiques dans
votre correspondance. Les envois non distribuables doivent ờtre
envoyộs ladresse ci-dessus. Poste-publications #40032303
SNELL
La version franỗaise a ộtộ rộvisộe par le professeur Pierre Lachapelle,
Montrộal.
16. Farahi A, Hashemi H. The effect of hyperopic laser in situ keratomileusis on refractive
a
ccommodative esotropia. Eur J Ophthalmol 2005;15(6):688-94.
17. Stidham DB, Borissova O, Borissov V, Prager TC. Effect of hyperopic laser in situ
keratomileusis on ocular alignment and stereopsis in patients with accommodative
esotropia. Ophthalmology 2002;109(6):1148-53.
18. Nemet P, Levenger S, Nemet A. Refractive surgery for refractive errors which cause
s
trabismus: A report of 8 cases. Binocul Vis Strabismus Q 2002;17(3):187-90.
19. Nucci P, Serano M, Hutchinson AK. Photorefractive keratectomy for the treatment of
purely refractive accommodative esotropia. J Cataract Refract Surg 2003;29(5):889-94.
20. Godts D, Trau R, Tassignon MJ. Effect of refractive surgery on binocular vision and ocular
alignment in patients with manifest or intermittent strabismus. Br J Ophthalmol 2006;
9
0(11):1410-3.
21. Nucci P, Serano M, Hutchinson AK. Photorefractive keratectomy followed by strabismus
surgery for the treatment of partly accommodative esotropia. J of AAPOS 2004;8(6):555-9.
22. Snir M, Kremer I, Weinberger D, Sherf I, Axer-Siegel R. Decompensation of exodeviation after
corneal refractive surgery for moderate to high myopia. Ophthalmic Surg Lasers Imaging
2003;34(5):363-70.
23. Kushner BJ, Kowal L. Diplopia after refractive surgery: occurrence and prevention. Arch
O
phthalmol 2003;121(3):315-21.
24. Furr BA, Archer SM, Del Monte MA. Strabismus misadventures in refractive surgery. Am
Orthoptic J 2001;51:11-5.
25. Godts D, Tassignon MJ, Gobin L. Binocular vision impairment after refractive surgery.
J Cataract Refract Surg 2004;30(1):101-9.
2
6. Schuler E, Silverberg M, Beade P, Moadel K. Decompensated strabismus after laser in situ
keratomileusis. J Cataract Refract Surg 1999;25(11):1552-3.
27. Helveston EM. Visual training: Current status in ophthalmology. Am J Ophthalmol
2005;140(5):903-10.
28. Petrunak JL. The treatment of convergence insufciency. Am Orthoptic J 1999;49:12-6.
2
9. Jenkins RH. Characteristics and diagnosis of convergence insufciency. Am Orthoptic J
1999;49:7-11.
30. Thorson JC. Press-on prisms in ocular motility management. Am Orthoptic J 1972;22:59-63.
31. Spielmann A. Clinical rationale for manifest congenital nystagmus surgery. J of AAPOS
2000;4:67-74.
3
2. Kutschke PJ, Keech RV. Surgical outcome after prism adaptation for esotropia with a
distance-near disparity. J of AAPOS 2001;5(3):189-92.
33. Wygnanski-Jaffe T, Trotter J, Watts P, Kraft SP, Abdolell M. Preoperative prism adaptation in
acquired esotropia with convergence excess. J of AAPOS 2003;7:(1)28-33.
34. Magoon E, Cruciger M, Scott AB, Jampolsky A. Diagnostic injection of xylocaine into extra-
o
cular muscles. Ophthalmology1982;89(2):489-91.
35. Kraft SP. Surgery for Duane syndrome. Am Orthoptic J 1993;43:18-26.
36. Lee JP. Botulinum toxin in the management of ocular muscle disorders. Am Orthoptic J
1995;45:115-24.
37. Scott AB. Botulinum toxin therapy of eye muscle disorders: Safety and Effectiveness.
O
phthalmic Procedures Assessment of American Academy of Ophthalmology.
Ophthalmology: Instruments and Book Issue 1989;37-41.
38. Carruthers JD, Kennedy RA, Bagaric D. Botulinum vs. adjustable suture surgery in the treat-
ment of horizontal misalignment in adult patients lacking fusion. Arch Ophthalmol
1990;108(12):1432-5.
3
9. Holmes JM, Beck RW, Kip KE, Droste PJ, Leske DA. Botulinum toxin treatment versus conser-
vative management in acute traumatic sixth nerve palsy or paresis. J of AAPOS
2000;4(3):145-9.
40. Lee J, Harris S, Cohen J, Cooper K, MacEwen C, Jones S. Results of a prospective randomized
trial of botulinum toxin therapy in acute unilateral sixth nerve palsy. J Ped Ophthalmol
S
trabismus 1994;31(5):283-6.
41. Kraft SP. Outcome criteria in strabismus surgery. Can J Ophthalmol 1998;33(4):237-9.
42. Mills MD, Coats DK, Donahue SP, Wheeler DT. Strabismus surgery for adults: A report by
the American Academy of Ophthalmology. Ophthalmology 2004;111(6):1255-62.
43. Kushner BJ, Morton GV. Postoperative binocularity in adults with longstanding strabismus.
A
rch Ophthalmol 1992;99(3):316-9.
44. Repka MX. Nystagmus: Clinical evaluation and surgical management. In: Rosenbaum AL,
Santiago PA, eds. Clinical Strabismus Management. Philadelphia: Saunders;1999:404-20.
45. Santiago AP, Rosenbaum AL. Selected transposition procedures. In: Rosenbaum AL, Santiago
PA, eds. Clinical Strabismus Management. Philadelphia: Saunders; 1999:476-89.
4
6. Demer JL. Pivotal role of orbital connective tissues in binocular alignment and strabismus
(Freidenwald Lecture). Invest Ophthalmol Vis Sci 2004;45(3):729-38.
47. Eino D, Kraft SP. Postoperative drifts after adjustable suture strabismus surgery. Can J
Ophthalmol 1997;32(3):163-9.
48. Wisnicki HJ, Repka MX, Guyton DL. Reoperation rate in adjustable strabismus surgery. J Ped
Ophthalmol Strabismus 1988;25(3):112-4.
49. Kraft SP, Jacobson ME. Adjustable suture techniques in strabismus surgery. In: Nelson LB,
Lavrich J, eds. Ophthalmology Clinics of North America: Strabismus Surgery. Philadelphia: WB
Saunders; 1992:93-104.
50. Ellis FD, Wasserman BN, Hidaji F. Selected surgical complications. In: Rosenbaum AL,
Santiago PA, eds. Clinical Strabismus Management. Philadelphia: Saunders;1999:539-51.
Le D
r
Kraft dộclare quil na aucune divulgation faire en association
avec le contenu de cet article.
Ophtalmolo gie
Confộrences scientifiques
JUILLET/AOT 2007
Volume 5, numộro 4
C
OMPTE RENDU DES CONFẫRENCES
S
CIENTIFIQUES DU DẫPARTEMENT
D
OPHTALMOLOGIE ET
D
ES SCIENCES DE LA VISION,
F
ACULTẫ DE MẫDECINE,
U
NIVERSITẫ DE TORONTO
Dộpartement dophtalmologie
et des sciences de la vision
Facultộ de mộdecine
Universitộ de Toronto
60 Murray St.
Bureau 1-003
Toronto (Ontario) M5G 1X5
Le contenu rộdactionnel dOphtalmologie
Confộrences scientiques est dộterminộ
exclusivement par le Dộpartement
dophtalmologie et des sciences de la vision,
Facultộ de mộdicine, Universitộ de Toronto.
Dộpartement dophtalmologie
et des sciences de la vision
Jeffrey Jay Hurwitz, M.D., Rộdacteur
Professeur et prộsident
Martin Steinbach, Ph.D.
Directeur de la recherche
The Hospital for Sick Children
Elise Heon, M.D.
Ophtalmologiste en chef
Mount Sinai Hospital
Jeffrey J. Hurwitz, M.D.
Ophtalmologiste en chef
Princess Margaret Hospital
(Clinique des tumeurs oculaires)
E. Rand Simpson, M.D.
Directeur, Service doncologie oculaire
St. Michaels Hospital
Alan Berger, M.D.
Ophtalmologiste en chef
Sunnybrook Health Sciences Centre
William S. Dixon, M.D.
Ophtalmologiste en chef
The Toronto Hospital
(Toronto Western Division and
Toronto General Division)
Robert G. Devenyi, M.D.
Ophtalmologiste en chef
Mise jour sur la technologie avancộe des
lentilles intraoculaires (LIO) : les LIO monofocales
BASE E R U. KHA N , M.D., FRC S ( C)
Les deux derniốres dộcennies ont ộtộ tộmoins de progrốs incroyables tant dans les techniques
que dans les rộsultats obtenus en chirurgie de la cataracte. Les dix premiốres annộes ont vu la
phacoộmulsification acceptộe de maniốre quasi gộnộrale comme technique standard dextraction
du cristallin dans la cataracte, alors que les dix annộes suivantes ont connu une plộthore
davancộes dans la technologie des LIO. Bien quils aient ộtộ, lorigine, proposộs par Sir Harold
Ridley, en 1955, les LIO nont pas ộtộ bien acceptộs jusquau milieu des annộes 80s. Aujourdhui,
une multitude doptions existent, aussi bien pour les patients que pour les chirurgiens. Compte
tenu de la masse de connaissances et de la littộrature dont nous disposons sur les diffộrents
implants, cet article se consacrera uniquement la variộtộ dimplants monofocaux dont disposent
les chirurgiens au Canada. Par ailleurs, bien quil y ait de nombreuses entreprises qui fabriquent
des LIO, ce numộro dOphtalmologie Confộrences scientifiques ộtudiera essentiellement ceux que
proposent les trois principaux fabricants de LIO en Amộrique du Nord, savoir: Advanced Medical
Optics (AMO), Alcon et Baush and Lomb (B&L). Le Tableau 1 rộsume les technologies de pointe en
matiốre de LIO monofocaux auxquelles chacune de ces trois firmes a eu recours.
Les implants asphộriques
A lorigine, les premiốres implantations de LIO visaient corriger grossiốrement lerreur de
sphộricitộ consộcutive lộlimination de lobstruction visuelle due la cataracte. Plus rộcemment, lin-
troduction de la technologie par front dondes a permis danalyser et de comprendre la faỗon dont les
aberrations de degrộ ộlevộ, telles que dộfinies par les polynụmes de Zernicke, influencent la vision.
Dộfinie jadis par lộchelle dacuitộ de Snellen, qui ne reprộsente quun petit sous-groupe des situations
visuelles que vivent tous les jours les patients, la performance visuelle peut prộsent ờtre mesurộe de
maniốre plus prộcise, en utilisant la sensibilitộ au contraste. La sensibilitộ au contraste a ộtộ validộe
comme ộtant un puissant indicateur de la performance visuelle, capable dộvaluer la vision travers le
spectre de luminance et dộblouissement des activitộs quotidiennes
1
-7
. Cest une fonction de lefficacitộ
optique de lil mesurộe en utilisant la fonction transfert de modulation (FTM) et de la plus petite
rộsolution possible au niveau de la rộtine
8,9
. La FTM quantifie la capacitộ dun systốme optique
produire avec prộcision limage dun objet dont la frộquence spatiale et la luminositộ varient. Une grille
sinusoùdale est souvent utilisộe comme objet test standard dans les ộtudes de laboratoires (Figure 1).
Dans lil phakique, deux structures optiques sont responsables de la focalisation de la lumiốre
sur la rộtine: le cristallin et la cornộe. Les aberrations de la cornộe ont ộtộ bien ộtudiộes et bien docu-
mentộes. Dans la population en gộnộral, la valeur moyenne de toutes ces aberrations est de ô0ằ, sauf
pour le polynụme Z
4
0 qui reprộsente laberration de sphộricitộ: la valeur, ộtant dans ce cas, de
0,27 àm
10-14
. Alors que cette valeur moyenne a ộtộ reproduite dans de nombreuses ộtudes, lộcart type
rapportộ a variộ entre 0,02 àm et 0,089 àm
10-14
. Bien que le cristallin nait pas ộtộ aussi bien ộtudiộ, il
prộsente des aberrations qui compensent, en gộnộral, celles que lon a constatộes dans la cornộe et que
lon qualifie, parfois, dôaberrations demmộtropisationằ
10,15-20
. En tant que telle, la valeur moyenne de
toutes les aberrations du cristallin, au sein de la population, est ộgalement de ô 0 ằ, sauf celle du
polynụme Z
4
0 dont on peut prộdire quelle est nộgative
10
. Toutefois, la diffộrence de la cornộe qui
demeure statique, dans le temps, laberration de sphộricitộ devient de plus en plus positive avec lõge,
passant de 0,2 àm, la naissance, 0,0 àm aux environs de 70 ans. Ces changements dans la
propriộtộ de rộfringence du cristallin contribuent vraisemblablement la baisse de la performance
visuelle et expliquent les plaintes fonctionnelles ộmises par les patients õgộs qui ne manifestent pas,
autrement, de modifications attribuables la formation dune cataracte
20
.
Alors que les aberrations de degrộ faible, telles que la vision floue et lastigmatisme, peuvent ờtre
traitộes par des lunettes correctrices, les aberrations de troisiốme degrộ ou plus ne le peuvent pas. Et
pourtant, les aberrations de degrộ ộlevộ peuvent avoir un impact significatif sur la vision, proportionnel
leur amplitude et leur position relative par rapport au sommet de la pyramide de Zernicke
21-23
. Parmi
les aberrations de degrộ ộlevộ, laberration de sphộricitộ est, de loin, la plus ộlevộe en termes dampli-
tude, tout en ộtant dun degrộ relativement faible
10-14
. Par ailleurs, parmi toutes les aberrations de degrộ
MD
Dộpartement
dophtalmologie et des
sciences de la vision
FACULTY OF MEDICINE
University of Toronto
Disponible sur Internet :
www.ophtalmologieconf erences.ca
élevé, l’aberration de sphéricité est la seule qui soit symétrique
en termes de rotondité et qui se prête donc, facilement, à une
correction par la création de LIO
2
4
.
Les LIO (asphériques) rectifiés par un front d’ondes
Les LIO sphériques standard ont une aberration de
sphéricité positive de 0,10 µm. On a, toutefois, démontré que
cette valeur est corrélée positivement avec le pouvoir
sphérique de l’implant
2
5
. Ainsi, les LIO de pouvoir élevé
induisent-ils un grand nombre d’aberrations de sphéricité.
Cette implication dans la création d’un nombre élevé d’aber-
rations de sphéricité a été démontrée dans une étude qui n’a
constaté aucune différence au niveau des FTMs entre les yeux
pseudophakiques à LIO sphériques et des yeux phakiques
appariés pour l’âge
2
6
. Dans une autre étude, on a montré que
des patients pseudophakiques présentaient une aberration de
sphéricité d’un degré supérieur à celle de sujets normaux, avec
des pupilles de taille supérieures à 5 mm
2
7
.
Le premier implant rectifié par un front d’ondes – le
Technis Z9000 – a été commercialisé en 2002 par Pharmacia.
La première étude publiée a montré un gain de 77,9 % au
niveau du pic mésopique de sensibilité au contraste, par
rapport à un implant sphérique standard
28,29
. Même dans des
conditions photopiques, la sensibilité au contraste a augmenté
de 23,4 % à 62,6 %
29,30
. Dans une étude conçue pour démon-
trer le bénéfice fonctionnel d’une sensibilité au contraste
accrue, les patients qui ont reçu un implant Technis ont
montré un temps de réponse aux obstacles plus court de 0,5
secondes, au cours d’une simulation de conduite
31
. Pas moins
de 30 études ont démontré la supériorité visuelle de l’implant
Technis par rapport aux LIO sphériques traditionnels. La Food
and Drug Administration des Etats Unis (FDA) a approuvé 3
LIO destinés à corriger l’aberration de sphéricité: le Technis Z
9000 (à présent chez AMO), l’AcrySof IQ (Alcon) et le SofPort
L161AO (B&L). Chacun d’entre eux offre un degré différent de
correction des aberrations de sphéricité, fondé à la fois sur la
philosophie et sur le brevet.
Les valeurs de l’aberration de sphéricité pour les LIOs
Technis, AcrySof IQ et SofPort sont, respectivement, de -0,27
µm, -0,20 µm et 0,0 µm. Le premier implant sphérique, le
Technis, a été conçu dans le but d’éliminer complètement
l’aberration de sphéricité. Quant à l’implant AcrySof IQ, il a été
conçu dans le but de simuler les yeux d’un adulte âgé de 20
ans chez qui l’implant n’élimine pas complètement l’aberration
de sphéricité positive dans la cornée et dont l’aberration nette,
dans le système optique, est de 0,10 µm. Plusieurs études ont
montré que cette aberration de sphéricité de degré faible est
associée à une acuité visuelle supérieure à la normale
(meilleure que 20/15)
32,33
. Ceci pourrait s’expliquer par le fait
que cette aberration de sphéricité résiduelle compense d’autres
aberrations de degré élevé existant dans le système optique de
l’œil. Dans un essai clinique randomisé masqué portant sur
120 yeux, les résultats obtenus avec l’implant AcrySof IQ ont
été meilleurs que ceux des implants AcrySof SA et AcrySof
Naturel (tous deux étant des implants sphériques), en termes
de sensibilité au contraste et de gêne à l’éblouissement
34
.
Quant à l’implant SofPort à front d’onde neutre, il a été conçu
afin d’atténuer certains des éventuels pièges et inconvénients
d’un implant correcteur des aberrations de sphéricité, comme
on en parlera plus loin.
Les limites des implants rectifiés par un front d’ondes
Bien que les LIO rectifiés par un front d’onde apportent, en
termes de vision, des bénéfices que personne ne conteste, il
importe que les chirurgiens en connaissent les limites et en
tiennent compte. Ainsi, un centrage parfait des l’implant
constitue un prérequis incontournable si l’on veut atteindre le
niveau de performance optique supérieur de ces implants : ce
qui veut dire que les avantages de l’implant Technis sont
perdus si cet implant est décentré de plus de 0,4 µm par
rapport à l’axe optique ou si son inclinaison est supérieure à
7°
3
5
. Il est donc impératif que le capsulorhexis soit rond, centré
et qu’il permette un recouvrement de la pupille sur 360°, afin
d’empêcher la migration de l’LIO, avec, pour finir, une fibrose
capsulaire. Indépendamment de la performance du chirurgien,
l’anatomie de l’oeil rend encore plus compliquée la détermina-
tion d’un centrage convenable. En effet, des études de popula-
tion ont montré que le centre de la pupille est décentré d’env-
iron 0,4 mm (écart type : 0,2 mm)
36-41
par rapport à l’axe
optique. De plus, cet axe optique ne coïncide généralement
pas avec l’axe visuel de l’œil
42
.
Par rapport à l’implant Technis, les exigences de centrage
concernant l’implant AcrySof IQ ne seront que légèrement
inférieures, la valeur de l’aberration de sphéricité de ce dernier
étant moindre. Quant à l’implant SofPort, son avantage réside
dans la robustesse de sa puissance optique, en présence d’un
décentrage. Sans aberration de sphéricité inhérente, l’implant
SofPort a donné de meilleurs résultats que l’implant Technis
dans les FTMs d’un modèle œil, lorsque les implants étaient
décentrés de plus de 0,15 mm, 0,30 mm et 0,38 mm, dans des
pupilles de 3 mm, 4 mm et 5 mm respectivement
43
.
Une aberration de sphéricité positive dans l’œil se traduira
par une réfraction subjective se rapprochant de la myopie
(étant donné que les rayons lumineux périphériques seront
focalisés en avant de la rétine, simulant ainsi un œil myope;
figure 2)
32
. L’élimination de l’aberration de sphéricité améliore
la qualité de l’image et en diminue le flou: mais elle réduit, de
manière significative, la profondeur du foyer pour les patients.
En comparant les implants AcrySof IQ et AcrySof SN, on a
constaté que l’Angle de Résolution Minimum (ARM), avec
correction de distance, était plus faible pour l’AcrySof IQ, (0,02
contre 0,03). Toutefois, pour les distances intermédiaires et
proches, l’ARM était significativement supérieur pour l’AcrySof
IQ (distance intermédiaire : 0,43 contre 0,33, distance proche:
0,51 contre 0,39)
44
. Le front d’onde étant neutre, l’implant
F
igure 1: Fonction transfert de modulation
Un objet sinusoïdal (à gauche) est projeté à travers un système
o
ptique et son image est ainsi générée (à droite). La capacité
d
’un système optique à maintenir le contraste est liée à la
fonction transfert de modulation (FTM), laquelle varie pour un
s
ystème optique donné quelconque, en fonction de la fréquence
spatiale de l’objet.
T
ableau 1: Technologie avancée des LIO monofocaux
F
irmes Implants rectifiés Implants bloquant Implants
p
ar un front les longueurs toriques
d
’ondes d’ondes courtes
(
valeur Z
4
0
)
(couleur)
A
dvanced Technis Z9000 TBA NA
M
edical Optic (-0,27 µm)
A
lcon AcrySof IQ AcrySof IQ (bleu) AcrySof
(-0,20 µm) AcrySof torique (bleu) torique
B
ausch SofPort SofPort LI61AO NA
&
Lomb LI61AO (violet)
vidu, est plus efficace. Mais alors que le concept de personna-
lisation est simple, sa mise en œuvre est complexe.
Tout d’abord, en effet, l’aberration cornéenne doit être
calculée. De nos jours, les appareils les plus couramment utili-
sés sont les aberromètres à front d’ondes et les unités
topographiques cornéennes; mais ces appareils sont chers, ce
qui peut en rendre l’accès difficile. Lorsqu’ils ont recherché
une méthode plus économique pour déterminer l’asphéricité
de la cornée, Beiko et col.
45
ont signalé, récemment, qu’on
ne pouvait pas utiliser de manière fiable, les lectures par
keratométrie cornéenne pour prédire une aberration de
sphéricité cornéenne.
Par ailleurs, on discute beaucoup pour savoir si l’as-
phéricité cornéenne est modifée par les plaies cornéennes
produites lors d’une intervention chirurgicale. Il est probable
qu’elle est dépendante de la chirurgie et, par conséquent, un
« facteur chirurgie » devrait être calculé pour l’aberration de
sphéricité, en plus des considérations sphéro-cylindriques.
Pour ce qui est de la personnalisation, la plus grande inter-
rogation et la plus grande controverse portent sur le résultat
visé. En tant que premier LIO asphérique, le Technis avait pour
objectif d’éliminer toutes les aberrations de sphéricité et sa
capacité à améliorer la fonctionnalité visuelle n’est pas
contestée. Cependant, les données disponibles permettent
d’affirmer, sans trop risquer de se tromper, qu’une aberration
de sphéricité de 0,1 µm est bénéfique. En effet, des études
menées sur la population ont démontré que ce niveau d’aber-
ration de sphéricité existe dans les yeux des sujets âgés de 20
ans. Par ailleurs, une étude menée sur des pilotes de l’aéron-
avale a montré qu’en même temps qu’une aberration de
sphéricité oculaire de 0,1 µm en moyenne, ils avaient une
acuité visuelle supérieure à la moyenne ainsi qu’une sensibilité
au contraste également supérieure à la moyenne
4
6
. Par ailleurs,
des données présentées, mais non publiées, par Beiko ont
également montré que des patients sélectionnés à 0,1 µm
obtenaient de meilleurs résultats que les patients non sélec-
tionnés, à pratiquement toutes les fréquences spatiales. Il
faudra probablement un certain temps avant que tous se
mettent d’accord sur le résultat visé. D’ici là, il reviendra au
chirurgien de déterminer ce qui fonctionnera le mieux entre
ses mains.
Les chirurgiens devraient envisager d’utiliser l’implant
SofPort dans les cas où un décentrage ou un basculement
serait à craindre à long terme, comme, par exemple, chez les
patients atteints du syndrome de pseudo-exfoliation ou de
zonulopathies. En tant qu’implant siliconé en trois éléments,
SofPort peut également être placé dans la sulcus, en présence
d’une rupture capsulaire postérieure et il est probablement
supérieur au Technis, dans ce scenario clinique, du fait de sa
solide performance optique en présence d’un décentrage.
L’implantation, dans la sulcus, de la plateforme d’AcrySof IQ,
implant acrylique en un seul élément, est contrindiquée.
Dernier élément d’hésitation entre ces trois implants: c’est
la présence de technologies de blocage de la lumière ciblant les
longueurs d’ondes courtes du spectre visible que l’on retrouve
dans AcrySof IQ et dans SofPor, qui bloquent respectivement le
bleu et le violet (voir la discussion ci-après).
Les implants filtrant les longueurs d’ondes courtes
Le fait qu’il faille empêcher les rayons lumineux poten-
tiellement nuisibles de pénétrer dans l’œil a été signalé par
Mainster en 1978 quand, en tant qu’interne de deuxième
année, il développa l’idée selon laquelle le rayonnement ultra-
violet (UV), connu pour sa phototoxicité vis-à-vis de l’oeil, était
transmis par les LIO utilisés à l’époque
47
. Dans les années 80,
les implants filtrants les UV furent rapidement adoptés et sont
devenus le standard en la matière.
SofPort fournit une profondeur de foyer d’environ 0,5 dioptries
avec l’aberration de sphéricité résiduelle de 0,27 µm retrouvée
dans la cornée.
La sélection des patients
Compte tenu de toutes les considérations théoriques, les
questions pratiques qui sont soulevées sont les suivantes:
quels sont les patients qui devraient recevoir une LIO
asphérique? Et si l’on doit poser un implant sur un patient,
quel implant faut-il utiliser?
Pour répondre à la première question, il est préférable de
préciser quels seront les sujets qui ne devraient pas bénéficier
des LIO rectifiés par un front d’ondes. Il pourrait s’agir des
patients dont les cornées produisent déjà une aberration de
sphéricité négative, notamment des patients dont les yeux ont
subi, antérieurement, une chirurgie de réfraction hyper-
métrope avec kératocône. Dans des yeux de ce type, les LIO
corrigés négativement ne feraient qu’accentuer les aberrations
de sphéricité existantes. En dehors de ces cas, n’importe quel
autre œil devrait pouvoir bénéficier de l’implantation d’une
LIO asphérique. Les autres éléments à prendre en compte sont
les besoins et les symptômes visuels des patients pris à titre
individuel. Ainsi, les sujets qui ont besoin d’une fonctionnalité
sous lumière faible (comme, par exemple, les chauffeurs de
camions) et ceux qui se plaignent d’éblouissements et de
halos sont ceux qui, probablement, apprécieront et béné-
ficieront le plus des avantages des LIO asphériques. Bien que
statistiquement significative, la baisse de la profondeur du
foyer n’a probablement, en pratique, qu’une signification
minime étant donné que les patients qui reçoivent des
implants monofocaux ont besoin, dans leur quasi totalité,
d’une correction pour la lecture en vision proche. D’après
l’opinion de l’auteur du présent article, la supériorité de la
sensibilité au contraste que confèrent les LIO asphériques
dépasse de loin les soucis relatifs à la profondeur du focus.
C’est la raison pour laquelle il encourage tous les patients à
envisager une LIO asphérique, à moins qu’ils ne soient des
candidats appropriés pour un implant torique ou qu’ils
souhaitent recevoir un implant multifocal
Répondre à la deuxième question qui porte sur la sélec-
tion de LIO asphériques est plus problématique. La plupart
s’accordent à penser que l’approche « une seule taille pour tous
les cas » n’est pas idéale et que la personnalisation des LIOs
asphériques, basée sur l’asphéricité cornéenne de chaque indi-
F
igure 2: Myopie subjective à partir d’une aberration de
s
phéricité positive. En cas d’aberration de sphéricité positive,
l
es rayons lumineux marginaux se trouvent focalisés en avant du
point focal paraxial, créant ainsi une appréciation subjective de
m
yopie. Le degré de focus devrait être proportionnel à la taille
de la pupille et, par conséquent, soumis, en partie, à des
c
onditions d’éclairage.
A
berration de
sphéricité
Point focal marginal
Point focal paraxial
Au cours des années 90, des études tant fondamen-
tales qu’épidémiologiques montrèrent que la lumière
bleue contribuait vraisemblablement à la dégénérescence
maculaire liée à l’âge (DMLA)
48
. Ceci accéléra l’introduc-
tion d’implants bloquant la lumière bleue et correspon-
dant à la capacité du cristallin d’un adulte jeune à
bloquer le rayonnement ultraviolet et à atténuer la
lumière bleue
49
.
En 2003, la FDA autorisa Alcon à commercialiser l’im-
plant AcrySof Natural pour fin de correction visuelle de
l’aphakie chez les patients adultes (cet implant n’a pas été
approuvé dans l’indication spécifique: « prévention ou
atténuation de la DMLA ». A présent, les implants chro-
mophores « prestige » d’Alcon portent tous une marque
ombrelle commune: c’est le cas, notamment, d’AcrySof IQ,
d’AcrySof Toric et d’AcrySof Restor. Le concept d’implant
bloquant la lumière bleue a soulevé d’innombrables
controverses à propos, en particulier, de sa capacité à
protéger l’œil de la DMLA et de la possibilité de dégrada-
tion de la fonction visuelle due à une baisse de la trans-
mission de la lumière bleue à la rétine.
La lumière bleue, la DMLA et
la chirurgie de la cataracte
La lipofuscine est un sous produit toxique de la
phagocytose incomplète des photorécepteurs qui se
dépose dans l’épithélium pigmentaire rétinien (EPR) et
qui est impliqué dans la pathogénèse de la DMLA
50,51
. Les
efforts pour identifier les constituants de la lipofuscine
ont permis d’isoler un fluorophore, connu sous le nom de
A2E, dont on a montré qu’il était très fortement excité par
la lumière bleue
5
2-56
.
Au fur et à mesure que les implants vieillissent, ils
deviennent naturellement plus jaunes, ce qui augmente
leur capacité à filtrer la lumière bleue et à l’empêcher d’at-
teindre la rétine. Lorsqu’on extrait un implant et qu’on le
remplace par un nouvel implant clair, au cours d’une
chirurgie de la cataracte, on peut, théoriquement, craindre
que la rétine soit, par la suite, exposée à des niveaux
élevés de lumière bleue, plus élevés qu’à aucun autre
moment de l’existence. Dhillon et col., ont estimé que l’ab-
sorption de la lumière par l’A2E augmentait, de ce fait, de
5 fois
57
. Une extrapolation logique de cet argument
permettrait de conclure que la fréquence de la DMLA
devrait augmenter après une chirurgie de la cataracte. Il
existe, cependant, d’excellentes études qui soit soutien-
nent soit contredisent cette affirmation. Ainsi, 6 des 8 prin-
cipales études épidémiologiques conçues pour étudier le
risque de DMLA associé à une exposition à la lumière
n’ont trouvé aucune corrélation
58-63
et une de ces études
a même mis en évidence une relation inverse
60
. L’étude
AREDS n’a pas non plus trouvé de corrélation entre la
chirurgie et la DMLA exsudative
63
. Toutefois, Pollack et
col., ont signalé un quadruplement du taux de conversion
de la forme sèche en forme humide de la DMLA au cours
de la première année qui a suivi une chirurgie de la
cataracte
64
. En outre, une analyse en pool de l’étude
Beaver Dam Eye et de l’étude Blue Mountain Eye Study a
montré que le risque de DMLA avancée augmentait 5 ans
après une chirurgie de la cataracte
65
.
Ces études indiquent que la corrélation entre la
chirurgie de la cataracte et la DMLA demeure incertaine
et que, par ailleurs, si cette corrélation existe, on ne sait
pas si elle est due à l’exposition à la lumière bleue ou à
d’autres médiateurs inflammatoires libérés pendant ou
après l’opération. Une étude in vitro de Sparrow et coll.
53
a
Ophtalmologie
Conférences scientifiques
montré une diminution significative de la mort (de 72 %
à 82 %) des cellules de l’EPR mises en culture et exposées
à la lumière bleue, verte et blanche filtrées à travers un
implant AcrySof Naturel, par rapport à de nombreux
autres implants clairs. Ces résultats doivent, cependant,
être définitivement confirmés par des études in vivo; ce
qui nécessitera plusieurs années et de nombreux patients.
La Performance Visuelle
L’introduction de l’implant Acrysof Natural a soulevé
des inquiétudes quant à une dégradation possible de la
fonction visuelle, en particulier de la vision scotopique,
chez les patients dont la lumière bleue serait atténuée.
Comble de l’ironie, l’un des adversaires les plus déter-
minés de l’implant bloquant la lumière bleue fut
Mainster, celui là même qui a communiqué sur les deux
types de rétinopathie photique: la phototoxicité bleu-vert
et la phototoxicité UV-bleue
66
: la première étant médiée
par la rhodopsine et la seconde par la lipofuscine. Cibler
la toxicité bleu-vert reviendrait à limiter sévèrement tant
la vision scotopique que la vision photopique et, de ce
fait, l’objectif consistant à prévenir la rétinopathie
photique devrait se concentrer sur cette dernière. Selon
Mainster, le rayonnement UV est responsable de 67 % de
la phototoxicité des UV-bleu et n’est pas perceptible par
l’œil humain. Par conséquent, bloquer le rayonnement
UV présente un réel intérêt. En effet, la lumière violette,
avec des longueurs d’ondes comprises entre 400 et
440 nm, représente 18 % de la phototoxicité aux UV -
bleu, alors qu’elle ne fournit que 10 % de la vision
scotopique
67
. Ceci va dans le même sens qu’une recherche
qui suggère que l’absorption de l’A2E diminue rapidement
à mesure que les longueurs d’ondes augmentent au-delà
de 440 nm
53,57
. Enfin, la lumière bleue (440-500 nm)
représente seulement 14 % de la phototoxicité aux UV-
bleu, alors qu’elle apporte 35 % de la vision scotopique,
étant donné que le pic de sensibilité est à 507 nm pour
les bâtonnets. C’est là le rationnel qui est derrière les
implants bloquant le violet qui ont été et qui vont être
mis sur le marché respectivement par B & L et AMO (l’im-
plant SofPort arrive, actuellement, avec une technologie
de blocage du violet, alors qu’AMO doit encore commer-
cialiser sa gamme d’implants bloquant le violet, mais leur
introduction est imminente).
On rapporte que la quantité de lumière bleue
bloquée par l’implant Acrysof Natural se situe entre 14 %
et 34 %. Les conséquences théoriques en sont à la fois
évidentes et subtiles. La réduction de l’apport de lumière
bleue dans les cas potentiels de vision scotopique
entraîne une diminution de la fonction visuelle au cours
des activités pratiquées sous de faibles niveaux de
lumière (conduite de nuit ou promenade nocturne
autour de la maison, par exemple). Les effets potentiels
sur le rythme circadien sont moins évidents. Le rythme
circadien, soumis à la lumière, est contrôlé par la
melanopsine, un pigment photosensible à la lumière
bleue, présent dans les cellules ganglionnaires de la
rétine. On a montré que les cellules ganglionnaires de la
rétine régulent les niveaux de mélatonine sécrétée par la
glande pinéale, qui module le cycle veille – sommeil et
celui de la température corporelle centrale. Lorsqu’elle est
exposée à la lumière, la mélanopsine est stimulée et la
mélatonine est supprimée. En revanche, au crépuscule ou
dans l’obscurité, en l’absence de stimulation de la
mélanopsine, la sécrétion de mélatonine augmente. Le
rythme circadien est perturbé dans de nombreuses
maladies touchant les personnes âgées, comme l’in-
somnie, la dépression, la maladie coronarienne, le cancer,
la démence, et la maladie d’Alzheimer. Réduire le pour-
centage de transmission de la lumière bleue à la rétine
pourrait, ainsi, augmenter les troubles du rythme circa-
dien, et contribuer au développement d’autres maladies
6
8
.
Alors que l’implant Acrysof Natural peut bloquer
plus de lumière bleue que les LIOs standards qui ne
bloquent que les UV, il continue de transmettre plus de
lumière, au dessus de 500 nm, que le cristallin d’un jeune
adulte humain moyen dont la capacité de transmission,
dans la région bleue-verte, est d’environ 60%
6
9
. Deux
essais prospectifs, randomisés, masqués, ont été menés
par Pandita et col
34
et par Marshall et col
70
sur 120 et 300
patients respectivement, dans le but de comparer la sensi-
bilité au contraste et la perception des couleurs entre
l’implant AcrySof SA60 (un implant acrylique clair en une
pièce) et l’implant AcrySof Natural. Aucun des deux
essais n’a montré de différence significative entre ces
deux implants. Espindle et coll
71
ont publié des données
relatives à la vision, à l’état de santé et à la qualité de vie
recueillies sur des patients ayant reçu ou non des
implants bilatéraux bloquant le bleu. Cette étude a
évalué la vision générale, les activités de près, les activités
de loin, la conduite (en particulier la conduite de nuit), la
santé mentale, la vision périphérique et les échelles de
difficulté des rôles, mais n’a relevé aucune différence
significative entre les groupes.
Bien qu’il y ait de bons arguments théoriques contre
les implants bloquant le bleu, du point de vue de la
performance visuelle, les essais cliniques n’ont pas réussi
à corroborer ces assertions. Quant aux arguments en
faveur des implants bloquant le violet, ils sont, certes,
forts, mais dans la mesure où ces implants ne sont entrés
que récemment sur le marché, on ne dispose que de peu
de littérature pour documenter leur performance, par
rapport, notamment, à leurs homologues qui bloquent le
bleu.
Les implants toriques
En vertu des principes discutés dans la partie
consacrée aux implants asphériques, plus une aberration
est proche du sommet de la pyramide de Zernicke et plus
son effet sur la dégradation optique sera important. En
tant qu’aberration de faible degré, l’astigmatisme a des
conséquences significatives s’il n’est pas corrigé après
l’opération. Jusqu’à récemment, la seule option qui exis-
tait pour prendre en charge un astigmatisme cornéen
significatif consistait à pratiquer des incisions de relâche-
ment au niveau du limbe (IRL), pendant ou après l’opéra-
tion et des ablations post-opératoires. Alcon a récemment
commercialisé des implants toriques présentés sur la
plateforme acrylique en une pièce AcrySof.
Pour être optiquement performant, la LIO torique
doit réussir un excellent centrage et avoir, en plus, une
rotondité précise. Cette rotondité est obtenue par
marquage de l’axe souhaité du cylindre correcteur avant
l’intervention chirurgicale au niveau du limbe puisqu’une
cyclotorsion de l’œil se produit fréquemment en cours
d’intervention, empêchant ainsi la détermination précise,
peropératoire, de l’axe. L’implant possède 3 points gravés
à chaque jonction haptique – optique, pour figurer l’axe
cylindrique qui doit être aligné avec le marquage
limbique.
Alcon a crée un site internet : www.acrysoftoric-
calculator.com dans lequel les valeurs kératométriques
préopératoires, la LIO sphérique calculée, ainsi que le
facteur chirurgical sont introduits afin de déterminer la
puissance sphéro-cylindrique de la LIO torique. Le
Tableau 2 comporte une liste de lentilles correspondant à
différents degrés d’astigmatisme. Par ailleurs, ce site
internet fournit une illustration en image de l’alignement
correct de l’implant au sein de l’œil qu’il est utile d’af-
ficher dans la salle d’opération, de sorte que le chirurgien
puisse s’assurer que l’implant a bien pivoté pour prendre
une position correcte. On a estimé que chaque degré de
rotation par rapport au bon axe entraînait une perte de
3,3 % du pouvoir du cylindre de l’implant. Un vaste essai
a montré que la rotation médiane de l’implant torique
AcrySof, à 6 mois, était de 0,6°, allant de 0,1° à 1,8°, ce qui
montre sa stabilité rotatoire
7
2
.
Les patients ne devraient être éligibles à un implant
torique que si les méridiens horizontaux et verticaux sont
séparés d’environ 90°, ce que la kératométrie manuelle
pourra déterminer. Par ailleurs, l’astigmatisme devrait
suivre un modèle symétrique, c’est à dire avoir la forme
d’un nœud papillon ou d’un triangle, ce que la topogra-
phie cornéenne permet de vérifier. Au cours de l’inter-
vention, l’enveloppe capsulaire doit obligatoirement être
intacte et une capsulorhexis continue curviligne doit être
présente.
Résumé
Avec toute la technologie mise à la disposition des
patients et des chirurgiens, il est probable que le débat
sur les différentes options de LIO prend plus de temps
que l’explication de l’opération de la cataracte elle-même.
Dans un futur relativement proche, les LIO seront proba-
blement personnalisés pour chaque patient, en se fondant
sur leur image particulière sur front d’ondes, semblable à
l’ablation personnalisée, dans la chirurgie de la réfraction.
Jusque là, plus nous en apprendrons sur les caractéris-
tiques des implants qui apportent la meilleure vision
fonctionnelle à nos patients et plus nous aurons de vari-
ables à prendre en compte à l’heure du choix et de la
recommandation d’une LIO particulier à un patient donné.
Baseer U. Khan (FRCS)C est chargé de cours dans le
département d’ophtalmologie de l’université de Toronto.
Références:
1. Packer M, Fine IH, Hoffman RS. Wavefront technology in cataract surgery. Curr
Opin Ophthalmol 2004;15(1):56-60.
2. Owsley C, Sloane M. Contrast sensitivity, acuity, and the perception of “real world”
targets. Br J Ophthalmol 1987;71:791-796.
3. Ginsburg AP, Evans DW, Sekule R, Harp SA: Contrast sensitivity predicts pilots’ per-
formance in aircraft simulators. Am J Optom Physiol Opt 1982;59:105-109.
4. Rubin GS, Bandeen Roche K, Huang GH, et al. The association or multiple visual
impairments with self-reported visual disability: SEE project. Invest Ophthalmol Vis
Sci 2001;42:64-72.
5. Lord SR, Menz HB. Visual contributions to postural stability in older adults. Geron-
tology 2000;46:306-310.
6. Owsley C, Stalvey BT, Wells J, et al. Visual risk factors for crash involvement in older
drivers with cataract. Arch Ophthalmol 2001;119:881-887.
7. Lord SR, Dayhew J. Visual risk factors for falls in older people. J Am Geriatr Soc
2001;49:676-677.
8. Campbell FW, Green DG. Optical and retinal factors affecting visual resolution. J
Physiol 1965;181:576-593.
Ophtalmologie
Conférences scientifiques
T
ableau 2: Modèles AcrySof toriqes
M
odèle Recommander les
A
crySof torique
Pouvoir du cylindre
g
ammes de correction
A
u plan Au plan de de l’astygmatisme
de l’LIO la cornée cornéen
S
N60T3 1,50 D 1,03 D 0,75 – 1,50 D
S
N60T4 2,25 D 1,55 D 1,50 – 2,00 D
SN60T5 3,00 D 2,06 D 2,00 D et au-dessus
9
. Schwiegerling J. Theoretical limits to visual performance. Surv Ophthalmol 2000;45:139-
146.
10. Altmann GE. Wavefront-customized intraocular lenses. Curr Opin Ophthalmol
2004;15(4):358-64.
11. Oshika T, Klyce SD, Applegate RA, et al. Changes in corneal wavefront aberrations with
a
ging. Invest Ophthalmol Vis Sci 1999;40:1351-1355
12. Guirao A, Redondo M, Artal P: Optical aberrations of the human cornea as a function of age. J
Opt Soc Am A Opt Image Sci Vis 2000;17:1697-1702.
13. He JC, Gwiazda J, Thorn F, et al. Wave-front aberrations in the anterior corneal surface and
the whole eye. J Opt Soc Am 2003;20:1155-1163.
1
4. Wang L, Dai E, Koch DD, et al. Optical aberrations of the human anterior cornea. J Cataract
Refract Surg 2003;29:1514-1521.
15. Tomlinson A, Hemenger RP, Garriott R. Method for estimating the spherical aberration of
the human crystalline lens in vivo. Invest Ophthalmol Visual Sci 1993;34:621-629.
1
6. Glasser A, Campbell MCW. Presbyopia and the optical changes in the human crystalline
lens with age. Vision Res 1998;38:209-229.
17. Smith G, Cox MJ, Calver R, et al. The spherical aberrations of the crystalline lens of the
human eye. Vision Res 2001;41:235-243.
18. He JC, Ong E, Gwiazda J, et al. Wavefront aberrations in the cornea and the whole eye.
I
nvest Ophthalmol Visual Sci 2000;41:s105.
19. Artal P, Guirao A, Berrio E, et al. Compensation of corneal aberrations by the internal optics
in the human eye. J Vision 2001;1:1–8.
20. Artal P, Berrio E, Guirao A, et al. Contribution of the cornea and internal surfaces to the
change of ocular aberrations with age. J Opt Soc Am A 2002;19:137-143.
2
1. Thibos LN, Applegate RA, Schwiegerling JT, Webb R. VSIA Standards Taskforce Members.
Vision Science and its Applications: Standards for reporting the optical aberrations of the
eyes. J Refract Surg 2002;18:S652-S660.
22. Chen L, Singer B, Guirao A, et al. Image metrics for predicting subjective image quality.
Optom Vis Sci 2005;82:358-369.
2
3. Charman WN. The Charles W Prentice Award Lecture 2005: optics of the human eye:
progress and problems. Optom Vis Sci 2006;83:335-345.
24. Bellucci R, Morselli S. Optimizing higher-order aberrations with intraocular lens technol-
ogy. Curr Opin Ophthalmol 2007;18(1):67-73.
25. Padmanabhan P, Yoon G, Porter J, et al. Wavefront aberrations in eyes with Acrysof monofo-
c
al intraocular lenses. J Refract Surg 2006;22:237-242.
26. Navarro R, Ferro M, Artal P, et al. Modulation transfer functions of eyes implanted with
intraocular lenses. Appl Opt 1993;32:6359-6367.
27. Miller JM, Anwaruddin R, Straub J, Schwiegerling J. Higher order aberrations in normal,
dilated, intraocular lens, and laser in situ keratomileusis corneas. J Refract Surg 2002;
1
8:S579-S583.
28. Packer M, Fine IH, Hoffman RS, Piers PA. Prospective randomized trial of an anterior sur-
face modified prolate intraocular lens. J Refract Surg 2002;18:692-696.
29. Packer M, Fine IH, Hoffman RS. Functional vision, wavefront sensing, and cataract surgery.
Int Ophthalmol Clin 2003;43:79-91.
3
0. Packer M, Fine IH, Hoffman RS, Piers PA. Improved functional vision with a modified pro-
late intraocular lens. J Cataract Refract Surg 2004;30:986-992.
31. Packer M. Evaluation of a modified prolate surface IOL with the WASCA Analyzer. Publication
No: 000000-1276-350. Jena, Germany: Carl Zeiss Meditec;2003.
32. Cheng X, Bradley A, Thibos LN. Predicting subjective judgment of best focus with objective
i
mage quality metrics. J Vision 2004;4:310-321.
33. Levy Y, Segal O, Avni I, Zadok D. Ocular higher-order aberrations in eyes with supernormal
vision. Am J Ophthalmol 2005;139:225-228.
34. Pandita D, Raj SM, Vasavada VA, et al. Contrast sensitivity and glare disability after implan-
tation of AcrySof IQ Natural aspherical intraocular lens: prospective randomized masked
c
linical trial. J Cataract Refract Surg 2007;33(4):603-10.
35. Holladay JT, Piers PA, Koranyi G, et al. A new intraocular lens design to reduce spherical
aberration of pseudophakic eyes. J Refract Surg 2002;18:683-691.
36. Hayashi K, Harada M, Hayashi H, et al. Decentration and tilt of polymethyl methacrylate,
silicone, and acrylic soft intraocular lenses. Ophthalmology 1997;104:793-798.
3
7. Wang M-C, Woung L-C, Hu C-Y, et al. Position of poly(methyl methacrylate) and silicone
intraocular lenses after phacoemulsification. J Cataract Refract Surg 1998;24:1653-1657.
38. Hayashi K, Hayashi H, Nakao F, et al. Comparison of decentration and tilt between one
piece and three piece polymethyl methacrylate intraocular lenses. Br J Ophthalmol 1998;
82:419-422.
39. Kimura W, Kimura T, Sawada T, et al. Postoperative decentration of three piece silicone
intraocular lenses. J Cataract Refract Surg 1996;22:1277-1280.
40. Hwang IP, Clinch TE, Moshifar M, et al. Decentration of 3-piece versus platehaptic silicone
intraocular lenses. J Cataract Refract Surg 1998;24:1505-1508.
41. Schwenn O, Kottler U, Krummenauer F, et al. Effect of large positioning holes on capsule
fixation of plate-haptic intraocular lenses. J Cataract Refract Surg 2000;26:1778-1785.
42. Rynders M, Lidkea B, Chisholm W, et al. Statistical distribution of foveal transverse chro-
matic aberration, pupil centration, and angle in a population of young adult eyes. J Opt Soc
Am A 1995;12:2348-2357.
43. Altmann GE, Nichamin LD, Lane SS, Pepose JS. Optical performance of 3 intraocular lens
designs in the presence of decentration. J Cataract Refract Surg 2005;31(3):574-85.
44. Rocha KM, Soriano ES, Chamon W, Chalita MR, Nose W. Spherical aberration and depth of
focus in eyes implanted with aspheric and spherical intraocular lenses a prospective ran-
domized study. Ophthalmology 2007;18. [Epub ahead of print]
45. Beiko GH, Haigis W, Steinmueller A. Distribution of corneal spherical aberration in a com-
prehensive ophthalmology practice and whether keratometry can predict aberration val-
ues. J Cataract Refract Surg 2007;33(5):848-58.
46. Grimson JM, Schallhorn SC, Kaupp SE. Contrast sensitivity: establishing normative data for
use in screening prospective naval pilots. Aviat Space Environ Med 2002;73(1):28-35.
47. Mainster MA. Spectral transmittance of intraocular lenses and retinal damage from intense
light sources. Am J Ophthalmol 1978;85(2):167-70.
48. Taylor HR, West S, Munoz B, Rosenthal FS, Bressler SB, Bressler NM. The long-term effects
of visible light on the eye. Arch Ophthalmol 1992;110(1):99-104.
49. Braunstein RE, Sparrow JR. A blue-blocking intraocular lens should be used in cataract
surgery. Arch Ophthalmol 2005;123(4):547-9.
50. Delori FC, Goger DG, Dorey CK. Age-related accumulation and spatial distribution of lipo-
fuscinin RPE of normal subjects. Invest Ophthalmol Vis Sci 2001;42:1855-1866.
© 2007 Département d’ophtalmologie et des sciences de la vision, Faculté de médecine, Université de Toronto, seul responsable du contenu de cette publication. Édition : SNELL Communication
Médicale Inc. avec la collaboration du Département d’ophtalmologie et des sciences de la vision, Faculté de médecine, Université de Toronto.
MD
Ophtalmologie – Conférences scientifiques est une marque
déposée de SNELL Communication Médicale Inc. Tous droits réservés. L’administration d’un traitement thérapeutique décrit ou mentionné dans Ophtalmologie – Conférences scientifiques doit toujours
être conforme aux renseignements d’ordonnance approuvés au Canada. SNELL Communication Médicale se consacre à l’avancement de l’éducation médicale continue de niveau supérieur.
L’élaboration de cette publication a bénéficié d’une subvention à l’éducation de
Novartis Ophthalmics
130-029F
Les avis de changement d’adresse et les demandes
d’abonnement pour Ophtalmologie – Conférences Scientifiques
doivent être envoyés par la poste à l’adresse C.P. 310, Succur-
sale H, Montréal (Québec) H3G 2K8 ou par fax au (514) 932-
5114 ou par courrier électronique à l’adresse
Veuillez vous référer au bulletin Oph-
talmologie – Conférences Scientifiques dans votre correspon-
dance. Les envois non distribuables doivent être envoyés à
l’adresse ci-dessus.
Poste-publications #40032303
SNELL
La version française a été révisée par le professeur Pierre Lachapelle,
Montréal.
Le D
r
Khan déclare qu’il n’a aucune divulgation à faire en association
avec le contenu de cet article.
5
1. Holz FG, Bellman C, Staudt S, Schutt F, Volcker HE. Fundus autofluorescence and develop-
ment of geographic atrophy in age-related macular degeneration. Invest Ophthalmol Vis Sci
2001;42:1051-1056.
52. Sparrow JR, Nakanishi K, Parish CA.The lipofuscin fluorophore A2E mediates blue light-
induced damage to retinal pigmented epithelial cells. Invest Ophthalmol Vis Sci 2000;
4
1:1981-1989.
53. Sparrow JR, Cai B. Blue light-induced apoptosis of A2E-containing RPE: involvement of cas-
pase-3 and protection by Bcl-2. Invest Ophthalmol Vis Sci 2001;42:1356-1362.
54. Sparrow JR, Zhou J, Ben-Shabat S, Vollmer H, Itagaki Y, Nakanishi K. Involvement of oxida-
tive mechanisms in blue light induced damage to A2E-laden RPE. Invest Ophthalmol Vis Sci
2
002;43:1222-1227.
55. Sparrow JR, Vollmer-Snarr HR, Zhou J, et al. A2E-epoxides damage DNA in retinal pigment
epithelial cells: vitamin E and other antioxidants inhibit A2E-epoxide formation. J Biol
Chem 2003;278:18207-18213.
5
6. Sparrow JR, Zhou J, Cai B. DNA is a target of the photodynamic effects elicited in A2E-laden
RPE by blue light illumination. Invest Ophthalmol Vis Sci 2003;44:2245-2251.
57. Dillon J, Zheng L, Merriam JC, Gaillard ER. Transmission of light to the aging human retina:
possible implications for age related macular degeneration. Exp Eye Res 2004;79(6):753-9.
58. The Eye Disease Case-Control Study Group. Risk factors for neovascular age-related macu-
l
ar degeneration. Arch Ophthalmol 1992;110(12):1701-8.
59. Hirvela H, Luukinen H, Laara E, Sc L, Laatikainen L .Risk factors of age-related maculopathy
in a population 70 years of age or older. Ophthalmology 1996;103(6):871-7.
60. Darzins P, Mitchell P, Heller RF. Sun exposure and age-related macular degeneration. An
Australian case-control study. Ophthalmology 1997;104(5):770-6.
6
1. Delcourt C, Carriere I, Ponton-Sanchez A, et al; POLA Study Group.Light exposure and the
risk of age-related macular degeneration: the Pathologies Oculaires Liees a l’Age (POLA)
study. Arch Ophthalmol 2001;119(10):1463-8.
62. McCarty CA, Mukesh BN, Fu CL, Mitchell P, Wang JJ, Taylor HR. Risk factors for age-related
maculopathy: the Visual Impairment Project. Arch Ophthalmol 2001;119(10):1455-62.
6
3. Clemons TE, Milton RC, Klein R, et al; Age-Related Eye Disease Study Research Group. Risk
factors for the incidence of Advanced Age-Related Macular Degeneration in the Age-
Related Eye Disease Study (AREDS) AREDS report no. 19. Ophthalmology 2005;112(4):533-9.
64. Pollack A, Bukelman A, Zalish M, Leiba H, Oliver M. The course of age-related macular
degeneration following bilateral cataract surgery. Ophthalmic Surg Lasers 1998;29(4):286-94.
6
5. Klein R, Klein BEK, Wong TY, Tomany SC, Cruickshanks KJ. The association of cataract and
cataract surgery with the long-term incidence of age-related maculopathy. Arch Ophthal-
mol 2002;120:1551-1558.
66. Mainster MA, Sparrow JR. How much blue light should an IOL transmit? Br J Ophthalmol
2003;87(12):1523-9.
6
7. Mainster MA. The spectra, classification, and rationale of ultraviolet-protective intraocular
lenses. Am J Ophthalmol 1986;102(6):727-32.
68. Pauley SM. Lighting for the human circadian clock: recent research indicates that lighting
has become a public health issue. Med Hypotheses 2004;63(4): 588-96.
69. Boettner EA, Wolter JR. Transmission of the ocular media. Invest Ophthalmol 1962;1:776-783.
7
0. Marshall J, Cionni RJ, Davison J, et al. Clinical results of the blue-light filtering AcrySof
Natural foldable acrylic intraocular lens. J Cataract Refract Surg 2005;31(12):2319-23.
71. Espindle D, Crawford B, Maxwell A, et al. Quality-of-life improvements in cataract patients
with bilateral blue light-filtering intraocular lenses: clinical trial. J Cataract Refract Surg
2005;31(10):1952-9.
7
2. Weinand F, Jung A, Stein A, Pfutzner A, Becker R, Pavlovic S. Rotational stability of a single-
piece hydrophobic acrylic intraocular lens: new method for high-precision rotation control.
J Cataract Refract Surg 2007;33(5):800-3.
Réunion scientifique à venir
10 au 13 novembre 2007
111
e
Réunion annuelle de l’American Academy
of Ophthalmology
Nouvelle-Orléans, Louisianne
Renseignements : www.aao.org
Ophtalmologie
Conférences scientifiques
N
OVEMBRE/DÉCEMBRE 2006
Volume 4, numéro 6
COMPTE RENDU DES CONFÉRENCES
SCIENTIFIQUES DU DÉPARTEMENT
D’OPHTALMOLOGIE ET
DES SCIENCES DE LA VISION,
FACULTÉ DE MÉDECINE,
UNIVERSITÉ DE TORONTO
Département d’ophtalmologie
et des sciences de la vision
Faculté de médecine
Université de Toronto
60 Murray St.
Bureau 1-003
T
oronto (Ontario) M5G 1X5
Le contenu rédactionnel d’Ophtalmologie –
Conférences scientifiques
est déterminé
exclusivement par le Département
d’ophtalmologie et des sciences de la vision,
Faculté de médicine, Université de T
oronto.
Département d’ophtalmologie
et des sciences de la vision
Jeffrey Jay Hurwitz, M.D., Rédacteur
Professeur et président
Martin Steinbach, Ph.D.
Directeur de la recherche
The Hospital for Sick Children
Elise Heon, M.D.
Ophtalmologiste en chef
Mount Sinai Hospital
Jeffrey J. Hurwitz, M.D.
Ophtalmologiste en chef
Princess Margaret Hospital
(Clinique des tumeurs oculaires)
E. Rand Simpson, M.D.
Directeur, Service d’oncologie oculaire
St. Michael’s Hospital
Alan Berger, M.D.
Ophtalmologiste en chef
Sunnybrook Health Sciences Centre
W
illiam S. Dixon, M.D.
Ophtalmologiste en chef
The Toronto Hospital
(Toronto Western Division and
Toronto General Division)
Robert G. Devenyi, M.D.
Ophtalmologiste en chef
Les progrès réalisés dans la greffe de cornée
PAR DAVID S. ROOTMAN, M.D., FRCSC
Il y a 101 ans, le Dr. Eduard Zirm effectuait, avec succès, la première kératoplastie
pénétrante (PKP)
1
. Il avait opéré sur les yeux d’ un ouvrier agricole itinérant qui avait
été rendu aveugle par de l’alcali. Au cours des 50 ans qui suivirent, les progrès tech-
niques réalisés par les grands maîtres en la matière, tels que Filitov, Castroviejo et
d’autres, nous permirent d’entrer dans l’ère de la réussite des greffes de cornée, ère
dans laquelle un taux de succès de 90 % est considéré comme normal
2,3
(Figure 1). Les
progrès réalisés dans la compréhension de l’immunologie et du rejet cornéen, dans
les instruments microchirurgicaux et dans les sutures en ont fait une réalité, tout
comme les banques d’yeux modernes qui ont fait partie intégrante de ce progrès.
Toutefois, la technique utilisée pour la greffe standard de cornée par pénétration est
restée largement inchangée au cours des 40 à 50 dernières années et les greffes de
cornée lamellaires, bien que popularisées au siècle dernier par des médecins tels que
Von Hippel, n’ont pas connu un grand succès, du fait des problèmes posés par la clarté
de l’interface
4
. Par conséquent, alors que les progrès réalisés au niveau de la rétine, du
glaucome et d’autres sous-spécialités avançaient à pas de géant, les changements au
niveau de la chirurgie cornéenne ont été plus lents. Récemment, cependant, cette ten-
dance s’est inversée grâce au développement de nouvelles techniques et de nouveaux
instruments pour la greffe de cornée. Ce numéro d’
Ophtalmologie – Conférences scien-
tifiques
passe en revue les progrès réalisés dans la greffe de cornée.
La transplantation endothéliale
Une fois reconnue l’importance de l’endothélium cornéen en tant que pompe à eau
pour la cornée, le recours à la kératoplastie transfixiante pour les affections de l’en-
dothélium, devint le traitement de choix. Des maladies telles que la dystrophie cornéenne
de Fuchs, l’œdème cornéen aphaque et, plus tard, l’œdème cornéen pseudo-phaque, dev-
inrent les causes prédominantes de l’atteinte de l’endothélium et de la faiblesse de la
vision due à un astigmatisme irrégulier et à une opacification de la cornée. Tout ceci se
passait peu de temps avant que les médecins leaders d’opinion en ophtalmologie, tels que
Jose et Joaquin Barraquer de Barcelone et de Bogota, eurent réalisé que le fait de remplacer
intégralement la cornée - alors que seuls les 20 microns postérieurs étaient atteints – pou-
vait ne pas constituer la meilleure option. C’est ainsi qu ils conçurent la greffe « partielle »,
lamellaire, pratiquée sous un lambeau, pour remplacer le stroma et l’
endothélium
postérieurs. Ceci fut facilité par l’utilisation d’un microkératome, un instrument semblable
au dermatome pour la peau, qui a permis de pratiquer la résection légère de la surface
cornéenne, afin de former un lambeau superficiel et la trépanation interne d’un disque
central et son remplacement
5
.
Bien que ce concept fut révolutionnaire, il ne semble pas s’être imposé et ces idées
restèrent en sommeil pendant de nombreuses années, alors que dans le monde entier
, les
chirurgiens de la cornée continuaient de pratiquer de kératoplastie pénétrante et non
transfi
xante (c’est à dire PKP) pour remplacer l’endothélium. Pourtant, en dépit de ses
qualités et du succès honnête qu’
elle connaissait, surtout depuis la commercialisation des
corticoïdes topiques, cette méthode laissait certains problèmes sans solutions. Ainsi, par
exemple, un greffon clair aurait été inutile pour le patient, si une grande partie de son
astigmatisme, régulier ou irrégulier, avait persisté (Figure 1 et 2). De même, le rejet qui
survenait dans moins de 10 % des cas, fut souvent à l’
origine d’un échec de la greffe. De
MD
Département
d’ophtalmologie et des
sciences de la vision
FACULTY OF MEDICINE
University of Toronto
Disponible sur Inter
net à :
www
.ophtalmologieconferences.ca
même, la fragilisation de la cornée, qu’un léger trau-
matisme pouvait facilement déchirer, a posé des prob-
lèmes à certains patients, tout au long de leur vie, tout
comme les infections qui survenaient au niveau de la
suture ont pu compromettre un bon résultat.
Par la suite, entre la moitié et la fin des années 90,
un ophtalmologiste hollandais, Gerrit Melles, fit
revivre l’idée qui consistait à ne remplacer que la
couche de cornée altérée par l’atteinte endothéliale
6
-9
.
Ce concept différait de celui qu’avait élaboré Barra-
quer, plusieurs dizaines d’années auparavant. En effet,
à sa place, Melles proposait d’enlever la partie pro-
fonde du stroma interne, avec l’endothélium sur la
membrane de Descemet, et de la remplacer par un
disque lamellaire fin, provenant de la cornée d’un
donneur. Il effectua ce travail initial, en tant que
chercheur, avec le Dr. Perry Binder, à San Diego, Cali-
fornie, et persista dans cette approche, à son retour en
Hollande. Tout ceci se traduisit par la publication du
concept et par la première greffe endothéliale réalisée
avec succès, sur l’homme, vers la fin des années
1990s. Sa technique fut facilitée par les méthodes de
dissection dont il fut le pionnier et qui lui permirent
de réaliser ce que d’autres qualifiaient d’irréalisable.
En effet, grâce à son sens aigu de l’observation, il
remarqua qu’une dissection pratiquée au dessus d’une
bulle d’air produisait une interface unique en son
genre qui reflétait le côté tranchant de la lame du
couteau à dissection
: il réalisa alors qu’il pouvait met-
tre ceci à profit pour définir et séparer les couches pro-
fondes de la cornée, permettant ainsi au chirurgien de
pénétrer de quelques microns au sein de l’
endo
-
thélium, sans atteindre la membrane de Descemet.
Quelques rumeurs commencèrent à circuler à pro-
pos de ses idées et de ses techniques dans le monde de
la cornée, au début de ce nouveau siècle. Certains
médecins, dont plus particulièrement, Mark Terry, de
P
ortland, réalisèrent que quelque chose de passion-
nant était en train de se produire et allèrent rapide-
ment étudier les inno
vations du Dr. Melles. Quant à
moi, j’étais, personnellement, stupéfait du succès ren
-
contré par cette technique et j’organisai immédiate-
ment un voyage pour rendre visite au Dr. Melles, en
Hollande, en 2001. Malheureusement, l’épidémie de
fièvre aphteuse rendit difficile le voyage en Hollande
et l’accès aux yeux des animaux: je dus donc retarder
mon voyage. En 2002, je me rendis à Rotterdam et
passai du temps avec le Dr. Melles, à étudier et à
apprendre ses techniques. Par la suite, j’ai travaillé
avec Mark Terry, à Portland, pour observer les modifi-
cations que cet autre grand chirurgien avait apportées
à ces techniques
10-15
.
D’autres centres proposèrent de faire revivre la
technique du lambeau superficiel, avec trépanation
prof
onde, que les Drs. Barraquer avaient conçues
16
,
mais les problèmes que posaient la cicatrisation de la
plaie et l’astigmatisme irrégulier me persuadèrent que
les techniques internes du Dr. Melles représentaient
les meilleures alternatives.
Le Dr. Melles avait baptisé sa technique « kérato-
plastie lamellaire postérieure » (PLK), tandis que le Dr.
Terry avait vulgarisé l’appellation: « kératoplastie
endothéliale lamellaire profonde » (DLEK) pour
désigner sa technique, similaire, quoique légèrement
différente. En effet, alors que le Dr. Melles recom-
mandait une dissection au dessus d’une bulle d’air for-
mant un coussinet, le Dr. Terry, quant à lui, séparait la
lamelle avec un fluide dans la chambre antérieure. La
technique telle qu’elle avait été conçue à l’origine,
comportait les étapes suivantes:
1. Dissection d’un plan cornéen à l’
aide de dissecteurs
spécialement conçus, en fendant la cornée horizon-
talement, d’un limbe à l’autre, à environ 85 % (à peu
près
4
00 microns) de la surface, à travers un canal
limbique scléral.
2. Délimitation d’un cercle de 8 à 9 mm, au centre de
la cornée. A l’origine, on insérait une tréphine
intrastromale, spécialement conçue, dans la cavité
cornéenne, puis on pratiquait la trépanation interne
dans la c
hambre antérieure. Mais cette manipulation
s’est avérée difficile et fut remplacée par la suite, par
une section interne à main levée, pratiquée à l’
aide de
ciseaux spécialement conçus, par le biais de l’incision
limbique.
3. Préparation du greffon du donneur, de la même
manière, en utilisant l’un de ses bord inséré dans un
dispositif artifi
ciel de chambre antérieure ou réalisé
Figure 1 : Kératoplastie ronde pénétrante, 10 – 0 inter-
rompue et 11 – 0 suture continue en place
Figure 2: Topographie après greffe de cornée.
A noter la forme en « noeud papillon » de l’astigmatisme.
Il fut donc suggéré d’insérer le nouvel endothé-
lium du greffon du donneur avec une fine couche
stromale d’environ 100 microns. C’est ce que fit, dans
la pratique, le Dr. Melles qui baptisa cette nouvelle
modification « Stripping de Descemet avec kératoplas-
tie endothéliale (DSEK) » (Figure 4). Ces progrès ont
été divulgués par le Dr. Melles entre 2002 et 2004 et,
peu à peu, se sont imposés comme une alternative à la
PLK ou à la DLEK
23
. La fine pièce provenant du greffon
du donneur est insérée dans l’
œil et positionnée dans
la chambre antérieure avec l’aide d’une bulle d’air.
Ceci facilite l’élimination du fluide de l’interface et
donne au nouvel endothélium du greffon du donneur
le temps de commencer à pomper et à former le vide
nécessaire pour maintenir en place le greffon du don-
neur. Les résultats préliminaires ont été encourageants
et ont semblé constituer une alternative aux tech-
niques précédentes
17
. Il est certainement nettement
plus facile de décoller la membrane de Descemet que
de réaliser les dissections lamellaires profondes néces-
sitées par PLK et DLEK.
Une autre avancée technique a permis d’améliorer
plus encore cette méthode. En effet, les micro-
kératomes existaient depuis un certain temps déjà et
tous étaient basés sur le concept original de Baraquer
des années 50. Ils furent améliorés grâce au développe
-
ment de l’ingénierie et des instruments jusqu’à ce que
le microkératome perfectionné et modifié de Baraquer
soit présenté au milieu des années 8
0 par la société
Steinway Instruments (Californie, USA). Il devint le pre-
mier dispositif à être utilisé couramment et fut adapté
par la société Baush and Lomb, Inc. (San Dimas, CA)
pour être utilisé dans la tec
hnique du kératomileusis in
situ, assisté par laser (LASIK), destinée à corriger la
m
yopie, l’astigmatisme et l’hypermétropie. De nou-
velles adaptations furent développées par cette firme et
par d’
autres; elles permirent d’obtenir des lambeaux
plus précis, plus lisses et plus sûrs.
LASIK est aujourd’hui la méthode la plus utilisée
et des millions de personnes, dans le monde entier, ont
eu leur cornée « ouverte » par l’un de ces instruments.
P
ar la suite, la société Moria Inc. (Antony, France) modi-
sur l’œil entier du donneur. La cornée fendue est alors
découpée à l’emporte-pièce, à partir du côté de l’endo-
thélium, afin de correspondre à la taille de la section
interne effectuée sur le receveur.
4. L’insertion du cristallin du donneur dans la chambre
antérieure et positionnement dans la zone de résec-
tion, chez le receveur. Au début, on faisait cela en
plaçant le cristallin du donneur sur une spatule, puis
en l’insérant dans la chambre antérieure, en apposant
les stromas l’
un contre l’autre. Cela nécessitait une
longue incision de 9 mm. Par la suite, on a réalisé un
« taco » en forme de pli, en faisant se toucher les deux
surfaces endothéliales et en l’insérant à travers une
incision de 5 mm formant un canal scléral. Cela a
transformé l’opération en une kératoplastie quasiment
sans sutures, et, habituellement, un seul point était
nécessaire pour fermer la plaie.
Les résultats de petites séries d’interventions ont
commencé à se répandre, d’abord, en provenance de
chez Melles, en Europe puis de chez Terry, aux États-
Unis. Le Dr. Terry constitua alors le « Groupe Kérato-
plastie Endothéliale » (EKG), composé de chirurgiens
du monde entier, qui collaboraient en partageant leurs
résultats et en améliorant les techniques d’avant-
garde. Ce groupe se réunit deux fois par an et a permis
d’avancer à un rythme rapide (Figure 3).
Et pendant ce temps, le Dr. Melles continuait d’in-
nover. Il s’était avéré, en effet, que la dissection interne
était une tec
hnique qui prenait beaucoup de temps,
qui était difficile à maîtriser et qui produisait souvent
une interface irrégulière: ce qui a pu en limiter les
résultats sur la vision à une fourchette de 20/40,
entraîner le scepticisme de certains médecins à son
égard et en limiter, de ce fait, la diffusion. Le Dr. Melles
a alors proposé de n’
enlever que la membrane de
Descemet laissant ainsi exposée une surface stromale
vitreuse lisse. S’
est alors posée la question de savoir
comment ne greff
er que la membrane de Descemet,
question difficile à résoudre, car la membrane de
Descemet du greffon du donneur défile de bas en
haut, rendant son déploiement et son positionnement
dans l’œil difficiles.
Figure 3 : Une semaine après une kératoplastie réussie
par la méthode DLEK.
A noter l’absence de sutures sur
la surface.
Figure 4: Représentation schématique de la méthode
DSEK ou DSAEK.
On notera la cornée non déplacée du
receveur avec la fine couche de stroma apposée sur le
stroma postérieur dénudé.
C
ornée du receveur
L
amelles attachées du
g
reffon du donneur
f
ia le kératome, lui adjoignit la puissance d’un
turbo et le coupla avec une chambre antérieure
artificielle pour maintenir le greffon cornéen
excisé du donneur. Cela a permis d’enlever une
calotte antérieure épaisse (400 microns), avec une
précision parfaite, en laissant une couche
postérieure d’environ 150 microns, avec une
surface stromale tout à fait lisse. Cette couche
postérieure, qui renferme stroma, endothélium et
membrane de Descemet, pouvait être pliée et
insérée chez un receveur grâce à la méthode de
stripping de Descemet. Non seulement la surface
stromale est plus lisse, éliminant ainsi les pro-
blèmes dus à la cicatrisation de l’interface, mais
les dissections du greffon du donneur peuvent,
désormais, être faites sans dissections lamellaires
manuelles. Cette combinaison est appelée à
présent, « kératoplastie endothéliale automatique
par le stripping de Descemet (DSAEK) ». Elle a fait
irruption sur la scène de la cornée avec la même
intensité que la phacoémulsification chez les
chirurgiens de la cataracte et que le LASIK chez
les chirurgiens de la réfraction.
Les problèmes d’interface, les problèmes tech-
niques et les problèmes posés par la préparation du
greffon du donneur, sont relativement mineurs par
rapport aux méthodes PLK et DELK originales d’il y
a 5 ans. Toutefois, les problèmes posés par le greffon
du donneur demeurent, avec une perte cellulaire
endothéliale probablement plus élevée qu’avec la
kératoplastie pénétrante standard. Il y a également
les dépenses liées au microkératome et l’absence
d’études à long terme disponibles permettant de
vérifier la longévité de cette technique, par com-
paraison avec la kératoplastie pénétrante qui reste
la méthode de référence pour la maladie de
endothélium. Des complications que l’
on ne pou
-
vait pas imaginer, telles que la dislocation ou la
non adhérence du disque pro
venant du greffon du
donneur, peuvent également survenir jusque dans
3
0 % des séries initiales
10,12
.
La kératoplastie pénétrante modifiée.
Alors que l’atteinte endothéliale représente
l’une des causes majeures de l’opacification
cornéenne, nécessitant une réparation, il existe
Ophtalmologie
Conférences scientifiques
d’autres maladies (comme par exemple les taches
de la cornée, les traumatismes, les troubles exta-
tiques et les dystrophies) qui ne sont pas redev-
ables des techniques lamellaires postérieures
décrites plus haut. L’opinion de l’auteur de cet arti-
cle est que nous ne devrions pas encore nous
débarrasser de nos trépans et qu’il y a encore de
nombreux patients qui peuvent tirer profit des
greffes pénétrantes. Et pourtant, le besoin de
résoudre les problèmes posés par la chirurgie
pénétrante existe encore pour ces patients. Ce ne
sont pas des problèmes nouveaux; les pionniers
de la greff
e avaient déjà cherché des solutions aux
problèmes d’apposition des plaies et de cicatrisa-
tion. La kératoplastie moderne, circulaire, à plaie à
bords rectilignes était, en effet, le résultat final
d’années de réflexions, de tests et d’expérience. Il
suffit simplement d’examiner la littérature pour
apprécier le travail des maîtres en la matière et les
problèmes auxquels ils ont été confrontés dans la
chirurgie de la kératoplastie. Ils avaient proposé
différentes configurations pour les plaies. Ainsi,
par exemple, Castroviejo, d’Espagne, et, plus tard,
de New-York, conçut la kératoplastie de forme
carrée et eut du succès avec cette configuration
(Figure 5)
19
. Quant à Francesetti et Baraquer, ils
étudièrent différentes configurations de plaies, en
double marches, en articulations de lapins
20,21
;
certaines avaient une plaie postérieure plus large,
alors que d’autres avaient une plaie antérieure
plus large, mais toutes deux avaient une interface
lamellaire intervenant pour améliorer la surface
de la zone de la plaie et la cicatrisation. Toutefois
ces idées sont restées en sommeil dans la littéra-
ture , dans la mesure où le monde de la cornée
avait opté pour les kératoplasties circulaires
assistée par le trépan cornéen de forme circulaire.
Récemment, cependant, Busin, d’
Allemagne, a fait
revivre ces techniques lamellaires partielles et les
a adaptées aux instruments c
hirurgicaux
modernes
17
. Il baptisa sa tec
hnique
«
kératoplastie
en forme de sommet de chapeau » dans la mesure
où le pan extérieur, interne faisait ressembler le
greffon du donneur au sommet des chapeaux
d’
antan (Figure 6). Cette technique présente
Figure 5 : Transplant carré de Castroviejo
Cornée du receveur
Région de la guérison
lamellaire
Greffe pleine épais-
seur de donneur
Cornée du receveur
Figure 6 : Kératoplastie pénétrantes en forme
de « sommet de chapeau ».
On notera le pan
périphérique qui se replie à la périphérie, donnant
ainsi une plus grande adhésion stromale.
Région de la
guérison lamellaire
1-2 mm
l’avantage d’offrir une plus grande surface pour la
p
laie stromale, une plus large zone pour l’endo-
thélium transplanté et une meilleure cicatrisation
de la plaie, permettant d’enlever les fils plus tôt
sans risque de déhiscence. Les quelques études en
cours peuvent montrer les avantages que présen-
t
ent de telles techniques. et même s’il existe une
courbe d’assimilation pour maîtriser ces méth-
odes, les études futures montreront, nous
l’espérons, que des améliorations considérables
leurs sont associées.
La kératoplastie lamellaire
Pour les troubles dystrophiques et les affec-
tions liées à l’amincissement de la cornée, les
greffes pénétrantes ont dominé la thérapeutique
au cours des 5 dernières décennies. Mais bien
qu’elles soient efficaces, l’idée d’enlever l’en-
dothélium sain pour les maladies de la zone
antérieure a toujours gêné les chirurgiens de la
cornée. En effet, pourquoi remplacer l’endo-
thélium d’un sujet sain, âgé de 20 ans, ayant un
kératocône, et le soumettre au risque significatif
de rejet endothélial et de fragilisation permanente
de l’
œil avec une plaie pénétrante?
C’est pour ces raisons que les chirurgiens ont
cherché comment éviter la kératoplastie péné-
trante chez de tels patients. Melles, qui avait déjà
innové avec la chirurgie lamellaire postérieure, a
suggéré des méthodes alternatives pour enlever
95 % de la partie antérieure de la cornée, tout en
conservant, en toute sécurité, la membrane de
Descemet et l’endothélium de l’hôte. Il y parvint
avec la kératoplastie lamellaire antérieure pro-
fonde (DALK)
23
. En utilisant une fois de plus une
bulle d’air comme guide et comme coussinet, il a
pu enlever et remplacer seulement le stroma
antérieur. Bien que constituant un véritable défi
technique, cette méthode a pu être mise en œuvre
à plusieurs reprises, évitant ainsi une kératoplastie
pénétrante pour ceux qui n’avaient pas, véritable
-
ment, d’autres options. D’autres médecins, dont
l’égyptien Anwar, avaient proposé de séparer
la membrane de Descemet en injectant de l’
air
dans le stroma ou un liquide pour faciliter la dis-
section
24
. Lorsqu’ elles étaient réussies, ces inter-
ventions chirurgicales lamellaires profondes
évitaient les problèmes d’interface que posaient
les dissections lamellaires plus superficielles et
donnaient, en général, des résultats comparables à
ceux des greffes pénétrantes. Les rejets de l’en-
dothélium ne se produisaient pas et même si des
rejets du stroma pouvaient survenir
, ils étaient,
en général, de faible intensité et facilement
réversibles avec des stéroïdes topiques.
L
L
a kératoplastie assistée au laser
F
emtosecond (FLAK)
Une autre avancée innovante est apparue
dans le domaine de l’ingénierie, associée à la
chirurgie de la réfraction. Comme cela a été men-
tionné plus haut, le microkératome a révolu-
t
ionné la chirurgie de la réfraction cornéenne qu’il
a transformée en intervention généralement sans
risque et prévisible, mais non dépourvue de com-
plications. Or il se trouve que la plupart des com-
plications provoquées par la technique LASIK
s
ont imputables à la création du lambeau. Au
milieu des années 80, les chercheurs com-
mencèrent à étudier la technologie du laser YAG
en tant que moyen de pratiquer une ablation
intrastromale. Cela a débouché sur le laser Fem-
tosecond, mais non comme instrument de traite-
ment intrastromal, mais comme instrument
permettant de préparer un lambeau dans le cadre
de LASIK. IntraLase
TM
(Irvine, CA) fut le premier
instrument commercialisé qui rendit cela possible.
En créant des milliers de petites explosions, au
sein d’un modèle de trame, (comme dans un écran
de télévision), toutes dans le même plan, il permit
de pratiquer une dissection sans kératome. Cette
technologie utilise la voie transépithéliale, sans
qu’il soit nécessaire de pratiquer l’abrasion de la
cornée associée au microkératome standard. Les
niveaux de précision et d’épaisseur des lambeaux
sont beaucoup plus contrôlés et les limitations
liées à la lame n’existent plus. Il est possible
d’obtenir des lambeaux à bords verticaux et plus
plans: mais ce n’est pas ce qui passionne le plus
les chirurgiens de la cornée: ce qui les passionne,
ce sont, plutôt, les retombées de cet instrument. Il
permet, en effet, de réaliser n’importe quel type
d’incision de la cornée – verticale, horizontale,
ovale, circulaire ou sur mesure. De même, le bord
n’a plus à être droit; il peut avoir une configura-
tion en «sommet de chapeau» ou une forme en
«zig-zag» (comme l’
a présenté W. Culbertson à la
Société d’Ophtalmologie Canadienne, à Toronto,
en juin 2006). Cela peut améliorer l’apposition de
la plaie et la cicatrisation et diminuer l’
astigma
-
tisme. On peut, à présent, non seulement prati-
quer une incision conforme à ce que l’on avait
imaginé, mais on peut la pratiquer sous le con-
trôle d’
un logiciel. IntraL
ase
TM
a apporté des modi
-
fications à leur «confectionneur de lambeau» qu’il
a transf
ormé en appareil pouvant être utilisé dans
presque toutes les interventions chirurgicales sur
la cornée. Bien que cette tec
hnologie soit
onéreuse, l’
auteur du présent article croit qu’
elle
détient la clé d’une chirurgie cornéenne perfor-
mante dans le futur.
Ophtalmologie
Conférences scientifiques
1
0. Terry MA, Ousley PJ. Deep lamellar endothelial keratoplasty: early
c
omplications and their management.
C
ornea
2
006 Jan;25(1):37-43.
11. Terry MA, Ousley PJ. Deep lamellar endothelial keratoplasty visual
acuity, astigmatism, and endothelial survival in a large prospective
series.
Ophthalmology 2005;112(9):1541-8.
12. Ousley PJ, Terry MA. Stability of vision, topography, and endothelial
cell density from 1 year to 2 years after deep lamellar endothelial ker-
atoplasty surgery.
Ophthalmology 2005; 112(1):50-7.
1
3. Terry MA, Ousley PJ. Small-incision deep lamellar endothelial kerato-
p
lasty (DLEK): six-month results in the first prospective clinical study.
C
ornea
2
005;24(1):59-65.
1
4. Terry MA, Ousley PJ. Replacing the endothelium without corneal sur-
f
ace incisions or sutures: the first United States clinical series using
t
he deep lamellar endothelial keratoplasty procedure.
O
phthalmology
2
003;110(4):755-64; discussion 764.
1
5. Terry MA, Ousley PJ. Deep lamellar endothelial keratoplasty in the
f
irst United States patients: early clinical results.
C
ornea
2
001;
20(3):239-43.
16. Busin M, Arffa RC, Sebastiani A. Endokeratoplasty as an alternative to
penetrating keratoplasty for the surgical treatment of diseased
endothelium: initial results.
Ophthalmology 2000;107(11):2077-82.
17. Busin M. A new lamellar wound configuration for penetrating kerato-
plasty surgery.
Arch Ophthalmol 2003;121(2):260-5.
18. Price MO, Price FW Jr. Descemet’s stripping with endothelial kerato-
plasty comparative outcomes with microkeratome-dissected and man-
ually dissected donor tissue.
Ophthalmology 2006;113(11):1936-42.
1
9. Corneal Transplantation: A History in Profiles. In: Mannis MJ, Mannis
A
A.
H
ischberg History of Ophthalmology, The Monographs
,
Vol 6. J.P.
W
ayenborgh:Belgium,1999:209.
20. Corneal Transplantation: A History in Profiles. In: Mannis MJ, Mannis
A
A.
H
ischberg History of Ophthalmology, The Monographs
,
Vol 6. J.P.
Wayenborgh:Belgium,1999:3
13. J.P.
21. Barraquer J, Rutllan J.
Microsurgery of the Cornea. Edicones Scriba, SA:
B
arcelona, Spain;1984:292.
2
2. Melles GR, Lander F, Rietveld FJ, Remeijer L, Beekhuis WH, Binder PS.
A new surgical tech
nique f
or deep stromal, anterior lamellar kerato-
plasty.
Br J Ophthalmol 1999;83(3):327-33.
23. Melles GR, Wijdh RH, Nieuwendaal CP. A technique to excise the
D
escemet membrane from a recipient cornea (descemetorhexis).
Cornea 2004;23(3):286-8.
24.
Anwar M, T
eichmann KD. Deep lamellar keratoplasty: surgical tech-
niques for anterior lamellar keratoplasty with and without baring of
Descemet’s membrane.
Cornea 2002;21(4):374-83.
Conclusion
Toutes les techniques décrites ci-dessus, que ce
s
oit les kératoplasties lamellaires antérieures ou
postérieures, les incisions précises ou les configura-
tions de plaies pénétrantes, peuvent être mieux et plus
précisément mises en œuvre à l’aide du laser Fem-
tosecond. Il reste toutefois, encore des points à régler.
A
insi, par exemple, la technologie actuelle est tribu-
taire de l’aplanissement de la surface cornéenne pour
l’incision. Les obstacles techniques que comporte la
création d’une surface courbe devront être surmontés
de sorte que même les cornées déformées puissent
ê
tre incisées avec précision, comme cela se fait avec
les guidages topographiques des surfaces .
Les ophtalmologistes ont de la chance de vivre
dans cette ère de changements dans tous les domaines
de l’ophtalmologie. Certaines des innovations que
nous considérons, aujourd’hui, comme acquises, n’é-
taient que de simples rêves, pour les générations
précédentes. La combinaison entre les nouvelles tech-
nologies et les idées innovantes qui vont émerger per-
mettront probablement de réaliser des percées encore
plus importantes dans le futur .Mais nous devons
respecter le génie de nos prédécesseurs, car ce sont
leurs travaux qui sont à l’origine de bien des idées que
l’
on peut développer de nos jours, parce qu’il existe,
aujourd’hui, les moyens de les mettre en œuvre. S’il y
a quelque chose que nous avons appris, c’est que la
plupart des nouveautés d’aujourd’hui ont déjà été
pensées par quelqu’un, il y a bien longtemps. C’est à
nous qu’il revient de retrouver ces trésors et de les
appliquer aux temps modernes.
Références:
1. Corneal Transplantation: A History in Profiles. In: Mannis MJ, Mannis
AA.
Hisc
hber
g History of Ophthalmology, T
he Monographs
, V
ol 6. J.P
.
Wayenborgh:Belgium,1999:131.
2. Corneal Transplantation: A History in Profiles. In: Mannis MJ, Mannis
AA.
Hischberg History of Ophthalmology, The Monographs, Vol 6. J.P.
W
ayenborgh:Belgium,19
9
9:171-191.
3. Corneal Transplantation: A History in Profiles. In: Mannis MJ, Mannis
AA.
Hischberg History of Ophthalmology, The Monographs, Vol 6. J.P.
Wayenborgh:Belgium,1999:205-226.
4. Corneal Transplantation: A History in Profiles. In: Mannis MJ, Mannis
AA.
Hischberg History of Ophthalmology, The Monographs, Vol 6. J.P.
Wayenborgh:Belgium,1999:105-115.
5.
Barraquer J, Rutllan J.
M
icr
osur
ger
y of the Cor
nea
. Edicones Scriba, S
A:
Barcelona, Spain;1984:125,289,292.
6. Alio JL, Shah S, Barraquer C, Bilgihan K, Anwar M, Melles GR. New
tec
hniques in lamellar keratoplasty. Curr Opin
Ophthalmol
2002;13(4):224-9.
7. Melles GR, Lander F, Nieuwendaal C. Sutureless, posterior lamellar
keratoplasty: a case report of a modified technique.
Cornea
2002;21(3):325-7.
8.
Melles G
R, Lander F, Beekhuis WH, Remeijer L, Binder PS. Posterior
lamellar keratoplasty f
or a case of pseudophakic bullous keratopath
y
.
Am J Ophthalmol 1999;127(3):340-1.
9. Melles GR, Eggink FA, Lander F, et al. A surgical technique for poste-
rior lamellar keratoplasty
.
Cor
nea
19
98;17(6):618-26.
© 2006 Département d’ophtalmologie et des sciences de la vision, Faculté de médecine, Université de Toronto, seul responsable du contenu de cette publication. Édition : SNELL Communication
Médicale Inc
. avec la collaboration du Département d’ophtalmologie et des sciences de la vision, Faculté de médecine, Université de Toronto.
MD
Ophtalmologie – Conférences scientifiques est une marque
déposée de
SNELL Communication Médicale Inc. Tous droits réservés. L’administration d’un traitement thérapeutique décrit ou mentionné dans Ophtalmologie – Conférences scientifiques doit toujours
être conforme aux renseignements d’ordonnance approuvés au Canada.
SNELL Communication Médicale se consacre à l’avancement de l’éducation médicale continue de niveau supérieur.
L’élaboration de cette publication a bénéficié d’une subvention à l’éducation de
Novartis Ophthalmics
130-025F
Les avis de c
hangement d’
adresse et les demandes d’
abonne
-
ment pour
Ophtalmologie – Conférences Scientifiques doivent
être envoyés par la poste à l’adresse C.P. 310, Succursale H,
Montréal
(Québec) H3G 2K8 ou par fax au (514) 932-5114 ou
par courrier électronique à l’adresse
Veuillez vous référer au bulletin
Ophtalmologie – Conférences
Scientifiques
dans votre correspondence. Les envois non
distribuables doivent être envoyés à l’adresse ci-dessus.
Poste-publications #40032303
SNELL
La version française a été révisée par le professeur Pierre Lachapelle,
M
ontréal.
Le D
r
Rootman déclare qu’il n’a aucune divulgation à
faire en association avec le contenu de cette publication.
Ophtalmologie
Conférences scientifiques
J
UILLET/AOÛT 2006
Volume 4, numéro 4
COMPTE RENDU DES CONFÉRENCES
SCIENTIFIQUES DU DÉPARTEMENT
D’OPHTALMOLOGIE ET
DES SCIENCES DE LA VISION,
FACULTÉ DE MÉDECINE,
UNIVERSITÉ DE TORONTO
Département d’ophtalmologie
et des sciences de la vision
Faculté de médecine
Université de Toronto
60 Murray St.
Bureau 1-003
T
oronto (Ontario) M5G 1X5
Le contenu rédactionnel d’Ophtalmologie –
Conférences scientifiques
est déterminé
exclusivement par le Département
d’ophtalmologie et des sciences de la vision,
Faculté de médicine, Université de T
oronto.
Département d’ophtalmologie
et des sciences de la vision
Jeffrey Jay Hur
witz, M.D., Rédacteur
Professeur et président
Martin Steinbach, Ph.D.
Directeur de la recherche
The Hospital for Sick Children
Elise Heon, M.D.
Ophtalmologiste en chef
Mount Sinai Hospital
Jeffrey J. Hurwitz, M.D.
Ophtalmologiste en chef
Princess Margaret Hospital
(Clinique des tumeurs oculaires)
E. Rand Simpson, M.D.
Directeur
, Ser
vice d’oncologie oculaire
St. Michael’
s Hospital
Alan Berger, M.D.
Ophtalmologiste en chef
Sunnybrook and Women’s College
Health Sciences Centre
W
illiam S. Dixon, M.D.
Ophtalmologiste en chef
The Toronto Hospital
(Toronto Western Division and
Toronto General Division)
Robert G. Devenyi, M.D.
Ophtalmologiste en chef
L’orbitopathie thyroïdienne : Ce que
l’ophtalmologiste général devrait savoir
PAR NANCY TUCKER, M.D.
L’orbitopathie thyroïdienne peut avoir des effets dévastateurs sur les milliers de
patients qui en sont atteints chaque année. La frustration que ressentent les malades et
les médecins face à cette maladie provient du fait qu’ils doivent lutter contre elle alors
qu’ils ne disposent, à ce jour, que de peu d’options thérapeutiques valables et qu’ils
ignorent encore beaucoup sur elle. Quelques progrès ont toutefois été réalisés au cours
des dernières décennies, tant dans la compréhension de la physiopathologie de cette
maladie, que dans les options thérapeutiques. Ce numéro d’
Ophtalmologie – Conférences
scientifiques
donne une vue d’ensemble de l’orbitopathie thyroïdienne et décrit les
progrès thérapeutiques récents susceptibles d’aider l’ophtalmologiste généraliste à
aborder ce groupe de patients difficile-stimulant.
On a utilisé de nombreux termes pour décrire la constellation de manifestations ocu-
laires qui peuvent apparaître chez les patients atteints d’orbitopathie thyroïdienne; mais il
n’existe pas d’accord universel sur le terme qui la décrirait le mieux. Ophtalmopathie de
Graves, ophtalmopathie infiltrante, maladie thyroïdienne de l’œil, ophtalmopathie thyroï-
dienne, orbitopathie th
yroïdienne, orbitopathie dysthyroïdienne, ophtalmopathie endocri-
nienne, exophtalmie endocrinienne et exophtalmie maligne, figurent parmi les termes que
l’on a utilisés. L’auteur de cet article préfère employer orbitopathie thyroïdienne puisque l’on
sait que cette maladie peut survenir dans d’autres circonstances que dans la maladie de
(Basedow) Graves, que les patients qui en sont atteints peuvent être euthyroïdiens et que
l’orbite est le site primaire concerné.
L
a plupart des malades atteints d’
orbitopathie thyroïdienne ont une maladie de Graves.
T
outef
ois, d’
autres affections thyroïdiennes peuvent être associées à la même constellation
de manif
estations oculaires, dont la th
yroïdite c
hronique de Hashimoto, le cancer de la thy-
roïde et l’hyperthyroïdie primaire. Près de 40 % des patients atteints de la maladie de Graves
ont ou vont développer une orbitopathie thyroïdienne; mais on peut détecter des modifica-
tions orbitaires sub-
cliniques à l’éc
hographie ultrasonique ou au scanner (CT), dans pra-
tiquement tous les cas. Parmi les malades atteints d’orbitopathie thyroïdienne, près de 80 %
sont cliniquement h
yperth
yroïdiens et 2
0 % sont cliniquement euthyroïdiens
1
. L
a plupart
des patients atteints orbitopathie de Graves euthyroïdienne présenteront quelques signes,
détectables en laboratoire, d’hyperthyroïdie subclinique
2
. D’une manière générale, les
patients atteints de la maladie de Graves euthyroïdienne auront tendance à développer une
orbitopathie moins sévère
3
.
L’orbitopathie apparaît,en général, dans les 18 mois qui suivent le diagnostic de la
maladie thyroïdienne; mais il n’est pas rare qu’elle apparaisse simultanément. Il est difficile
de prévoir quand elle va commence
r : elle peut précéder le diagnostic ou survenir plusieurs
années après le début de la maladie de Graves. L’orbitopathie thyroïdienne est, habituelle-
ment, une maladie qui progresse lentement, qui peut se développer de manière fl
uctuante
avant de se stabiliser et, finalement, disparaître. Elle peut durer de 6 mois à plusieurs années.
Etiologie
L’orbitopathie th
yroïdienne est plus fréquente c
hez la femme que chez l’homme (le ratio
est de 8 contre 1) et survient, habituellement, entre 3
0 et 50 ans. La prévalence est plus
élevée chez les fumeurs. On a montré, récemment, que non seulement les fumeurs ont plus
de chances de développer une orbitopathie thyroïdienne, mais que leur orbitopathie tend à
MC
Département
d’ophtalmologie et des
sciences de la vision
FACULTY OF MEDICINE
University of Toronto
Disponible sur Internet à :
www.ophtalmologieconferences.ca
être plus sévère et à répondre moins bien aux stéroïdes
ou à l’irradiation. Le mécanisme qui relie le tabagisme à
l’orbitopathie thyroïdienne demeure spéculatif. Il est
possible que la baisse de l’immunosuppression chez les
fumeurs permette une plus grande expression des
p
rocessus immunitaires, ou que l’hypoxie orbitaire qui
en résulte, le thiocyanate et la stimulation adréner-
gique de la glande thyroïde associée à la nicotine y
contribuent.
Il existe également une prédisposition génétique et
une association HLA (Antigène Leucocytaire Humain)
dans l’orbitopathie thyroïdienne. On constate, en effet,
une prévalence accrue du HLA-B8 et du HLA-DR3 chez
les patients atteints de la maladie de Graves et du HLA
–DR5 chez les patients atteints de la thyroïdite
chronique de Hashimoto. L’association avec le HLA n’a
pas de valeur prédictive pour le développement de l’or-
bitopathie chez les patients atteints de la maladie de
Graves. Du fait de la nature auto-immune sous-jacente
de l’orbitopathie thyroïdienne, les patients qui en sont
atteints peuvent présenter d’autres troubles immuni-
taires, spécifiques à un organe ou généralisés. Enfin,
une irradiation antérieure du cou, une « myasthénia
gravis », une kératite limbique supérieure constituent
des facteurs de risque de l’hyperthyroïdie de Graves
4
.
L’orbitopathie thyroïdienne est une maladie auto-
immune, mais la nature précise de ce processus auto-
immun, à l’origine des anticorps mis en cause et du
ciblage spécifique de la glande thyroïde, de l’orbite et de
la peau de la région pré-tibiale, chez les sujets atteints
de la maladie de Graves, est encore mal compris et
repose encore largement sur des hypothèses. Plusieurs
anticorps ont été isolés et 3 d’
entre eux peuvent être
dosés en routine : l’anticorps anti-microsomial, l’anti-
corps anti-thyroglobuline et l’anticorps anti récepteur
de la TSH (thyréostimuline). On ne sait pas avec certi-
tude si ces anticorps jouent un rôle important dans la
pathogenèse de cette maladie oculaire ou si ce ne sont
que de simples marqueurs du processus infl
ammatoire
auto-
immun de l’
orbite. De même, bien qu’
on ait pu
isoler ces anticorps sur la plupart des patients atteints
d’orbitopathie thyroïdienne, on ne les retrouve pas chez
tous ces patients et, souvent, il n’y a pas de corrélation
entre le niveau d’
anticorps et l’évolution clinique ou la
sévérité de cette maladie de l’œil.
L
a plupart des patients ne nécessitent pas de dosage
d’anticorps. En général, les patients que l’on soupçonne
d’être atteints d’orbitopathie thyroïdienne devront être
soumis aux tests standards d’exploration de la fonction
th
yroïdienne (TFT
s), pour détecter une h
yperth
yroïdie.
Le dosage immunoradiométrique de l’hormone thyréo-
stimulante (TSH) permet de séparer, de façon fiable,
les états «normaux» th
yroïdiens des états « hyper » et
« hypo » thyroïdiens. C’est le TFT de première intention
le plus utile c
hez les c
hez les patients atteints de
maladies thyroïdiennes. L’une des stratégies que suivent
les laboratoires qui réalisent ce test, consiste à doser
d’abord la TSH. Si le résultat est bas, on peut poser le
diagnostic d’h
yperth
yroïdie et si le résultat est élevé, on
posera le diagnostic d’h
ypothyroïdie. Pour chacun de
ces deux scénarios, on peut distinguer la forme visible
de la maladie, de sa forme subclinique, en dosant la T4
(thyroxine) libre. Bien que cette approche progressive
soit scientifiquement valable, au plan pratique, toute-
fois, – pour éviter les délais et les inconvénients d’une
approche en deux temps – la plupart des cliniciens
d
emandent, en routine, que la T4 libre et la TSH soient
dosées en même temps.
Si la TSH est normale, on dit que les patients sont
euthyroïdiens. Un patient euthyroïdien présentant des
signes cliniques évidents et cohérents avec une
orbitopathie thyroïdienne, n’a pas besoin de subir de
nouveaux tests de laboratoire; le diagnostic d’orbi-
topathie euthyroïdienne pouvant être établi sur des
bases cliniques. Mais si les signes d’une possible
orbitopathie thyroïdienne sont subtiles ou atypiques, de
nouvelles investigations seront indiquées pour con-
firmer le diagnostic. Il sera, ainsi, utile de prescrire un
scanner B orbitaire pour déterminer la taille du muscle
et de même qu’un titrage des anticorps thyroïdiens. Des
anticorps anti-récepteur de la TSH seront présents chez
85 à 95 % des patients souffrant d’une hyperthyroïdie
de Graves non traitée. Cependant, dans la population de
patients que l’on examine habituellement, (c’est-à-dire
les patients atteints d’orbitopathie euthyroïdienne), on
ne retrouve les anticorps anti TSH que dans 50 % des
cas, les anticorps anti-microsomiaux, que dans 60 % des
cas et les anticorps anti-thyroglobuline que chez 30 %
des patients
5
. Par conséquent, si le fait que ces résultats
soient positifs permet de confirmer un diagnostic de
maladie thyroïdienne auto-immune, le fait qu’un résul-
tat soit négatif ne l’exclut pas.
Ces anticorps et d’autres encore, sans doute, peu-
vent être responsables des manif
estations cliniques de
l’orbitopathie thyroïdienne. Il est très probable qu’ils
agissent en activant les lymphocytes T et B présents
dans les tissus orbitaires ainsi que dans la glande thy-
roïde. La modification la plus précoce semble en être
une inflammation des tissus conjonctifs endomysiaux
situés au sein des muscles extra-
oculaires. Les l
ympho-
cytes T et B vont alors entraîner une activation et une
prolifération des fi
broblastes par l’intermédiaire d’
un
mécanisme qui n’est pas encore complètement compris
mais qui est, probablement, régulé par les cytokines.
Une f
ois stimulés, les fibroblastes de l’
endomysium
vont produire des glucosaminoglycanes et du colla-
gène, ce qui va entraîner l’
apparition d’
un œdème et
d’une fibrose.
Les manifestations cliniques
Les manif
estations cliniques de l’
orbitopathie th
yroï
-
dienne relèvent de la triade : inflammation, œdème et
fibrose, présente dans divers tissus orbitaires, dont
les muscles extra-
oculaires, le muscle de Müller,
l’aponévrose capsulopalpébrale, le muscle releveur et,
dans une moindre mesure, la graisse orbitaire et la
glande lacrymale. L’ atteinte des muscles extra-oculaires
est la plus significative. Les structures suivantes ne sont
pas particulièrement, affectées par l’infiltration inflam-
matoire direct
e
: il s’
agit des insertions tendineuses des
muscles extra-
oculaires, des méninges du nerfs optique
et du globe oculaire lui même.
2
arrière de l’œil augmente, élevant ainsi la pression aux
confins de l’orbite osseuse. L’exophtalmie est partielle-
ment limitée par le septum orbitaire et par l’attache
postérieure des muscles extra-oculaires au niveau de
l’apex. Lorsque la pression qui s’exerce au sein des tissus
r
étro-bulbaires dépasse les forces qui s’opposent à
l’exophtalmie, une complication rare peut survenir, la
subluxation du globe, en avant des paupières.
L’atteinte du muscle extra-oculaire
L’anomalie la plus fréquente de la motilité oculaire
est constituée par une limitation du mouvement de l’œil
vers le haut, due à une fibrose du muscle inférieur droit
qui provoque une diplopie lorsque le regard se déplace
vers le haut (Figure 2). Le deuxième muscle le plus
fréquemment atteint, au plan clinique, est le droit
médian, suivi par le complexe droit supérieur/ releveur
et, pour finir, par le droit latéral. Toutefois, n’importe
quel muscle seul ou association de muscles peuvent
produire cet effet. La diplopie est provoquée par une
fibrose des muscles oculaires qui empêchent l’extension
complète lorsque les muscles antagonistes se con-
tractent. S’il existe des antécédents de diplopie variable
et notamment si cette dernière est associée à une ptose
variable, liée à la fatigue, une « myasthénia gravis » doit
être envisagée. La « myasthénia gravis », qui est égale-
ment une maladie auto-immune, survient plus fré-
quemment chez les patients atteints d’orbitopathie
thyroïdienne que dans la population générale.
L’élévation de la pression intraoculaire mesurée pen-
dant que le regard des patients atteints d’orbitopathie
thyroïdienne se déplace vers le haut, a fait l’objet de
contro
verse. Lorsqu’une restriction du muscle droit
inférieur intervient, la pression intraoculaire peut aug-
menter de
≥ 6 mm de Hg par rapport au regard de base,
lorsque le regard se déplace vers le haut. L’augmentation
de la pression intraoculaire que l’on observe lorsque le
regard se porte vers le haut est un phénomène normal
que l’
orbitopathie th
yroïdienne exagère. Chez les
patients présentant une f
orme sévère, infiltrée, de la
maladie, on constate une augmentation de la pression
lorsque le regard se déplace vers le haut, par rapport
aux témoins normaux ou aux patients atteints d’une
f
orme modérée de la maladie. Mais, souvent, cela ne
constitue pas un signe précoce de la maladie, car cela
se produit rarement c
hez les patients qui présentent des
signes oculaires minimes
6
.
L’atteinte de la cornée
L
’
atteinte de la cornée, due à une kératite lagoph
-
talmique, peut résulter d’une exophtalmie, d’une rétrac-
tion de la paupière supérieure, d’une rétraction de la
paupière inférieure, d’
une lagophtalmie ou d’une com-
binaison de tous ces phénomènes. On peut également
constater un d
ysf
onctionnement primaire de la glande
lacrymale dans l’orbitopathie de Graves. Bien que cela
ne soit encore qu’une hypothèse, on dispose de cer-
taines preuves qui montrent que la composition des
protéines des larmes est modifi
ée c
hez les patients souf
-
frant d’
orbitopathie thyroïdienne. Cette modification
Les modifications observées
au niveau des paupières
L’orbitopathie thyroïdienne est la cause la plus com-
mune de rétraction palpébrale supérieure qui peut être
provoquée soit par l’action exagérée, de nature adré-
nergique, du muscle de Müller, soit par une fibrose et
un raccourcissement fonctionnel du muscle releveur.
En présence d’une rétraction minimale d’une paupière,
un diagnostic erroné de ptose de la paupière opposée
peut facilement être posé. La rétraction de la paupière
supérieure que l’on observe dans la maladie de Graves,
s’accompagne d’un érythème temporal caractéristique.
La rétraction de la paupière inférieure peut provenir de
modifications semblables au niveau de l’aponévrose
capsulopalpébrale. L’exophtalmie accentue l’aspect
cosmétique de la rétraction des paupières supérieures
et inférieure.
L’atteinte du tissu mou
Un examen attentif de ces patients peut révéler la
présence d’un œdème palpébral, d’un chémosis con-
jonctival et d’
une congestion des vaisseaux conjoncti
-
vaux et épiscléraux situés sous les insertions des
muscles extra oculaires. L
’infl
ammation, l’h
ypertrophie
et les modifications fibreuses des muscles extra ocu-
laires peuvent provoquer des troubles de la motilité et
une diplopie. D’
autres signes inflammatoires tels que
l’œdème palpébral ou périorbitaire, le chémosis con-
jonctival et l’érythème, ainsi que le gonflement de la
glande lacrymale, sont observés fréquemment.
L’exophtalmie
L
’
exophtalmie contribue à la kératite lagoph
-
talmique et à la rétraction palpébrale (Figure1).
L’orbitopathie thyroïdienne constitue la cause la plus
fréquente d’
exophtalmie, tant unilatérale que bilatérale,
chez l’adulte. Habituellement, l’exophtalmie est
bilatérale, mais elle peut être asymétrique. L
’
orbitopathie
thyroïdienne se traduit par une exophtalmie axiale : le
déplacement du globe oculaire dans n’importe quelle
autre direction évoque un autre diagnostic. Un déplace-
ment du globe oculaire vers l’
avant intervient lorsque le
volume du muscle et du tissu conjonctif situés en
Ophtalmologie
Conférences scientifiques
3
Figure 1 : Orbitopathie thyroïdienne, avec exophtalmie et
kératite lagophtalmique cornéenne inférieure.
peut être due à une baisse de la production de larmes
ou à une modification générale de la composition des
larmes
7
. La kératite lagophtalmique peut aller d’une très
faible coloration ponctuée inférieure à une kératite
sévère et même à une ulcération de la cornée.
La neuropathie optique
La neuropathie optique avec perte visuelle, que l’on
observe chez les patients atteints d’orbitopathie thyroï-
dienne, a une prévalence inférieure à 5 %
8
. La neu-
ropathie optique représente, toutefois, la cause la plus
fréquente de cécité secondaire à l’orbitopathie thyroïdi-
enne. Elle débute souvent de manière insidieuse et peut
être masquée par d’autres symptômes. Elle est plus
fréquente chez les personnes âgées (entre 50 et 70 ans),
chez les sujets de sexe masculin et chez les patients
souffrants de diabète. La neuropathie optique est
habituellement bilatérale, mais dans près d’un tiers des
cas, elle peut être unilatérale
9
.
La plupart des cas de neuropathie optique sont dus à
une compression du nerf optique par les muscles extra-
oculaires h
ypertrophiés au niveau de l’
apex orbitaire. Les
patients atteints de neuropathie optique compressive
présentent une atteinte plus symétrique des muscles
extra-oculaires, que la plupart des malades atteints de
maladies thyroïdiennes
10
. Bien que les patients atteints
de neuropathie optique présentent habituellement une
exophtalmie, une neuropathie optique peut survenir
sans qu’il y ait d’
exophtalmie significative c
hez les
patients dont la cloison orbitaire limite efficacement le
déplacement antérieur du globe oculaire, en dépit de
l’augmentation de la pression rétro bulbaire. Il arrive,
très rarement, que la neuropathie optique intervienne
sans qu’il y ait d’hypertrophie musculaire significative.
Dans ces cas, l’hypothèse est qu’il s’agit d’un nerf optique
court qui est étiré ou que le nerf optique est comprimé
par la graisse orbitaire environnante
11
. Ces cas sont telle-
ment rares qu’
une neuropathie optique survenant en
l’absence d’hypertrophie musculaire ou d’exophtalmie,
devrait faire l’objet d’une étude minutieuse, car elle n’est
pas liée à des causes thyroïdiennes.
Bien que des antécédents de baisse de la vision
devraient être soigneusement rec
herchés, il est impor-
tant de savoir qu’une neuropathie optique peut survenir
dans un nombre significatif de patients (18 %) dont
l’acuité visuelle s’étend de 20/20 à 20 /25. On pourra
constater la présence d’un défaut pupillaire afférent dans
35 % des cas; d’un disque anormal (soit enflé, soit pale)
dans seulement 52 % des cas et de défauts du champ
v
isuel dans 66 % des cas
9
.
Le test de vision des couleurs
de Farnsworth – Munsell (aux 100 teintes) est un indica-
teur sensible de dysfonctionnement du nerf optique,
alors que les tests de dépistage pseudo-isochromatique
(les tables d’Ishihara, par exemple) identifient rarement
un défaut acquis au niveau des couleurs, à moins que la
neuropathie optique ne soit sévère
9
.
La prise en charge.
La prise en charge des patients atteints d’orbito-
pathie thyroïdienne se divise en 4 catégories générales :
• Il y a, tout d’abord, les patients qui présentent des
signes évoquant une orbitopathie thyroïdienne, mais
chez qui le diagnostic n’avait pas été soupçonné aupara-
vant.
• Le second groupe comprend les patients dont on sait
qu’ils sont atteints de la maladie de Graves et qui sont
référés par l’endocrinologue avant de commencer le
traitement à l’I
131
.
• Puis vient le groupe de patients dont on sait qu’ils sont
atteints d’une orbitopathie thyroïdienne et qui sont
suivis durant leur phase active / instable.
• Il y a enfin le groupe de patients atteints d’orbitopathie
thyroïdienne dont l’état est stabilisé.
Patients non diagnostiqués
Les tableaux cliniques dans lesquels la possibilité
d’
une orbitopathie thyroïdienne est souvent négligée,
comprennent une irritation des yeux, un larmoiement
et une très légère rétraction de la paupière dans l’orbito-
pathie thyroïdienne précoce. Les signes que l’on observe
à l’examen comprennent une légère rétraction de la
paupière supérieure ou inférieure, qui peut être uni-
latérale ou bilatérale, une ptose unilatérale,
une très
légère exophtalmie, une diplopie démarrant à l’âge
adulte, une kératopathie lagophtalmique
inférieure ou
une ptose unilatérale modérée. La ptose unilatérale n’est
pas un signe d’orbitopathie thyroïdienne, mais les
patients présentant une rétraction unilatérale discrète
de la paupière se présentent le plus souvent en se plaig-
nant d’
une ptose palpébrale du coté opposé. Il est
important de rester très vigilant chez les patients d’âge
moyen (30 à 50 ans), qui ne portent pas de lentilles de
contact et qui se présentent avec une ptose unilatérale
d’
apparition récente. En eff
et, dans ce tableau clinique,
une rétraction de la paupière supérieure serait beau-
coup plus fréquemment à l’origine de l’asymétrie qu’une
ptose unilatérale.
Dans le groupe de patients présentant une
orbitopathie th
yroïdienne
« possible », d’autres signes
discrets, décelés à l’examen, peuvent aider à confirmer
le diagnostic : par exemple, le signe de Von Graefe [asy-
nergie oculo-palpébrale] (retard du mouvement vers le
bas de la paupière supérieure, quand le regard se
déplace lentement vers le bas), le signe de Griffith
(retard du mouvement de la paupière inférieure quand
4
Figure 2 : Limitation du mouvement extra-oculaire
vers le haut
le regard se porte vers le haut), le signe de Stellwag
(clignement rare et incomplet), le signe de Kocher
(rétraction spasmodique de la paupière supérieure pen-
dant la fixation), le signe de Rosenbach (tremblement
des paupières fermées doucement), le signe de Gifford
(
difficulté d’éversion de la paupière supérieure) et le
signe de Grove (résistance à la traction vers le bas de la
paupière supérieure). Pour apprécier le signe de Grove,
on demande au patient de regarder vers le bas; puis on
saisit les cils palpébraux supérieurs et on détermine la
résistance à la traction vers le bas. Le signe de Grove est
positif quand on ressent un niveau de résistance signifi-
catif, ce qui indique que le muscle releveur est proba-
blement atteint.
Si l’exploration fonctionnelle de la thyroïde donne
des résultats normaux chez des patients soupçonnés
d’avoir une orbitopathie thyroïdienne, une recherche
d’anticorps thyroïdiens peut être utile. Si ces derniers ne
peuvent pas en démontrer la présence, une échographie
ultrasonique orbitaire, pratiquée par un échographiste
expérimenté est très utile. La plupart des patients atteints
de la maladie de Graves, même ceux qui n’ont aucun
signe oculaire visible, montreront, aux ultrasons, des
signes manifestes d’atteintes des muscles extra-ocu-
laires
12
. Dans ce cas, les ultrasons sont plus sensibles que
le scanner (CT) ou que l’imagerie par résonance magné-
tique (IRM) pour détecter la plus petit hypertrophie
musculaire. Il peut également être utile de différencier
les formes évolutives et non évolutives de la maladie.
Si la suspicion d’orbitopathie thyroïdienne est
fondée sur une exophtalmie unilatérale, avec augmenta-
tion de la résistance à la rétropulsion, un CT ou une
IRM seront indiqués pour éliminer la présence d’une
tumeur orbitaire. Un scanner CT sera également utile
pour distinguer une orbitopathie thyroïdienne d’une
pseudo-tumeur orbitaire inflammatoire. Ce que l’on
observe de plus caractéristique au scanner CT, dans
l’orbitopathie thyroïdienne, c’est une hypertrophie
fusif
orme des muscles extra-
oculaires, habituellement
bilatérale, symétrique, très nettement délimitée et
respectant les insertions tendineuses. Le modèle d’h
y
-
pertrophie musculaire observé sur le CT est comparable
à celui que l’on observe en clinique. Le muscle droit
inférieur est le plus fréquemment concerné, suivi par le
droit médian, le droit supérieur et le droit latéral. Au
contraire, la m
yosite / pseudo-
tumeur orbitaire, aff
ecte
le plus fréquemment le muscle droit médian ( 57 % ),
suivi par le droit latéral (36 % )
13
. Elle est plus probable-
ment unilatérale, affecte un seul muscle et atteint les
tendons de manière visible à l’éc
hographie ultrasonique
ou au CT. Toutefois, faire la différence au CT, entre l’hy-
pertrophie d’un muscle myositique et celle d’un muscle
th
yroïdien, peut s’avérer difficile parce que le gonfle-
ment des tendons, dans la myosite, n’est pas un élément
constant et parce que de nombreux muscles peuvent
être affectés
14
.
Patients ayant fait l’objet d’un diagnostic
Le second groupe de patients que les ophtalmolo
-
gistes voient couramment, comprend les patients
envoyés par un endocrinologue pour un examen de
l’œil, avant de démarrer le traitement à l’I
131
. Le pro-
blème, avec ces patients, c’est de savoir s’ils ont, ou non,
une maladie préexistante de l’œil et si les stéroïdes leur
seraient recommandés ou non. Ce point a pris de l’im-
p
ortance, à la suite d’une publication parue dans le
N
ew
England Journal of Medicine
, en 1998
15
. On avait mon-
tré, au préalable, en 1992, que par rapport à d’autres
formes de traitements anti-thyroïdiens, le traitement à
base d’I
131
avait plus de chances de déclencher un début
d’orbitopathie thyroïdienne ou d’en provoquer l’exacer-
bation
16
. Cette probabilité était d’environ 15 % par
rapport à 3 % avec le propothiouracile. Au sein de
l’ensemble du groupe des 15 %, les sujets les plus
atteints étaient ceux qui avaient une orbitopathie thy-
roïdienne préexistante (28% contre 8 %). Par la suite,
Bartelena et col. signalèrent, en 1998, que la prédnisone
pouvait prévenir totalement le risque accru d’or-
bitopathie thyroïdienne associé à l’I
131
On a donc recom-
mandé de soumettre les patients présentant une
orbitopathie thyroïdienne préexistante, à un traitement
prophylactique à base de stéroïdes
16
. Néanmoins, les
chirurgiens oculoplasticiens semblent divisés sur le fait
de recommander cette prophylaxie à base de stéroïdes.
Certains d’entre eux pensent, en effet, que le bénéfice
que l’on pourrait retirer en empêchant la progression de
l’orbitopathie thyroïdienne ne compense pas les risques
potentiels d’effets secondaires liés à la prédnisone.
L’opinion de l’auteur des cet article est en faveur d’une
couverture stéroïdienne mise en œuvre pendant les
2 semaines qui précédent le traitement à l’I
1
31
, puis
réduite progressivement, pendant les 3 semaines qui
suivent ce traitement, c
hez les patients présentant une
orbitopathie thyroïdienne préexistante.
Orbitopathie thyroïdienne évolutive
Le troisième et plus important groupe de patients
vus par les ophtalmologistes généralistes est constitué
de patients dont on sait qu’ils sont atteints d’
une
orbitopathie th
yroïdienne. Le rôle de l’
ophtalmologiste
consistera à surveiller ces patients, pour le cas où leur
orbitopathie thyroïdienne se compliquerait de manière
sérieuse (neuropathie optique et kératite lagophtal-
mique par exemple) et à leur dispenser des conseils et
un traitement approprié qui leur permettra de gagner
du temps jusqu’à ce que leur maladie se stabilise. L
a
plupart de ces patients resteront évolutifs pendant 12 à
18 mois (bien que ceci soit tout à fait variable), puis
se stabiliseront et pourront même s’améliorer. Au cours
de cette phase évolutive, les patients se sentent souvent
frustrés devant le manque d’empressement apparent de
leur ophtalmologiste à démarrer un traitement efficace,
alors que la sévérité de leur maladie continue de pro
-
gresser. L’ophtalmologiste devra donc expliquer à ces
patients leur orbitopathie th
yroïdienne et sa stratégie de
prise en charge globale. L’importance du tabagisme
devra être expliquée aux patients. On peut dire, pour
résumer, que le tabagisme est le facteur le plus impor-
tant qui permet de déterminer si un patient atteint de
la maladie de Graves va développer une orbitopathie.
Ophtalmologie
Conférences scientifiques
5