luận văn nghiên cứu tác dụng của chế phẩm giáng chỉ tiêu khát linh điều trị rối loạn lipid máu trên động vật đái tháo đường týp 2 thực nghiệm (01)
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (3.5 MB, 167 trang )
1
ĐẶT VẤN ĐỀ
Hội chứng chuyển hoá là một chuỗi các yếu tố nguy cơ tim mạch và thay đổi
chuyển hoá liên quan với tình trạng tăng trọng lượng mỡ của cơ thể, trong đó rối loạn
lipid máu (RLLPM), rối loạn chuyển hoá (RLCH) carbohydrat, tăng huyết áp (THA)
và béo phì được coi là “bộ tứ chết người”; đó là những yếu tố nguy cơ hàng đầu gây
vữa xơ động mạch (VXĐM), bệnh tim mạch và đột quỵ [3][29].
Bệnh lý mạch vành có vị trí hàng đầu trong bệnh lý tim mạch, tỷ lệ bệnh mạch
vành ở người đái tháo đường (ĐTĐ) cao gấp 2 đến 3 lần người không mắc bệnh ĐTĐ.
Thậm chí người có rối loạn dung nạp glucose (RLDNG), suy giảm dung nạp glucose
lúc đói (RLGLĐ) cũng đã có những RLLPM tương tự và mức độ nguy cơ với những
tai biến tim mạch của họ không khác gì so với những người mắc bệnh ĐTĐ [2]. Bệnh
ĐTĐ gia tăng hàng năm theo sự phát triển của đời sống kinh tế xã hội. Theo thống kê
của Hiệp hội đái tháo đường thế giới (IDF), năm 2011 có khoảng 336,2 triệu người
mắc ĐTĐ và dự báo đến năm 2030 con số này sẽ tăng lên đến trên 550 triệu người
(mức tăng trưởng là 51%). Bệnh ĐTĐ xảy ra khắp các châu lục, thường là ĐTĐ týp 2,
đặc biệt ở các nước phát triển [47].
Ở bệnh nhân ĐTĐ lâu năm, tình trạng tăng glucose máu, RLLPM (tăng LDL-
C, tăng triglycerid, giảm HDL-C) kéo dài dẫn đến nhiều những RLCH đan xen là
nguyên nhân chính gây VXĐM và để lại những hậu quả xấu đối với hệ tim mạch
gây nên nhiều các biến chứng mạn. Do vậy, các thuốc y học hiện đại (YHHĐ) và y
học cổ truyền (YHCT) điều trị ĐTĐ nhằm kiểm soát glucose máu, điều chỉnh
RLLPM để có thể giảm được nguy cơ tiến triển của các biến chứng và giảm nguy
cơ bệnh mạch vành, hạn chế tác dụng phụ của thuốc ngày càng trở nên cấp thiết và
luôn là vấn đề quan tâm hàng đầu của các nhà khoa học.
Các thuốc YHHĐ điều trị RLLPM ở bệnh nhân ĐTĐ còn nhiều hạn chế bởi
khi dùng thuốc kéo dài thường hay có những ảnh hưởng đến chức năng gan và
thận…[73][103] hơn nữa giá thành của thuốc khá cao. Do vậy, nhiều nhà khoa học ở
2
Việt Nam cũng như trên thế giới đang có xu hướng tìm kiếm và ứng dụng các thuốc
nguồn gốc tự nhiên có tác dụng điều trị ĐTĐ và hạn chế rối loạn lipid.
Theo lý luận của y học cổ truyền (YHCT), ĐTĐ có nhiều điểm tương đồng
với chứng tiêu khát và RLLPM tương ứng với chứng đàm thấp. Trên lâm sàng thì
RLLPM ở bệnh nhân ĐTĐ có nhiều điểm tương đồng với chứng tiêu khát thể có
đàm thấp. Bệnh phát sinh từ các tạng phế, tỳ và thận, phần nhiều là chứng âm hư do
bệnh tiến triển lâu ngày thương tổn đến phần âm và thường đi kèm chứng đàm thấp.
Vì vậy, việc kết hợp điều trị chứng tiêu khát và trừ đàm thấp trong YHCT là một
hướng điều trị RLLPM ở bệnh nhân ĐTĐ [10][11]. Cho đến nay có nhiều vị thuốc,
bài thuốc đã được nghiên cứu ứng dụng điều trị chứng tiêu khát và chứng đàm thấp.
Thuốc có nguồn gốc thảo mộc ít độc tính, một số đã được nhân giống trồng trong
nước nên giá thành rẻ, có thể dùng trong thời gian lâu dài.
“Giáng chỉ tiêu khát linh” được bào chế dựa trên cơ sở bài thuốc nghiệm
phương “Giáng chỉ thang” đã được sử dụng trên lâm sàng để điều trị chứng tiêu
khát có đàm thấp (RLLPM ở bệnh nhân ĐTĐ) [32]. Tuy nhiên, bài thuốc mới chỉ
được chứng minh hiệu quả bằng kinh nghiệm, chưa có bằng chứng khoa học xác đáng
để khẳng định. Do vậy, để có cơ sở khoa học chắc chắn khẳng định hiệu quả cũng
như tính an toàn của bài thuốc “Giáng chỉ tiêu khát linh”, đề tài:
Nghiên cứu tác dụng của chế phẩm Giáng chỉ tiêu khát linh”
điều trị rối loạn lipid máu trên động vật đái tháo đường týp 2 thực nghiệm
được thực hiện nhằm các mục tiêu sau:
1. !
"#$%&
2. ' !%()
() * +(,$))+ ++%/"+
01#$%&
3
CHƯƠNG 1
TỔNG QUAN
1.1. RỐI LOẠN CHUYỂN HÓA LIPID, HOẠT ĐỘNG GỐC TỰ DO VÀ
VỮA XƠ ĐỘNG MẠCH TRONG ĐÁI THÁO ĐƯỜNG
1.1.1. Đái tháo đường
ĐTĐ là một hội chứng rối loạn chuyển hóa với sự tăng glucose máu do thiếu
tuyệt đối hoặc tương đối insulin. Sự thiếu hụt insulin ảnh hưởng tới chuyển hóa
carbohydrat, protein và lipid; gây ra các rối loạn hằng định nội môi của nước và điện
giải. Sự mất bù chuyển hóa cấp tính có thể gây tử vong; rối loạn chuyển hóa mạn tính
gây ra các thay đổi về cấu trúc và chức năng một cách thường xuyên và không thể
đảo ngược đối với các tế bào và mô của cơ thể, trong đó hệ thống mạch máu đặc biệt
nhạy cảm. Sự thay đổi này dẫn đến các biến chứng mạn tính của bệnh ĐTĐ [2].
ĐTĐ có thể xảy ra thứ phát sau các bệnh lý khác, ví dụ như viêm tụy mạn,
phẫu thuật tụy, tăng bài tiết các hormon đối kháng với insulin (hội chứng Cushing,
bệnh to đầu chi ). Tuy nhiên ĐTĐ thứ phát hiếm gặp. Phần lớn các trường hợp
ĐTĐ là tiên phát, được phân loại thành 2 týp. Týp 1 hay ĐTĐ phụ thuộc insulin
(insulin dependent diabetes mellitus - IDDM) là dạng ĐTĐ nặng, có biến chứng
nhiễm ceton nếu không được điều trị, thường gặp ở trẻ em và người trẻ. Bệnh
thường khởi phát một cách cấp tính, nồng độ insulin máu giảm hoặc không có do sự
phá hủy các tế bào β của đảo tụy. IDDM ít có tính chất gia đình nhưng có mối liên
quan rất rõ với một vài kháng nguyên phù hợp tổ chức như HLA - DR3 và DR4.
Týp 2 hay ĐTĐ không phụ thuộc insulin (non insulin dependent diabetes mellitus-
NIDDM) thường xảy ra ở những người trên 40 tuổi có béo phì, bệnh khởi phát từ
từ, hiếm khi gặp nhiễm ceton. Mặc dù bệnh biểu hiện không trầm trọng, nhưng các
bệnh nhân ĐTĐ týp 2 có nguy cơ cao phát triển các biến chứng mạch máu lớn và
vi mạch. Ở đa số các bệnh nhân ĐTĐ týp 2, tế bào β đảo tuỵ không nhạy cảm với
glucose, dẫn tới sự bài tiết insulin suy giảm. Với các trường hợp khác, đặc biệt
người béo phì, nồng độ insulin máu phần lớn là bình thường (ở một số bệnh nhân
có thể tăng) và có sự không nhạy cảm của các mô với insulin (tình trạng kháng
insulin) [79].
4
1.1.2. Rối loạn chuyển hóa lipid trong đái tháo đường
1.1.2.1. Lipid và lipoprotein trong máu
Thành phần lipid chính trong máu là acid béo tự do, triglycerid (TG), cholesterol
toàn phần (TC) gồm cholesterol tự do (FC) và cholesterol este (CE), các phospholipid
(PL). Vì không tan trong nước nên lipid trong huyết tương không lưu hành dưới dạng
tự do mà được gắn với protein đặc hiệu (apoprotein viết tắt là apo) tạo thành các phức
hợp lipoprotein (LP) vận chuyển trong máu và hệ bạch huyết [7][12][17].
* Cấu trúc, thành phần và phân loại lipoprotein:
Lipoprotein (LP) là những phần tử hình cầu, bao gồm phần nhân chứa đựng
những phân tử không phân cực là TG và CE, xung quanh bao bọc bởi lớp các phân
tử phân cực: PL, FC và các apolipoprotein (apo).
Có 5 loại lipoprotein chính theo tỷ trọng tăng dần khi siêu li tâm là: (1)
chylomicron (CM); (2) lipoprotein có tỷ trọng rất thấp (very low density lipoprotein -
VLDL); (3) lipoprotein có tỷ trọng thấp (low density lipoprotein - LDL); (4)
lipoprotein có tỷ trọng cao (high density lipoprotein - HDL) là sản phẩm chuyển hóa
của VLDL tiền chất của LDL (bình thường có hàm lượng rất thấp trong huyết tương);
(5) LP có tỷ trọng trung gian (Intermediate-density-lipoprotein IDL) là sản phẩm
thoái hóa của VLDL trong máu được gọi là VLDL tàn dư (remnant) [4][18].
Lipoprotein (a) hay Lp(a) là loại lipoprotein không điển hình với chức năng
chưa biết. Lp(a) to và nặng hơn LDL nhưng có thành phần tương tự, ngoại trừ có
thêm apo (a). Nồng độ Lp(a) trong huyết tương thay đổi nhiều giữa các cá thể, trong
khoảng từ 0 - 100mg/dL và được xác định do yếu tố di truyền. Nồng độ Lp(a) tăng
cao là một yếu tố nguy cơ độc lập của bệnh mạch vành.
Các apoprotein (apo) có vai trò quan trọng trong cấu trúc và chuyển hóa của
lipoprotein. Trong quá trình chuyển hóa lipid, các apo có một số các chức năng: (1)
chức năng nhận biết các receptor đặc hiệu trên màng tế bào; (2) chức năng điều hòa,
hoạt hóa hoặc ức chế một số enzym và là chất cộng tác của enzym; (3) chức năng
giúp các LP được vận chuyển trong máu và bạch huyết. Khi tính tan của các LP bị
rối loạn hoặc sự vận chuyển chúng bị chậm trễ sẽ dẫn đến tình trạng ứ đọng các
phân tử có chứa nhiều lipid, một trong những yếu tố gây vữa xơ động mạch [46]
[93][95].
5
Một số apo chính liên quan trực tiếp đến RLLPM [46][99]:
- Apo A: là thành phần cấu tạo của HDL, chủ yếu trong HDL mới sinh (được
tổng hợp ở gan). Nồng độ apo AI thấp là bệnh lý, phản ánh nguy cơ của bệnh tim mạch.
- Apo B 100 là protein cấu trúc chính trong VLDL và LDL, đóng vai trò chất
nhận diện các receptor màng tế bào đối với LDL, gắn với thụ thể LDL ở màng tế bào,
đưa LDL vào trong tế bào để cung cấp cholesterol cho tế bào. Apo B tham gia vào cơ
chế sinh bệnh của XVĐM và là nguyên nhân của nhiều bệnh lý tăng lipid máu. Apo
B, cholesterol cùng với VLDL và LDL là những yếu tố nguy cơ gây XVĐM. Tăng
apo B phản ánh sự thoái hóa cholesterol kém và sự ứ đọng cholesterol trong mô. Apo
B48 là protein cấu trúc chính trong CM, thiếu vị trí gắn với thụ thể của LDL.
Hình 1.1: Sơ đồ phân loại các lipoprotein [99]
1.1.2.2. Chuyển hóa lipoprotein
LP được chuyển hóa theo hai con đường ngoại sinh và nội sinh với sự tham
gia của các enzyme và protein vận chuyển. Bốn enzyme LPL (lipoprotein lipase),
HL (hepatic lipase), LCAT (lecithin cholesterol acyl transferase) và EL (endothelial
lipase) đóng vai trò sinh lý quan trọng trong chuyển hoá lipoprotein. Cholesteryl
este transfer protein (CETP) là một protein vận chuyển đặc hiệu, làm tăng vận
chuyển CE giữa HDL và các lipoprotein giàu TG. Phospholipid transfer protein
(PLTP) có tác dụng làm tăng sự trao đổi phospholipid giữa các lipoprotein [46].
* Chuyển hoá lipid ngoại sinh
TG, TC, PL từ lipid thức ăn được hấp thu qua niêm mạc ruột non tạo thành
CM. CM theo các bạch mạch đến ống ngực, đổ vào hệ tuần hoàn ở tĩnh mạch trên
đòn, tới mô mỡ và cơ. Tại các mô, TG được tách ra nhờ enzym LPL thành glycerol
và acid béo, các acid béo được dự trữ hoặc được các mô sử dụng làm nguồn cung
6
cấp năng lượng. Quá trình này xảy ra liên tục làm cho CM bị mất TG và tạo thành
CM tàn dư giàu cholesterol. CM tàn dư được gắn bắt ở tế bào gan nhờ các thụ thể
đặc hiệu với apo B 48 và apo E có trong thành phần CM tàn dư. Đời sống của CM
rất ngắn, chỉ vài phút. Ở gan, cholesterol được chuyển thành acid mật và đào thải
theo đường mật xuống ruột non, một phần cholesterol và TG tham gia tạo VLDL.
VLDL này rời gan vào hệ tuần hoàn để bắt đầu con đường vận chuyển hay chuyển
hoá lipid nội sinh (còn gọi là chuyển hoá lipid ở mạch máu) [7][53][94].
* Chuyển hoá lipid nội sinh
Con đường này liên quan đến lipid chủ yếu có nguồn gốc từ gan. VLDL giàu
TG chứa apo B100, apo E và apo C được tạo thành ở gan (90%) và một phần ở ruột
(10%) vào máu đến các mô ngoại vi, tại đây TG bị tách ra do tác dụng của enzym
LPL, đồng thời apo C cũng được chuyển để tạo thành HDL. VLDL chỉ còn lại apo
B100 và apo E, kích thước bị giảm dần. Một enzym khác cũng tác động đến
cholesterol của VLDL là enzym LCAT từ gan vào huyết tương, enzym này xúc tác sự
vận chuyển acid béo từ lecithin để este hoá phân tử cholesterol tạo thành CE. Như
vậy, VLDL sau khi giải phóng TG, nhận thêm CE và mất đi apo C, chuyển thành IDL
- tiền chất của LDL. Ở điều kiện bình thường LCAT tạo ra 75-90% CE trong huyết
tương, phần CE còn lại của huyết tương do gan hoặc ruột sản xuất bởi enzym ACAT
(acyl - Co A cholesterol acyl transferase) của nội bào [7]. Do vậy, sự thiếu hụt LCAT
gây nên các rối loạn chuyển hóa LP [95].
2.3+4566567
+ Lipoprotein tỷ trọng trung gian (IDL) trở lại gan, gắn vào các thụ thể đặc
hiệu (ApoB, E) ở màng tế bào và chịu tác dụng của lipase gan. Chuyển hoá của IDL
xảy ra rất nhanh: một phần IDL bị gan giữ lại, phần IDL còn lại trong tuần hoàn
được tách apo E để tạo thành LDL.
+ Lipoprotein tỷ trọng thấp (LDL) là chất vận chuyển chính cholesterol trong
máu, chủ yếu dưới dạng CE. LDL gắn với các thụ thể LDL nhận biết ApoB-100
trên màng tế bào gan (70%) và các màng tế bào khác của cơ thể (30%). Các LDL
được chuyển vào trong tế bào và thoái hóa trong lysosom, giải phóng FC.
Đại thực bào tạo ra từ các monocyt trong máu có thể bắt giữ LDL qua thụ thể
thu dọn. Quá trình này xảy ra ở các nồng độ LDL bình thường nhưng được tăng
7
cường khi nồng độ LDL tăng cao và bị biến đổi (LDL bị oxy hóa hoặc glycosyl hóa).
Sự bắt giữ LDL bởi đại thực bào ở thành động mạch là yếu tố quan trọng trong bệnh
sinh của VXĐM. Khi đại thực bào quá tải CE, chúng chuyển thành các tế bào bọt
(foam cell) – là thành phần tạo nên mảng vữa xơ [66][95].
Hình 1.2: Chuyển hoá lipoprotein nội và ngoại sinh [99]
+ Lipoprotein tỷ trọng cao (HDL) được tổng hợp tại gan hoặc từ sự thoái hóa
của VLDL và CM trong máu. HDL có chức năng thu hút FC thừa ở các mô đưa về
gan, chuyển hóa thành acid mật và đào thải theo đường mật. HDL đóng vai trò loại trừ
cholesterol thừa, vì vậy nó được gọi là “cholesterol tốt” và là cơ chế chống VXĐM
quan trọng nhất. Khi nồng độ apo A cùng với nồng độ HDL- C tăng, chứng tỏ sự
chuyển hoá tốt và sự đào thải tốt cholesterol, các chỉ số này giảm chứng tỏ sự bài xuất
cholesterol kém và sự ứ đọng cholesterol ở mô [7][53][67][95].
Ở người bình thường, quá trình tổng hợp và thoái hoá lipid diễn ra cân bằng
nhau và phụ thuộc vào nhu cầu cơ thể, vì thế duy trì được sự ổn định về nồng độ lipid
và LP trong máu. Khi có sự bất thường, các kiểu rối loạn chuyển hoá lipid sẽ xảy ra.
1.1.2.3. Rối loạn chuyển hóa lipoprotein
6867 ++, (,9::;7<,,<.(9=6567,. +>,(. ++,(9?567,%,,@
,(. ++,(96567 +>@,(. ++,(9656A7 +>@,(. ++,,,+&
BC74((+@1DDEF
8
* Phân loại theo Fredrickson:
Năm 1965, Fredrickson căn cứ vào kỹ thuật điện di và siêu ly tâm các thành
phần lipid huyết thanh và phân thành 5 týp dựa trên những thay đổi của thành phần
LP. Cách phân loại này nhanh chóng được chấp nhận nhưng sau đó, người ta đề
nghị tách týp II thành týp IIa có tăng LDL đơn thuần và týp IIb có tăng LDL,
VLDL. Bảng phân loại này trở thành phân loại quốc tế của WHO từ năm 1970.
Bảng 1.1. Phân loại rối loạn lipid máu theo Fredrickson có bổ sung [45]
Týp I IIa IIb III IV V
Cholesterol ↑ ↑↑ ↑↑ ↑
⊥ / ↑ ⊥ / ↑
Triglycerid ↑↑↑
⊥
↑↑ ↑↑ ↑↑ ↑↑↑
Lipoprotein ↑ CM ↑↑ LDL
↑ LDL
↑ VLDL
↑ IDL ↑ VLDL
↑ VLDL ↑
CM
Gây VXĐM Không + + + + + + + + + + +
2G7HIJ*KILM*KKILN*KKKIL
RLLPM có thể tiên phát do di truyền hoặc thứ phát sau các bệnh khác như béo
phì, nghiện rượu, những rối loạn nội tiết (ĐTĐ, suy giáp trạng, ), hội chứng thận
hư, suy thận mạn, sau dùng kéo dài một số thuốc (các loại glucocorticoid, thuốc lợi
tiểu,…) [12].
* Chế độ ăn và sự rối loạn chuyển hoá lipoprotein
Người ta thấy có mối tương quan thuận giữa mức tiêu thụ chất béo bão hòa với
nồng độ cholesterol máu: những dân tộc có thói quen ăn nhiều mỡ có hàm lượng
cholesterol máu cao hơn những dân tộc có thói quen ăn ít mỡ, đồng thời những bệnh lý
có liên quan tới tăng lipid máu như VXĐM, bệnh mạch vành, nhồi máu cơ tim có tần
xuất mắc tăng rõ rệt ở quần thể dân tộc ăn nhiều mỡ. Điều chỉnh chế độ ăn là một trong
các biện pháp quan trọng của điều trị rối loạn lipid máu [94][95].
1.1.2.4. Rối loạn chuyển hóa lipid trong đái tháo đường
Các đặc điểm chung nhất của rối loạn chuyển hóa lipid trong bệnh ĐTĐ là
TG máu tăng, HDL-C giảm và xuất hiện các phần tử LDL nặng và nhỏ hơn (tỷ
trọng tăng và kích thước nhỏ hơn). Những thay đổi này thường kèm theo sự tăng
nồng độ apo B huyết tương. Các rối loạn trên có thể gặp ở các bệnh khác và vì vậy
không đặc hiệu cho bệnh ĐTĐ. Nồng độ LP (a) có thể tăng trong ĐTĐ, nhưng sự
9
thay đổi LP này không được xem như nằm trong hội chứng rối loạn chuyển hóa
lipid của bệnh lý ĐTĐ [67][95].
Xu hướng xuất hiện các phần tử VLDL nhỏ, nặng và tăng IDL, phân bố lại các
LDL về phía những phân tử loại nhỏ và nặng hơn, sự thay đổi đáng kể thành phần
HDL đã được ghi nhận. Sự thay đổi thành phần lipid huyết tương xảy ra trong mỗi
loại LP với sự tăng tương đối tỷ lệ cholesterol tự do/phospholipid. Hơn nữa, người ta
đã quan sát thấy sự tăng mức độ glycosyl hóa bởi phản ứng không enzym với tất cả
các loại LP trong tuần hoàn. Nhiều nghiên cứu chỉ ra rằng LP ở các bệnh nhân ĐTĐ
tăng nhạy cảm với tác nhân oxy hóa, điều này có thể cũng làm tăng khả năng gây
VXĐM của chúng. RLLPM ở bệnh nhân ĐTĐ bao gồm cả sự thay đổi chất lượng và
số lượng lipid và lipoprotein huyết tương, mức độ trầm trọng của RLLPM ở bệnh
nhân ĐTĐ phụ thuộc vào týp bệnh, mức độ tăng glucose máu, mức độ thiếu hụt
insulin và yếu tố di truyền của RLLPM [2][45][46][47].
* Rối loạn chuyển hóa lipid trong đái tháo đường týp 1
- Tăng TG huyết tương: bất thường phổ biến nhất ở bệnh nhân ĐTĐ týp 1 là
tăng TG huyết tương do tăng VLDL. Rối loạn này sẽ mất đi khi kiểm soát được
glucose máu. Tăng VLDL có thể là kết quả của sự tăng bài tiết VLDL hoặc giảm
chuyển hóa VLDL do giảm lipoprotein lipase.
- Giảm HDL-C huyết tương: thường gặp phối hợp với tăng TG máu.
- LDL-C huyết tương: trong giới hạn bình thường ở bệnh nhân ĐTĐ týp 1.
Ở bệnh nhân ĐTĐ týp 1, bất thường chính của LP huyết tương là sự tăng
nồng độ VLDL huyết tương và tình trạng này sẽ được cải thiện khi việc điều trị
cùng với sự kiểm soát glucose máu một cách chặt chẽ được thiết lập.
* Rối loạn chuyển hóa lipid trong đái tháo đường týp 2
Rối loạn chuyển hóa lipid trong ĐTĐ týp 2 phổ biến hơn trong ĐTĐ týp 1.
Ảnh hưởng của ĐTĐ týp 2 trên chuyển hóa lipid và lipoprotein phức tạp hơn nhiều vì
nó chịu tác động của nhiều yếu tố như tình trạng kháng insulin, béo phì, phương pháp
điều trị, mức độ kiểm soát glucose máu, sử dụng thuốc điều trị các rối loạn phối hợp
và điều trị các biến chứng của bệnh ĐTĐ.
Rối loạn chuyển hóa lipid đặc trưng ở ĐTĐ týp 2 là tăng TG và giảm HDL-C,
và xuất hiện các phần tử LDL nặng và nhỏ (tỷ trọng tăng và kích thước nhỏ hơn)
10
trong huyết tương. Tăng TG máu do tăng bài tiết VLDL và sự giảm hoạt độ của
enzym LPL, đặc trưng bởi sự ứ đọng các phần tử tàn dư sau khi thuỷ phân VLDL, là
yếu tố gây VXĐM [2][45][46][47]. Ngoài ra người ta còn thấy tăng CT, tăng
cholesterol không HDL (nHDL-C), tăng apoB và giảm apoA-I [15][16][52][56] [62]
[72]. Các rối loạn trên có thể gặp ở các bệnh khác và vì vậy không đặc hiệu cho bệnh
ĐTĐ. Nồng độ Lp(a) có thể tăng trong ĐTĐ, nhưng sự thay đổi loại lipoprotein này
không được xem như nằm trong hội chứng RLLPM trong bệnh ĐTĐ.
Những đặc trưng của rối loạn lipid ở BN ĐTĐ týp 2:
- Rối loạn chuyển hoá VLDL: Tăng nồng độ insulin máu và béo phì trung
tâm đi kèm với tình trạng kháng insulin là yếu tố dẫn đến tăng sản xuất quá mức và
suy giảm thoái hoá VLDL [2][15].
Tăng sản xuất VLDL tại gan: Tăng sản xuất VLDL do tăng TG từ acid béo
trong vòng tuần hoàn [45]. RLCH ở những bệnh nhân kháng insulin cũng dẫn đến
tăng sản xuất VLDL, ngăn cản việc đưa VLDL ra khỏi gan và gây tăng TG trong gan.
Mặt khác, nồng độ LPL bị giảm ở những bệnh nhân có kháng insulin [2][15].
Giảm thanh thải VLDL: Những bệnh nhân tăng glucose máu đều có khiếm
khuyết về sự thanh thải VLDL. Các nghiên cứu mới đây cho thấy sự hoạt hoá enzym
LPL giảm ở những bệnh nhân tăng glucose máu, do sự kết hợp giữa sự giảm tiết
insulin và sự kháng insulin [87]. Hoạt độ của LPL ở bệnh nhân ĐTĐ týp 2 bình
thường, nhưng giảm thanh thải VLDL do tăng sản xuất VLDL. LDL trở nên bão hoà ở
nồng độ TG 150- 250mg/dl (1,7- 2,9mmol/l), làm mất sự thanh thải của VLDL.
Ngoài sự tăng nồng độ của VLDL, các thành phần trong tiểu phần VLDL
cũng thay đổi ở những bệnh nhân tăng glucose máu do rối loạn chuyển hoá của
VLDL. Người ta tìm thấy VLDL rất giàu TC, đó là nguyên nhân tiềm tàng làm tăng
quá trình VXĐM ở những bệnh nhân tăng glucose máu bởi vì tiểu phân tử VLDL
có thành phần rất giàu CT là thủ phạm gây VXĐM [2][15].
- Tăng TG: Thay đổi thường gặp nhất ở bệnh nhân ĐTĐ và tiền ĐTĐ là tăng
TG do tăng nồng độ VLDL. Nhiều nghiên cứu cho thấy có đến 50 - 100% bệnh
nhân ĐTĐ có tăng TG và tăng VLDL. Nghiên cứu của Heinz Drexel [83] cho thấy
nồng độ TG thấp ở nhóm có nồng độ glucose lúc đói bình thường, tăng nhẹ ở nhóm
rối loạn glucose máu lúc đói và tăng cao hơn ở nhóm ĐTĐ. Một trong những lý do
11
gây tăng TG là do tăng sản xuất quá mức VLDL giàu TG. Nguyên nhân sâu xa là do
tăng lưu lượng các chất, đặc biệt là glucose và acid béo tự do, đổ về gan [2][15].
- Tăng nồng độ IDL, LDL dạng nhỏ đặc: IDL được chuyển hoá bởi lipase
của gan tạo thành LDL. Hoạt động của lipase gan tăng ở bệnh nhân ĐTĐ týp 2 có lẽ
tham gia vào quá trình biến đổi LDL thành LDL nhỏ đặc [45].
Các nghiên cứu định lượng nồng độ TC và LDL-C ở bệnh nhân tăng glucose
máu (ĐTĐ týp 2 và tiền ĐTĐ) và không tăng glucose máu cho kết quả rất khác nhau.
Một số báo cáo thấy tăng nồng độ LDL-C, nhưng một số báo cáo lại thấy giảm nồng độ
LDL-C ở bệnh nhân tăng glucose máu so với nhóm chứng. Hầu hết các nghiên cứu đều
cho thấy rằng giới hạn về tỷ trọng của tiểu phần LDL-C từ 1,006 đến 1,063, khoảng giới
hạn tỷ trọng này bao gồm cả tiểu phần IDL. Vì vậy, nồng độ LDL-C tăng ở bệnh nhân
tăng glucose máu có thể do tăng nồng độ IDL. Ở những bệnh nhân ĐTĐ týp 2 có mối
liên quan giữa tăng glucose máu với giảm độ thanh thải của LDL-C. Ở những bệnh nhân
tăng glucose máu nhẹ (rối loạn glucose máu lúc đói và rối loạn dung nạp glucose) có thể
có hiện tượng tăng sản xuất LDL-C, được kích thích bởi insulin. Giảm sự thanh thải
LDL-C ở những bệnh nhân tăng glucose máu là do sự kháng insulin hoặc liên quan đến
giảm tiết insulin. Các thành phần trong tiểu phần LDL-C ở bệnh nhân ĐTĐ cũng thay
đổi, và những thay đổi này góp phần đáng kể về bất thường của chuyển hoá và VXĐM.
Tiểu phần LDL ở những bệnh nhân tăng glucose máu giảm khả năng liên
kết với các thụ thể và rất nhanh chóng bị oxy hoặc glycosyl hóa, tiểu phần LDL bị
biến đổi này được nhận biết bởi thụ thể của đại thực bào và tạo điều kiện hình thành
tế bào bọt, đó là nguy cơ gây VXĐM [44][49].
- Giảm nồng độ HDL-C máu: Những bệnh nhân tăng glucose máu đều có sự
gia tăng thanh thải HDL-C. Enzym lipase gan tăng hoạt hóa, góp phần giảm nồng
độ HDL. Glycosyl hoá HDL do tăng glucose máu cũng tương tác với sự kết gắn với
thụ thể HDL do vậy làm giảm nồng độ HDL-C. Sự thay đổi trong thành phần của
tiểu phần HDL có thể làm giảm vai trò của HDL trong sự vận chuyển ngược
cholesterol. Giảm nồng độ HDL và thay đổi các thành phần trong tiểu phần HDL là
một phần trong sự RLCH lipid gây nên bởi tình trạng kháng insulin [2][15].
@=OP+#+B::;F+$(( QRQ017
12
FFA là một liên kết quan trọng giữa béo phì với kháng insulin và ĐTĐ týp 2
(ĐTĐ không phụ thuộc insulin – NIDDM). Các kết quả nghiên cứu cho thấy nồng
độ FFA huyết tương tăng cao trong phần lớn những người mắc chứng béo phì. Sự
tăng FFA huyết tương ức chế sự hấp thu glucose ngoại vi dưới tác dụng kích thích
của insulin, ức chế sử dụng glucose của toàn cơ thể, ức chế oxy hoá glucose (chủ
yếu ở cơ) [61]. Hai cơ chế có thể là: (1) ức chế vận chuyển và phosphoryl hoá
glucose và (2) giảm hoạt tính glycogen synthetase ở cơ. Có rất nhiều bằng chứng
cho thấy oxy hoá acid béo ức chế oxy hoá glucose và kích thích tổng hợp glucose ở
gan. Tế bào β của tuỵ giảm đáp ứng bài tiết insulin dưới tác dụng kích thích của
glucose khi tồn tại trong trạng thái tiếp xúc dài ngày với acid béo [61].
1.1.3. Stress oxy hoá ở bệnh đái tháo đường
1.1.3.1. Các dạng oxy hoạt động trong cơ thể và quá trình peroxi hóa lipid
Các dạng oxy hoạt động bao gồm gốc tự do có oxy luôn được sản sinh trong
các hoạt động sinh lý của cơ thể sống. Nguồn sinh gốc tự do gắn liền với các
chuyển hóa tế bào như các phản ứng oxy hóa khử của tế bào trong quá trình thực
bào, trong các phản ứng khử độc của cơ thể bằng cơ chế oxy hóa, đặc biệt trong quá
trình hô hấp tế bào. Ngoài ra, gốc tự do còn hình thành trong cơ thể do những tác
nhân của môi trường và các chất dị sinh (các xenobiotic). Anion superoxid (O
2
•
–
)
được tạo nên trong quá trình hô hấp tế bào là gốc tự do đầu tiên, từ đó sinh ra hàng
loạt các dạng oxy hoạt động khác như hydroperoxid (H
2
O
2
), gốc hydroxyl (HO
•
),
oxy đơn bội (
1
O
2
), gốc peroxyl (LOO
•
), gốc alkyl (L
•
), gốc alkoxyl (LO
•
). Các dạng
oxy hoạt động này có liên quan đến nhiều quá trình bệnh lý của con người [17].
1
O
2
,
H
2
O
2
, HO
•
là những chất độc đối với tế bào vì chúng sẽ tấn công các acid béo không
bão hòa có trong lipid màng tế bào gây nên những biến đổi màng tế bào và biến đổi
của những phân tử DNA, gây đột biến gen
1
O
2
, HO
•
có hoạt tính hoá học rất mạnh,
chúng là thủ phạm chính gây peroxi hóa lipid màng, một gốc HO
•
sẽ oxy hóa hàng
trăm phân tử acid béo không bão hòa nhiều nối đôi theo cơ chế dây truyền trước khi
bị dập tắt [17].
1.1.3.2. Hệ thống chống oxy hóa của cơ thể
SOD
Catalase
GPx
13
Hệ thống chống oxy hoá của cơ thể có vai trò ngăn ngừa, chống lại và loại bỏ
tác dụng độc hại của các gốc tự do và các dạng oxy hoạt động khác.
* Hệ thống chống oxy hóa có bản chất enzym [17].
Loại này tồn tại chủ yếu trong tế bào; hoạt độ các enzym chống oxy hóa rất
thấp trong huyết tương, dịch sinh học khác như dịch não tủy, bao hoạt dịch…
Superoxid dismutase (SOD - EC.1.15.1.1):
Enzym này có trong tất cả các tế bào có chuyển hóa oxy, xúc tác sự phân hủy
anion superoxid.
2O
2
•
–
+ 2H
+
H
2
O
2
+ O
2
Vì superoxid liên tục được sinh ra và liên tục bị phá hủy nên SOD có hoạt tính càng
cao thì nồng độ superoxid càng nhỏ. Do đó, SOD là chất chống oxy hóa cơ bản, làm
hạ thấp nồng độ superoxid ban đầu mà từ đó sẽ sinh ra các dạng oxy hoạt động khác.
Catalase: Là enzym chống oxy hóa được biết đầu tiên, xúc tác phản ứng
phân hủy hydroperoxid vô cơ ở nồng độ cao. Catalase không phân hủy được
hydroperoxid hữu cơ và hydroperoxid vô cơ ở nồng độ thấp vì enzym này chỉ được
hoạt hóa khi hydroperoxid có nồng độ cao.
2H
2
O
2
2H
2
O + O
2
Glutathion peroxidase (GPx – EC.1.11.1.9): Glutathion peroxidase (GPx)
xúc tác phản ứng loại bỏ các peroxid hữu cơ và H
2
O
2
có nồng độ thấp:
2GSH + ROOH GSSG + ROH + H
2
O
GSH là glutathion dạng khử, GSSG là glutathion dạng oxy hóa, ROOH là
peroxid hữu cơ hoặc vô cơ).
Hệ thống glutathion peroxidase bao gồm 3 enzym: glutathion peroxidase
(GPx), glutathion reductase (GR) và glucose 6- phosphat dehydrogenase.
* Hệ thống chống oxy hóa có bản chất không enzym&
14
Gồm có 3 nhóm chính là nhóm các polyphenol, nhóm các thiol và nhóm các
phối tử của sắt hay đồng. Chúng hoặc có sẵn trong cơ thể hoặc được đưa từ ngoài
vào theo dạng thức ăn, nước uống.
+ Nhóm các polyphenol gồm vitamin A, vitamin E, coenzym Q, vitamin C và
các bioflavonoid. Các polyphenol có khả năng biến các gốc tự do hoạt động thành
các gốc trơ. Các flavonoid rất phổ biến trong thực vật, có bản chất là polyphenol.
Những flavonoid có hoạt tính sinh học được gọi là bioflavonoid; có tác dụng chống
oxy hóa, được sử dụng nhiều trong y học để điều trị một số bệnh có liên quan đến
gốc tự do như viêm mạn tính, bệnh tim mạch…[17].
+ Nhóm các thiol có tính khử mạnh nên chúng có thể cùng vitamin C chuyển
vitamin E từ dạng oxy hóa về dạng khử, phục hồi chức năng dập tắt quá trình peroxi
hóa lipid của vitamin E. Glutathion là thiol có vai trò rất quan trọng trong cơ thể.
Cơ chế hoạt động của glutathion được giả thiết là có liên quan đến phản ứng chuyển
một nguyên tử H tới các gốc tự do, hình thành gốc GS
•
, gốc này lại liên kết với một
gốc GS
•
khác tạo ra glutathion dạng oxy hóa GSSG. Một cơ chế hoạt động khác của
glutathion là khử các peroxid của các acid béo không bão hòa thành những hợp chất
hydroxy mang ít độc tính hơn và có thể bị chuyển hóa tiếp bởi quá trình β oxy hóa.
Ngoài ra glutathion còn có vai trò trong sự tái sinh vitamin E dạng oxy hóa.
Tóm lại, glutathion là một chất khử tuyệt vời, khử hoạt tính của các gốc tự do và
các peroxid, do đó ức chế POL ở màng trong ty thể [17].
+ Nhóm các phối tử của sắt và đồng: Ion sắt và ion đồng xúc tác phản ứng
Fenton, tạo nên hai dạng oxy hoạt động rất độc hại cho cơ thể là gốc hydroxyl và
oxy đơn bội. Khi sắt được chelat hóa hoàn toàn nghĩa là sắt tạo phức đủ sáu liên kết
phối trí (như trong hemoglobin, myoglobin), sắt sẽ không còn khả năng trên. Trong
nhóm này có transferin, lactoferin, ceruloplasmin [17].
1.1.3.3. Stress oxy hóa ở bệnh đái tháo đường
Các bệnh nhân ĐTĐ thường được cho là chịu tác động của các stress oxy
hóa. Mối liên quan giữa ĐTĐ và các stress oxy hóa đã được bàn luận rất nhiều từ
nhiều năm nay. Vậy nguồn gốc có thể của các stress oxy hoá trong ĐTĐ là ở đâu?
Liệu sự gia tăng các stress oxy hoá có phải là yếu tố đóng vai trò hàng đầu trong
15
bệnh sinh các biến chứng của ĐTĐ hay chúng chỉ là chỉ điểm thứ phát của các tổn
thương mô giai đoạn cuối của bệnh ĐTĐ?
Các nghiên cứu dịch tễ học đã cho thấy rằng sự tăng glucose máu mạn
tính là yếu tố nguy cơ cho sự phát triển các biến chứng của ĐTĐ. Khi nồng độ
glucose trong tế bào cao có thể gây độc bằng các cơ chế như tăng chuyển hoá
glucose theo con đường polyol, glucosamin, tạo thành các sản phẩm AGE, hiện
tượng glycosyl hoá không enzym, tạo thành và hoạt hoá protein kinase C [64][106].
* Tăng chuyển hoá glucose theo con đường Polyol
Chuyển hoá glucose theo con đường polyol góp phần gây ra glycosyl hoá
protein không enzym.
Hình 1.3. Chuyển hoá glucose theo con đường polyol [90]
Khi nồng độ glucose trong tế bào quá cao, aldose reductase xúc tác phản ứng
chuyển glucose thành polyalcol sorbitol bằng cách khử nhóm aldehyd của glucose
và sử dụng cofactor NADPH [90]. Phản ứng này xảy ra quá mức làm cạn kiệt
NADPH của tế bào. NADPH còn là cofactor thiết yếu cho sự tái tạo glutathion
dạng khử (hình 1.3). Vì vậy, bằng cách làm giảm lượng GSH, con đường polyol
làm tăng tính nhạy cảm với các stress oxy hoá trong tế bào. Một số các chất ức chế
aldose reductase như sorbinil, epalrestat đang được thử nghiệm trên lâm sàng.
* Hiện tượng Gluco-oxy hoá (gluco-oxidation) và sự tạo thành gốc tự do
và các sản phẩm tận (AGE) [104].
16
Trong quá trình glycosyl hoá, phân tử glucose mở vòng tạo glucose dạng mở
vòng (hydroxy aldehyd). Các hydroxy aldehyd này sẽ phản ứng với các nhóm amin tận
của phân tử lysin hoặc valin trong phân tử protein tạo thành các phân tử protein
glycosyl hoá, phản ứng không cần enzym (fructosamin và HbA1c). Glucose dạng
hydroxy aldehyd này cân bằng động với 3-deoxyglucoson (dạng ene-diol). Sự oxy hoá
của 3-deoxyglucoson thành glucose dạng dicarbonyl sản sinh ra các gốc tự do: anion
superoxid (
•
2
O
), hydroxy peroxid (H
2
O
2
) và các gốc tự do hydroxyl (HO
•
). Các gốc tự
do này sẽ mở đầu một dây chuyền sản sinh các gốc tự do nhiều gấp bội.
Hiện tượng glycosyl hoá tăng khi nồng độ glucose cao và có thể phát hiện
được ở nhiều protein của bệnh nhân ĐTĐ. Nồng độ hemoglobin glycosyl hoá
(HbA1c) được dùng như một chỉ số đánh giá nồng độ glucose máu đã được kiểm
soát như thế nào trong một giai đoạn một tháng trước đó. HbA1c chứa sản phẩm
Amadori của glucose gắn với N tận của valin của chuỗi β [106].
Các sản phẩm glycosyl hoá có thể bị oxy hoá (ví dụ bởi các dạng oxy hoạt
động) tạo các sản phẩm tận glycosyl (advanced glycation end- products - AGE). Sự
tạo thành AGE là không thuận nghịch, xảy ra trong giai đoạn hàng tháng đến hàng
năm và có thể gây tổn thương mô. Sự tích luỹ AGE trong collagen có thể làm giảm
tính đàn hồi của mô liên kết (tổn hại chức năng mạch máu) và làm tổn thương màng
đáy của thận. Ở những bệnh nhân ĐTĐ, AGE còn có mặt trong cả LDL của máu và
các tổn thương VXĐM.
Sự tăng tạo các tiền chất của AGE trong tế bào có thể gây tổn hại tế bào bởi
thay đổi các protein liên quan đến sự điều hoà sao chép gen trong tế bào; các tiền
chất AGE có thể khuyếch tán ra ngoài tế bào và làm biến đổi các phân tử gian bào
và làm thay đổi các protein trong máu (hình 1.6). Các protein bị biến đổi trong tuần
hoàn có thể gắn với AGE receptor và hoạt hoá chúng, làm tạo ra các cytokin gây
viêm và các yếu tố tăng trưởng, những yếu tố này gây bệnh lý mạch máu [12][15]
[106].
* Sự tăng hoạt tính của con đường hexosamin
17
Khi nồng độ glucose trong tế bào cao, phần lớn glucose được chuyển hoá
theo con đường glycolysis, trước tiên tạo glucose- 6 phosphat, sau đó là fructose - 6
phosphat và tiếp theo phần còn lại của chu trình. Tuy nhiên, khi fructose - 6
phosphat bị đổi hướng chuyển hoá theo con đường truyền tin, enzym glutamin
fructose-6 phosphat amidotransferase (GFAT) chuyển fructose-6 phosphat thành
glucosamin 6- phosphat và cuối cùng thành UDP (uridin diphosphat) N- acetyl
glucosamin. N- acetyl glucosamin gắn lên các gốc serin hoặc threonin của các yếu
tố sao chép (transcription factors) và sự thay đổi quá mức bởi glucosamin này
thường dẫn đến những thay đổi bệnh lý trong quá trình thể hiện gen [89].
Sự thay đổi yếu tố sao chép tăng lên dẫn đến tăng tổng hợp yếu tố tăng
trưởng chuyển dạng β1 (transforming growth factor - β1) và yếu tố ức chế hoạt hoá
plasminogen-1 (plasminogen activator inhibitor- 1), hai yếu tố này đều có tác dụng
xấu với mạch máu bệnh nhân ĐTĐ [75]. Mặc dù con đường hexosamin là yếu tố
mới được nhận biết nhất đóng góp vào bệnh sinh các biến chứng ĐTĐ, nó dường
như đóng vai trò quan trọng trong cả những bất thường ở tế bào cầu thận cũng như
rối loạn chức năng tế bào cơ tim do tăng glucose máu gây ra [70]. Ở những mảng
VXĐM cảnh của bệnh nhân ĐTĐ týp 2, sự thay đổi các protein tế bào nội mô bởi
con đường hexosamin cũng tăng có ý nghĩa [77].
* Hoạt hóa Protein Kinase C (PKCF[100]
Khi glucose máu tăng làm tăng sự tạo thành các dẫn xuất của oxy hoạt động
(ROS), ROS gây tăng lượng diacylglycerol (DAG) bằng hai cách trực tiếp và gián
tiếp: trực tiếp là tăng tổng hợp DAG mới do ROS ức chế enzym glyceraldehyd
phosphat dehydrogenase và gián tiếp là do các ROS hoạt hóa enzym phospholipase
D, enzym thủy phân phosphatidylcholin tạo ra DAG [100].
Tăng nồng độ diacylglycerol và hoạt hóa enzym PKC dạng đồng phân β và
δ, tăng hoạt tính protein kinase sẽ tăng sản sinh các cytokin, chất ức chế phân hủy
plasminogen-1 (plasminogen activator inhibitor-1), endothelin 1. PKC bị hoạt hóa,
làm thay đổi sự sao chép gen của fibronectin, collagen loại IV, các protein co cơ,
các protein nền trong tế bào nội bì và các neuron.
18
Hình 1.4. Cơ chế duy nhất gây tổn thương tế bào do tăng glucose máu [100]
Các yếu tố tăng trưởng đóng vai trò quan trọng trong biến chứng mạn tính
của ĐTĐ, như yếu tố tăng trưởng nội mạc mạch máu VEGF (vascular endothelial
growth factor) và yếu tố tăng trưởng giống insulin (IGF-β). Yếu tố tăng trưởng nội
mạc mạch máu gia tăng trong bệnh võng mạc tăng sinh do ĐTĐ, yếu tố tăng trưởng
giống insulin gia tăng trong bệnh thận do ĐTĐ, kích thích các tế bào trung mô tăng
sản xuất collagen và fibronectin, làm dầy màng đáy cơ bản ở cầu thận [100].
Tất cả thay đổi trên dẫn đến làm dày màng đáy, thay đổi tính thấm, hoạt hóa
quá trình tân tạo mạch, rối loạn điều hòa dòng chảy. Hậu quả của sự rối loạn thăng
bằng này là gây rối loạn chức năng thành mạch, tạo điều kiện tổn thương lớp tế bào
nội mô, tạo mảng xơ vữa, gây ra bệnh lý mạch máu, nguyên nhân của hầu hết các
biến chứng mạn tính, làm giảm chất lượng cuộc sống, thậm chí đe dọa tính mạng
của bệnh nhân [56][71].
Cơ chế duy nhất gây tổn thương tế bào giải thích biến chứng mạch máu lớn
trong ĐTĐ: Trái với các biến chứng vi mạch, các dữ liệu từ UKPDS cho thấy tăng
glucose máu không phải là yếu tố quyết định chính của biến chứng mạch máu lớn
trong ĐTĐ mà là sự kết hợp giữa các yếu tố nguy cơ khác như kháng insulin và hội
chứng chuyển hoá. Tác hại của kháng insulin là tăng dòng acid béo tự do từ mô mỡ
tới các tế bào nội mạc mạch máu [64]. Trong các tế bào nội mạc mạch máu lớn, sự
tăng dòng acid béo tự do này dẫn đến tăng oxy hoá acid béo tự do bởi ty thể. Vì cả
hai quá trình β- oxy hoá acid béo và oxy hoá acetylCoA- sản phẩm của β-oxy hoá
acid béo- bởi chu trình citric đều sinh ra các chất cho điện tử (NADH và FADH
2
)
tương tự như oxy hoá glucose, sự tăng oxy hoá acid béo tự do gây ra tăng sản xuất
19
ROS bởi ty thể theo cơ chế tương tự như glucose máu tăng như đã mô tả ở trên.
Giống như tăng glucose máu, sự tăng ROS bởi các acid béo tự do này cũng hoạt hoá
những con đường tương tự gây tổn thương tế bào: AGE, PKC, hexosamin và NFκB
(Necrosis Factor κB). Trong các mô hình động vật không ĐTĐ có kháng insulin, ức
chế giải phóng acid béo tự do từ mô mỡ hay oxy hoá acid béo tự do ở nội mạc động
mạch đều ngăn ngừa sự tăng tạo ROS và các tổn thương của nó.
1.1.4 Đái tháo đường và vữa xơ động mạch
* Thế nào là vữa xơ động mạch
Theo định nghĩa của Tổ chức Y tế thế giới “VXĐM là sự phối hợp những biến đổi
của lớp nội mạc động mạch bao gồm sự tích tụ tại chỗ lipid và phức hợp glucid, máu và
các sản phẩm của máu, tổ chức xơ và calci, kèm theo những biến đổi của lớp trung mạc”.
VXĐM là bệnh của động mạch lớn và vừa, thể hiện bằng hai loại tổn thương
cơ bản và đặc trưng là mảng vữa xơ rất giàu cholesterol và mô xơ được hình thành
ở lớp nội mạc và một phần lớp trung mạc; làm hẹp lòng động mạch, cản trở máu
đến nuôi dưỡng các tổ chức [12][29].
Có nhiều yếu tố nguy cơ gây nên VXĐM như RLCH lipid, THA, béo phì, ĐTĐ,…
trong đó rối loạn chuyển hóa lipid đóng vai trò chủ yếu [2][45][46]. Các bệnh nhân ĐTĐ
có nguy cơ phát triển VXĐM cao hơn từ 2 đến 6 lần so với người không ĐTĐ.
* Cơ chế sinh VXĐM do rối loạn lipid máu
VXĐM xuất hiện trên bề mặt động mạch có tổn thương do rối loạn thâm
nhập của lipid, làm thay đổi cấu trúc của thành động mạch. Người ta cho rằng, trước
hết phải có tổn thương tế bào nội mạc thành động mạch do nhiều yếu tố như ảnh
hưởng của dòng máu có áp lực cao và liên tục trong bệnh tăng huyết áp, hút thuốc
lá, một số thuốc và hoá chất, RLLPM, nhiễm khuẩn và virus Khi bị tổn thương,
lớp nội mạc mất khả năng bảo vệ thành mạch, tiểu cầu lập tức tách ra khỏi dòng
máu để tập trung vào chỗ nội mạc bị bộc lộ và kết dính lại, giải phóng ra nhiều chất
trong đó có yếu tố PDGF (Platelet derived growth factor) kích thích sự di chuyển
của các tế bào cơ trơn ở lớp trung mạc ra lớp nội mạc và phát triển ở đó. Các
monocyte từ dòng máu cũng đến chỗ tổn thương và chuyển thành đại thực bào,
cũng giải phóng ra các chất kích thích tương tự [2][45][46].
20
Hình 1.5. Vai trò của lipid và lipoprotein trong vữa xơ động mạch [19].
Lipoprotein đóng vai trò quan trọng trong bệnh sinh của VXĐM. Các
lipoprotein chứa apo B chuyển cholesterol cho thành động mạch và là tác nhân gây
VXĐM. Nồng độ HDL giảm dẫn tới giảm quá trình vận chuyển cholesterol ra khỏi
thành động mạch. Ở thành động mạch, các đại thực bào và các tế bào cơ trơn có ái
lực mạnh với một số thành phần của LP lưu thông, nhất là với CE (thành phần có
nhiều trong LDL) chúng có thụ thể đặc hiệu tiếp nhận LDL. Khi LDL tăng cao và
tồn tại lâu trong máu sẽ bị oxy hóa hay glycosyl hóa tạo nên LDL biến đổi. Những
"LDL biến đổi" khi tiếp xúc với tế bào nội mạc sẽ không được thu nhận, trừ các đại
thực bào và tế bào cơ trơn thành mạch do ở những tế bào này có thụ thể đặc hiệu
cho "LDL biến đổi", nhưng lại không có khả năng tự điều hoà cholesterol nên thu
nhận tất cả những "LDL biến đổi" và trở thành các tế bào bọt, tổn thương sớm của
VXĐM và là điểm báo trước những tổn thương cấp diễn hơn. Cholesterol tích tụ
trong tế bào đến mức quá tải sẽ làm căng vỡ tế bào. Tiếp theo sự chết của các tế
bào, là sự thanh toán dọn dẹp chúng của những tế bào có chức năng "làm sạch" đó
là các đại thực bào. Các tế bào này cũng bị chết, để lại sự ngổn ngang và nham nhở
lòng động mạch, từ đó làm tăng sự kết tụ tiểu cầu và sự rối loạn huyết động, làm
dày, xơ cứng và hẹp lòng động mạch dẫn đến các biến chứng như nhồi máu cơ tim,
tai biến mạch máu não [29][53].
21
* Đái tháo đường và vữa xơ động mạch
Đối với bệnh nhân ĐTĐ týp 2, cơ chế VXĐM rất phức tạp. Ngoài các yếu tố
nêu trên còn có sự tham gia và thúc đẩy quá trình VXĐM như THA, nồng độ cao
của glucose máu, sự kháng insulin, tăng insulin máu, các sản phẩm tận của quá trình
glycosyl hóa,…[15].
ĐTĐ là bệnh RLCH gây hậu quả nặng nề với các biến chứng có nguy cơ
phát triển VXĐM cao hơn từ 2 đến 6 lần so với người bình thường và một phần của
nguy cơ cao này là do RLLPM. Trong ĐTĐ, RLLPM có đặc điểm là tăng các
lipoprotein chứa apo B gây VXĐM, xuất hiện các LDL nhỏ, nặng và giảm HDL. Vì
LDL nhỏ, nặng có thể đi vào khoang dưới nội mạc một cách dễ dàng, gắn với
proteoglycan và làm tăng khả năng bị oxy hóa. Các LDL bị oxy hóa tăng lên trong
ĐTĐ và hội chứng kháng insulin [2][45][46].
Nồng độ HDL giảm trong đái tháo đường cùng với sự bất thường thành phần
cấu tạo có thể ảnh hưởng đến chức năng HDL, làm giảm quá trình vận chuyển
cholesterol ngược, do đó tăng ứ đọng lipid ở mạch máu.
Tất cả các loại lipoprotein bị glycosyl hóa tăng trong ĐTĐ. LDL glycosyl hóa
gắn kém với thụ thể LDL, do đó kéo dài thời gian lưu hành trong máu và có thể trong
khoang ngoài tế bào thành động mạch, tại đó chúng bị các biến đổi oxy hóa. LDL
glycosyl hóa tăng nhạy cảm với tác nhân oxy hóa.
Sự tạo thành các sản phẩm tận glycosyl hóa (advanced glycation end -
product) tăng trong ĐTĐ, các protein này gắn với receptor đặc hiệu trên tế bào thành
mạch dẫn đến tăng stress oxy hóa trong tế bào, tổng hợp các phần tử kết dính tế bào
nội mạc, hóa ứng động các monocyte, giải phóng các cytokin và các yếu tố tăng
trưởng. Vì vậy, các con đường oxy hóa, glycosyl oxy hóa tăng trong ĐTĐ là có khả
năng làm tăng quá trình VXĐM [2][45][46].
Các nghiên cứu mới đây cho rằng các mảng vữa xơ ở bệnh nhân ĐTĐ tương
tự mảng vữa xơ ở bệnh nhân không ĐTĐ nhưng chụp ảnh động mạch vành và giải
phẫu bệnh thì tổn thương mạch vành ở bệnh nhân ĐTĐ là tổn thương lan toả và cả ở
phần xa của động mạch vành [2][15]. Các yếu tố nguy cơtim mạch có thể có trước
khi xuất hiện bệnh ĐTĐ týp 2, chứng tỏ sự can thiệp đa yếu tố để dự phòng bệnh
mạch vành là hết sức cần thiết [45].
22
1.2. ĐÁI THÁO ĐƯỜNG VÀ RỐI LOẠN CHUYỂN HOÁ LIPID THEO
Y HỌC CỔ TRUYỀN
1.2.1. Đái tháo đường theo quan niệm của Y học cổ truyền
Y học cổ truyền không có bệnh danh “đái tháo đường”; nhưng đối chiếu với
các chứng trạng lâm sàng, căn bệnh này được quy vào phạm vi chứng “tiêu khát”.
Chứng tiêu khát của YHCT là chứng do rất nhiều nguyên nhân gây ra, trên
lâm sàng lấy các triệu chứng chính như uống nhiều, ăn nhiều, tiểu tiện nhiều, gầy
sút, mệt mỏi hoặc nước tiểu có vị ngọt gọi là chứng “Tam đa nhất thiểu” (Nội kinh
tố vấn) [10][13]. “Tiêu” có ba hàm ý, một là chỉ thức ăn nước uống tiêu nhanh nên
mau đói và uống nhiều, hai là chỉ tiêu hao tân dịch nhiều làm cho tân dịch mất nuôi
dưỡng, âm không thắng dương, hỏa nhiệt nội sinh, ba là chỉ hình thể yếu gầy, cơ
nhục teo nhẽo, sút cân [117]. Bệnh thường gặp ở những người ăn uống không điều
độ hoặc do rối loạn tình chí, mừng, giận, bi, thương quá mức, tinh thần bị căng
thẳng mà dẫn đến chứng bệnh tiêu khát [27][28].
1.2.1.1. Cơ chế bệnh sinh
Nguyên nhân, cơ chế, bản chất bệnh là phụ thuộc vào nhiều yếu tố như tiên
thiên bất túc, tình chí thất điều, ẩm thực bất tiết, lục dâm xâm phạm, lao dục thất độ
dẫn đến ngũ tạng hư nhược, uất lâu ngày hóa hoả, tích nhiệt thương tân, hoả gây tổn
âm, hao tinh thương thận. Cơ chế bệnh có liên quan đến âm tinh hao tổn, tích nhiệt
nội thịnh mà dẫn đến âm hư là chủ yếu. Âm hư là bản, táo nhiệt là tiêu. Hai yếu tố
này là nhân - quả suốt quá trình chứng tiêu khát. Bản chất bệnh ảnh hưởng đến nhiều
cơ quan tạng phủ (nhưng chủ yếu là ba tạng phế, vị, thận) tức là thượng tiêu, trung
tiêu, hạ tiêu; giữa phế, vị và thận thường cho là thận quan trọng nhưng đều hỗ tương
ảnh hưởng; vì vậy ăn nhiều, uống nhiều, tiểu nhiều, cũng là tương hỗ với nhau [35]
[39].
Sự chuyển hoá bình thường của thuỷ dịch trong cơ thể được đảm bảo bởi sự
hoạt động điều hoà của 3 tạng tỳ, phế, thận. Tỳ chuyển hoá thuỷ cốc thành tân dịch
vận chuyển lên phế, phế tiếp thu thuỷ dịch chuyển xuống thận, thận chưng hoá khai
hợp chuyển phần thanh lên phế, phần trọc ra nước tiểu. Sự phân thanh, giáng trọc
của tân dịch và sự bài tiết của thuỷ dịch là mấu chốt quan trọng để duy trì sự thăng
23
bằng của thuỷ dịch trong cơ thể. Sự mất cân bằng hoặc tổn thương các chức năng
tạng phủ sẽ làm tân dịch không phân bố và vận hành được, do đó tân dịch mất sự
quản lý sẽ bài tiết ra ngoài cơ thể gây chứng tiêu khát [5][13].
Theo Hải Thượng Lãn Ông: "Chứng tiêu khát phần nhiều do hoả làm tiêu hao chân
âm, năm chất dịch khô kiệt mà sinh ra" trong đó 3 tạng phế, tỳ, thận là chủ yếu [39].
Theo Cảnh nhạc toàn thư: Chứng tiêu khát là bệnh của tam tiêu, về thượng
tiêu chủ yếu là khát, uống nhiều, càng uống càng khát vì thượng tiêu tân dịch bị khô
kiệt, hoả ở tâm tỳ dương minh đều có thể hun đốt gây nên (còn gọi là cách tiêu); ăn
nhiều mau đói, không sinh ra da thịt mà người gầy là bệnh ở tỳ vị thuộc về trung
tiêu; đái nhiều, mệt mỏi, đau lưng, mỏi khớp là bệnh tại thận thuộc về hạ tiêu [39].
R+$$.S /TS*U*"7
- Phế: Phế chủ khí, phế khí tuyên thông thì bình thường điều tiết quản lý tân
dịch, cái tinh hoa trong tân dịch phế điều tiết được. Ngược lại, nếu phế khí trái
thường thì không thể điều tiết quản lý tân dịch, cái tinh hoa trong tân dịch là do mất
sự quản lý mà theo tiểu tiện bài tiết ra ngoài cơ thể, vì thế mà sinh chứng tiêu khát.
Sách "Bản thảo cương mục" viết: "Phế chứa khí, phế không bệnh thì có thể
quản lý tân dịch mà cái tinh vi của tân dịch mới nuôi nấng được cân cốt, huyết
mạch, còn thừa quá ngưỡng thì phải thải ra ngoài" [10][13][39].
- Tỳ: Tỳ chủ vận hoá, tỳ có bệnh thì không vận chuyển được thuỷ cốc và chất
tinh hoa của thuỷ cốc đi nuôi dưỡng cơ thể mà lại đào thải ra ngoài qua đường tiểu
tiện. Sách "Y Quán tiêu khát luận" viết "Tỳ thổ cùng vị thông hành tân dịch, tỳ vị đã
hư thì không thể phân bố được tân dịch nên khát, đói " [10][13][39].
- Thận: Thận chủ về nguyên âm và nguyên dương trong cơ thể, thận bị bệnh
nguyên âm không đủ thì không giúp hoả, hư hoả phạm lên mà sinh tiêu khát. Sách
"Đan Khê tâm pháp" viết: "Nhiệt phục ở dưới, thận hư phải chịu nên đầu gối, chân
khô gầy, xương khớp nhức đau, tinh chạy mất, tuỷ rỗng không, đòi uống nước".
Thận bị bệnh, nguyên dương không đủ đưa đến chức năng khí hoá của bàng quang
kém, thận tàng tinh, tinh khí không được tạo ra và đưa đi nuôi dưỡng cơ thể mà theo
tiểu tiện ra ngoài [10][13][39].
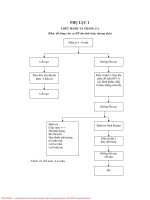
Cơ chế bệnh sinh chứng tiêu khát có thể tóm tắt trong sơ đồ sau:
24
ẨM THỰC
BẤT TÚC
TIÊN THIÊN
BẤT TÚC
TÌNH CHÍ
THẤT ĐIỀU
LAO LỰC
QUÁ ĐỘ
TỔN THƯƠNG
TỲ VỊ
NGŨ TẠNG
HƯ NHƯỢC
KHÍ UẤT
HÓA HỎA
ÂM DỊCH
TIÊU HAO
ÂM
HƯ
NỘI
NHIỆT
TÁO NHIỆT
THƯƠNG PHẾ
PHẾ VỊ
TÁO NHIỆT
TỲ VỊ KHÍ HƯ
THẤP NHIỆT
CAN THẬN
ÂM HƯ
TÂN DỊCH
MẤT PHÂN
BỐ
TRUNG TIÊU
NHIỆT MẠNH
TIÊU CỐC
TINH VI BÂT
SINH, TỨ CHI
THẤT DƯỠNG
TÀNG CHỨA
THẤT ĐIỀU, CỐ
NHIẾP VÔ NĂNG
ĐA
ẨM
ĐA
THỰC
GÀY
MÒN
ĐA
NIỆU
Hình 1.6: Sơ đồ tóm tắt cơ chế bệnh sinh chứng tiêu khát
1.2.2. Quan niệm của YHCT về hội chứng rối loạn lipid máu
1.2.2.1. Chứng đàm thấp, nguyên nhân, cơ chế bệnh sinh
Đàm thấp là sản phẩm bệnh lý, đàm là chất đặc, thấp không đặc như đàm, đàm
thấp sau khi sinh sẽ gây ra những chứng bệnh mới. Theo Y văn cổ: "Chứng đàm
thấp là một loại chứng bệnh mà nguyên nhân gây bệnh chính là thủy ứ đọng lại ở
một vị trí trong cơ thể, không vận hoá theo qui luật bình thường”. Sách “”
gọi là tích ẩm, “V%WX.S Y” gọi là đàm thấp [10][11].
Nguồn gốc sinh ra đàm thấp do sự vận hoá bất thường của tân dịch ngưng tụ
biến hoá mà thành. Bình thường sự vận hoá thủy thấp trong cơ thể được điều hoà
bởi 3 tạng tỳ, phế, thận. Bởi vậy đàm thấp có liên quan đến 3 tạng tỳ, phế, thận.
Chứng thuộc tỳ là chứng quan trọng nhất trong vấn đề cơ chế sinh chứng đàm trệ.
Đàm thấp do tỳ dương mất chức năng vận hoá, làm chuyển hoá tân dịch bị ngưng
trệ lại thành thấp, thấp thắng sinh ra đàm …[10][11].
Có 2 loại đàm: đàm hữu hình và đàm vô hình. Đàm hữu hình là chất đàm
sinh ra từ phế, thận. Đàm vô hình phải thông qua triệu chứng mới biết được. Hội
chứng RLLPM theo YHCT là do đàm vô hình gây bệnh. Biểu hiện trên lâm sàng rất
đa dạng. Đàm thấp thì người béo phì, đi lại nặng nề.
Nguyên nhân và cơ chế sinh đàm: Tỳ hư đàm thấp có thể do:
- Ăn uống nhiều chất béo ngọt tổn hại tỳ vị, vận hoá thủy thấp rối loạn, đàm
thấp nội sinh.
25
- Do tình chí: lo, nghĩ, giận dữ, làm tổn thương can tỳ, can mộc khắc tỳ thổ
làm tổn thương tỳ vị, làm tỳ giảm hoặc mất khả năng vận hoá thuỷ cốc, tân dịch tụ
lại thành đàm thấp.
- Do ít vận động thể lực: nằm nhiều hại khí, ngồi nhiều hại cơ nhục. Thương
khí dẫn đến khí hư, thương nhục dẫn đến tỳ hư, tỳ khí hư suy mà sinh đàm thấp [7].
Đàm thấp sau khi hình thành theo khí đi các nơi, ở ngoài đến cân xương, trong
đến tạng phủ, không đâu là không đến làm ảnh hưởng sự vận hành khí huyết. Sự thăng
giáng của khí gây ra các chứng bệnh ở các bộ phận của cơ thể [10][11].
Dựa vào tính chất ngũ khí kết hợp với đàm thấp người ta chia đàm thấp ra
làm 5 loại: phong đàm, hàn đàm, nhiệt đàm, táo đàm, thấp đàm. Đàm sinh ra bệnh
biến hoá rất phức tạp. Yếu tố thấp hay gặp nhất trong nguyên nhân gây chứng đàm
thấp [10][11].
1.2.2.3. Sự tương đồng giữa chứng đàm thấp và hội chứng rối loạn lipid máu
Trong nhiều năm qua, nhiều nghiên cứu trong và ngoài nước, đặc biệt ở Trung
Quốc đã đi sâu phân tích, tìm mối liên hệ giữa hội chứng RLLPM của YHHĐ với
các chứng trạng của YHCT. Căn cứ trên các biểu hiện lâm sàng, người ta thấy giữa
hội chứng RLLPM và chứng đàm thấp có một sự tương đồng khá sâu sắc về bệnh
nguyên, bệnh sinh và nguyên tắc trị liệu [38].
- Bệnh nguyên:
Chứng đàm thấp phát sinh do những nguyên nhân chủ yếu sau đây:
+ Yếu tố thể chất do tiên thiên quyết định, thường là tiên thiên bất túc. Sách
linh khu thiên: "Thọ yểu cương nhu" viết "con người ta sinh ra có cương có nhu, có
cường có nhược, có nặng có nhẹ, có âm có dương", yếu tố này có thể hiểu tương tự
như nguyên nhân di truyền của YHHĐ.
+ Yếu tố ăn uống (ẩm thực) do ăn quá nhiều các chất cao lương, thức ăn ngọt
béo làm tổn thương tỳ vị, khiến vận hoá thất điều, đàm thấp nội sinh mà dẫn đến
bệnh tật. Yếu tố này tương tự như việc ăn quá nhiều thức ăn mỡ động vật và phủ
tạng mà YHHĐ quan niệm.
+ Yếu tố ít vận động thể lực: Sách Tố vấn thiên "tuyên minh ngũ khí luận" viết
"cửu ngọa thương khí, cửu toạ thương nhục" (nằm nhiều hại khí, ngồi nhiều hại cơ