Bài 12 - HNO3 và muối nitrat
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (497.1 KB, 45 trang )
BÀI 12
AXIT NITRIC VÀ MUỐI NITRAT
GV:Vũ Ngọc Toản – CHK17- ĐHSP Hà Nội
HOạT ĐộNG 1:CHIA NHÓM ( 2 PHÚT)
Yêu cầu các bạn nhanh chóng ngồi theo
nhóm theo sơ đồ trên máy tính
Cho hình ảnh axit HNO
3
HOạT ĐộNG 2
I – TÌM HIểU Về TÍNH CHấT VậT LÍ CủA
HNO
3
Câu h i 1 (1 phút)ỏ
Quan sát l đ ng axit HNOọ ự
3
và t đi n các ự ề
thông tin c n thi t vào phi u:ầ ế ế
-
Tr ng thái…………., Kh i l ng riêng……..ạ ố ượ
-
-Màu s c……………, Nhi t đ sôi……………ắ ệ ộ
-
-Dung d ch HNOị
3 đ cặ
có C% = ……
Câu hỏi 2( 4 phút) Cho 2 bình đựng HNO
3
sau:
Bình 1 bình 2
Mức độ 1:Lọ nào chứa HNO
3
mới, lọ nào chứa
HNO
3
đã để lâu trong phòng thí nghiệm.
------------------------------------------------------------
------------------------------------------------------
Mức độ 2:Tại sao lại có sự khác biệt như trên ?
màu vàng là màu của chất nào ?
------------------------------------------------------------
------------------------------------------------------
Mức độ 3:Dùng phương trình hóa học để chứng
minh sự khác biệt trên ?
M c đ 4ứ ộ :V y theo b n ph i làm th nào đ ậ ạ ả ế ể
b o qu n HNOả ả
3
trong phòng thí nghi m ? đ a ệ ư
ra lí do c a b n ?ủ ạ
……………………………………………………………
……………………………………………………………
……………………………………………………………
HOạT ĐộNG 3:
TÌM HIểU Về CấU TạO CủA HNO
3
Câu hỏi 3 (5 phút)
1.Vi t CTCT c a HNOế ủ
3
, cho bi t trong các liên ế
k t đó liên k t nào ế ế phân c c nh tự ấ ? đ a ra 2 ư
d n ch ng (cho đ âm đi n c a H, O, N l n ẫ ứ ộ ệ ủ ầ
l t là:2,2; 3,44; 3,04)ượ
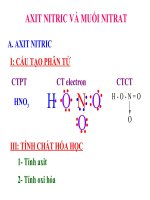
a.Công th c c u t o:ứ ấ ạ
D n ch ng v m t lí ẫ ứ ề ặ
thuy t…………………………………………………ế
D n ch ng v m t th c ẫ ứ ề ặ ự
nghi m…………………………………………………ệ
CTCT
O
H O N
O
Liên kết H – O phân cực nhất do
+ Hiệu độ âm điện H – O bằng 1,24 > 0,84 của N – O
+ Trong nước HNO
3
H
+
+ NO
3
−
2.Ch n 1 trong các ph ng án sau: Hóa tr , s ọ ươ ị ố
oxi hóa và tr ng thái lai hóa c a c a N trong ạ ủ ủ
phân t HNOử
3
l n l t là:ầ ượ
A.V , +5, sp B.IV,+5 và sp
2
C.III, +5 và sp
2
D.IV, +4,
sp
a ra l i gi i thích c a Đư ờ ả ủ
b n………………………………………………………ạ
…………………………………………………………..
Thời gian thảo luận là 3 phút ( chú ý đến dạng hình học
ở trên)
Cho sơ đồ sau:
Từ cấu tạo, trạng thái oxi hóa của HNO
3
Bạn hãy dự đoán
tính chất hóa học của HNO
3
-3 0 +1 +2 +3 +4 +5
NH
4
NO
3
N
2
N
2
O
NO
NO
2
HNO
3
NO
2
−
Mang đầy đủ tính chất của một axit thông thường
1.Làm quỳ tím chuyển thành màu đỏ
2.Tác dụng với bazơ
3.Tác dụng với oxit bazơ
4.Tác dụng với muối của axit yếu
5.Tác dụng với kim loại
HOạT ĐộNG 5
TÌM HIểU TÍNH CHấT HÓA HọC CủA HNO
3
1.Tác dụng với kim loại
Câu hỏi 4 ( 5 phút)
-
-N u cho 1 m u Cu vào dung d ch HCl thì s ế ẩ ị ẽ
thu đ c s n ph m và hi n t ng gì ? gi i ượ ả ẩ ệ ượ ả
thích ?
-
- N u cho 1 m u Cu vào dung d ch HNOế ẩ ị
3
thì
s thu đ c s n ph m và hi n t ng gì ? ẽ ượ ả ẩ ệ ượ
gi i thích ?ả
Mời các bạn cùng quan sát thí nghiệm, kiểm
tra lại giả thuyết và từ đó kết luận về khả
năng oxi hóa của H
+
so với NO
3
−
? Viết pt
dạng phân tử và ion rút gọn ?
Cu không tác dụng được với HCl do tính oxi hóa
của H
+
yếu
Phản ứng tạo ra NO
2
có mầu nâu đỏ ứng với
N
+5
+ 1e N
+4
Chứng tỏ tính oxi hóa của H
+
yếu
hơn NO
3
−
Tuy vậy, nhưng H
+
lại đóng vai trò làm môi trường,
nếu không có H
+
phản ứng cũng không xảy ra
Vậy nếu cho 1 mẩu Cu vào dung dịch chứa:
A.NaNO
3
B. HCl
C. Hỗn hợp NaNO
3
và HCl
Cho biết trong trường hợp nào sẽ xảy ra phản ứng ?
Viết pt dưới dạng ion rút gọn ?
3Cu + 8H
+
+ 2NO
3
-
3Cu
2+
+ 2NO + 4H
2
O