BÀI 9: AXIT NITRIC VA MUỐI NITRAT
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (128.49 KB, 9 trang )
Tiết 14
Ngày soạn:
Ngày giảng:
BÀI 9: AXIT NITRIC VA MUỐI NITRAT
I. MỤC TIÊU
1.Kiến thức:
1. HS biết được: Cấu tạo phân tử, tính chất vật lí (trạng thái, màu sắc, khối lượng riêng, tính tan), ứng dụng
của HNO3
2. HS hiểu được :
- HNO3 là một trong những axit mạnh nhất.
- HNO3 là chất oxi hoá rất mạnh: oxi hoá hầu hết kim loại, một số phi kim, nhiều hợp chất vô cơ và hữu cơ.
2.Kĩ năng:
- Dự đoán tính chất hóa học, kiểm tra dự đoán bằng thí nghiệm và rút ra kết luận.
- Quan sát thí nghiệm, hình ảnh..., rút ra được nhận xét về tính chất của HNO3.
- Viết các phương trình hoá học dạng phân tử, ion rút gọn minh hoạ tính chất hoá học của HNO3 đặc và loãng.
3.Thái độ:
- Say mê, hứng thú học tập, trung thực, yêu khoa học.
- Có ý thức vận dụng kiến thức đã học về axit nitric vào thực tiễn cuộc sống, phục vụ đời sống con người.
II. TRỌNG TÂM
- HNO3 có đầy đủ tính chất hóa học của một axit mạnh và là chất oxi hóa rất mạnh: oxi hóa hầu hết các
kim loại, một số phi kim, nhiều hợp chất vô cơ và hữu cơ.
IV. PHƯƠNG PHÁP
- Gv đặt vấn đề.
- Hs tự giải quyết vấn đề dưới sự hướng dẫn của gv.
- Kết hợp sách giáo khoa, trực quan để HS tự chiếm lĩnh kiến thức.
III. CHUẨN BỊ
1. Giáo viên:
- Dụng cụ thí nghiệm: ống nghiệm, kẹp ống nghiệm, đèn cồn, giá thí nghiệm, bình cầu đáy tròn, ống sinh
hàn, bộ dụng cụ đo khả năng dẫn điện.
- Hóa chất: Quỳ tím, CuO (r), dd NaOH, CaCO3 (r) và Cu, Zn, HNO3 đặc, HNO3 (l), dd HCl loãng.
2. Học sinh: Học bài, làm bài tập, chuẩn bị bài mới.
- Hoàn thành phiếu học tập số 1 theo yêu cầu của giáo viên (GV chuẩn bị sẵn phiếu học tập số 1 và phát cho
HS ở cuối buổi học trước)
III. CHUỖI CÁC HOẠT ĐỘNG DẠY HỌC
1. Ổn định lớp: Kiểm tra sĩ số, đồng phục...
2. Kiểm tra bài cũ: (có thể có)
- Viết phương trình hoá học hoàn thành dãy chuyển hoá sau:
(1)
(2)
(3)
(4)
(5)
(NH4)2SO4
→ NH3
→ NH4Cl
→ N2
→ NO
→ NO2
- Bằng phương pháp hoá học, nhận biết chất rắn sau: CaCO3; NH4Cl; NaCl
3. Giới thiệu chung:
Những hợp chất khí nào là nguyên nhân gây ra mưa axit? Có hợp chất của nitơ là NO 2, kết hợp với
nước tạo nên một loại axit, axit này có những tính chất gì mà có thể gây hại đến những công trình xây
dựng...
- Hoạt động trải nghiệm kết nối (Tình huống xuất phát): được thiết kế hằm huy động kiến thức đã học của
học sinh về tính chất của axit, số oxi hóa của N trong hợp chất.
- HĐ hình thành kiến thức: Tính chất vật lí, tính chất hóa học, ứng dụng, điều chế, nhận biết muối nitrat.
Thông qua kiến thức đã học HS suy luận thực hiện thí nghiệm để kiểm chứng rút ra kiến thức mới.
- HĐ luyện tập: được thiết kế thành các câu hỏi bài tập củng cố, khắc sâu các nội dung kiến thức trọng tâm.
- HĐ vận dụng: tìm tòi, mở rộng được thiết kế cho HS về nhà làm nhằm mục đích giúp HS vận dụng kiến
thức kĩ năng đã học trong bài để giải quyết các vấn đề, câu hỏi bài tập gắn với thực tiễnvà mở rộng kiến
thức.
4. Thiết kế chi tiết từng hoạt động dạy học
A. Hoạt động trải nghiệm, kết nối
a) Mục tiêu hoạt động: Huy động các kiến thức đã học của học sinh và tạo nhu cầu tiếp tục tìm hiểu kiến
thức mới của HS.
Nội dung HĐ:Tìm hiểu tính chất vật lí, tính chất hóa học, ứng dụng, sản xuất.
b) Phương thức tổ chức hoạt động
- GV tổ chức cho HS hoạt động nhóm hoàn thành phiếu học tập số 1.
- GV tổ chức cho HS hoạt động chung bằng cách cho 1 nhóm báo cáo, các nhóm còn lại góp ý, bổ sung. GV
không chốt kiến thức mà chỉ liệt kê câu hỏi vấn đề HS đưa ra, các vấn đề này sẽ được giải quyết ở HĐ hình
thành kiến thức và HĐ luyện tập.
- Dự kiến khó khăn vướng mắc và giải pháp hỗ trợ:
Dựa vào thông tin phiếu học tập, kết hợp với kiến thức đã học về axit nitric, HS nêu được tính chất hóa học
chung của axit, số oxi hóa của N .
PHIẾU HỌC TẬP SỐ 1
(HS chuẩn bị trước ở nhà)
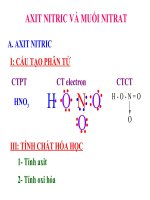
Cho CTPT axit nitric: HNO3
..
..
.... O :
H :O
.. : N .
.
..O:
CT eletron
CT cÊu t¹o
- Nguyªn tè nit¬ cã sè oxi ho¸ = +5 (cùc ®¹i).
Nghiên cứu tổng hợp kiến thức từ SGK hoặc tài liệu, trả lời các câu hỏi sau:
Câu 1. Nêu tính chất vật lí của axit HNO3: trạng thái, màu sắc, tính tan trong nước, độ bền, nồng độ dung
dịch đậm đặc và khối lượng riêng?
..............................................................................................................................................................................................
..............................................................................................................................................................................................
Câu 2. 1). Nêu các tính chất hóa học chung của axit. Theo em axit HNO3 có mang đầy đủ tính chất chung
của một axit không? Viết phương trình hóa học minh họa.
.................................................................................................................................................................................................................
.................................................................................................................................................................................................................
.................................................................................................................................................................................................................
................................................................................................................................................................................................................
2. Xác định số oxi hóa của nitơ, ngoài tính axit ra theo em HNO3 còn có tính chất gì (tính oxi hóa, tính
khử?...). Lấy ví dụ, chỉ rõ vai trò của axit HNO3 trong phản ứng.
.................................................................................................................................................................................................................
.................................................................................................................................................................................................................
.................................................................................................................................................................................................................
.................................................................................................................................................................................................................
B)Hoạt động hình thành kiến thức
HOẠT ĐỘNG GV VÀ HS
Hoạt động 1: (7 phút) Tìm hiểu cấu tạo phân tử và
tính chất vật lí của axit HNO3
a)Mục tiêu hoạt động
- HS nêu được cấu tạo của axit HNO3 có liên kết H-O
phân cực mạnh, trong dung dịch có thể phân li ra ion
H+. Số oxi hóa của N trong hợp chất là +5, đây là số
oxi hóa cao nhất của nitơ.
- Học sinh nêu được TCVL cơ bản của HNO3: axit
HNO3 tinh khiết là một chất lỏng, không màu, bốc
khói mạnh trong không khí ẩm. Để lâu dung dịch có
màu vàng do ở nhiệt độ thường, khi có ánh sáng, axit
bị phân hủy 1 phần giải phóng khí NO2 có màu nâu.
Tan rất tốt trong nước theo bất kì tỉ lệ nào. Nồng
độ đậm đặc 68%.
b)Phương thức tổ chức hoạt động
- GV cho học sinh chuẩn bị sẵn ở nhà, mời đại diện
một nhóm nên báo cáo, các HS khác góp ý, bổ sung.
GV hướng dẫn để HS chốt kiến thức về đặc điểm cấu
tạo của axit HNO3.
- GV cho HS quan sát lọ hóa chất sau đó hướng dẫn
HS kết luận về tính chất vật lí của HNO3: trạng thái,
màu sắc, độ bền tính tan trong nước, nồng độ của dung
dịch HNO3 đậm đặc và khối lượng riêng.
c) Sản phẩm đánh giá kết quả hoạt động
+Thông qua báo cáo của các nhóm và sự góp ý bổ
sung các nhóm khác giáo viên hướng dẫn chốt được
các kiến thức về cấu tạo phân tử và TCVL của HNO3.
Hoạt động 2: (30 phút) Tính chất hóa học của axit
HNO3
a)Mục tiêu hoạt động: Tìm hiểu tính chất hóa học của
axit nitric rèn luyện kỹ năng nghiên cứu hoạt động
nhóm kỹ năng thực hành thí nghiệm.
b)Phương thức tổ chức hoạt động
- HĐ nhóm: Từ đặc điểm cấu tạo, kết hợp với kiến
thức cũ đã học, thông qua phần kiểm tra bài cũ (phiếu
học tập số 1), GV yêu cầu các nhóm dự đoán tính chất
hóa học axit (có thể hiện các tính chất chung của axit
không? Ngoài ra còn có tính chất gì đặc biệt? Lấy ví
dụ minh họa).
- HĐ chung cả lớp:
+ GV mời 1 số nhóm báo cáo kết quả dự đoán tính
chất hóa học của axit HNO3, các nhóm khác góp ý, bổ
sung.
+ Giáo viên thông báo các dụng cụ hóa chất thí
nghiệm trên cơ sở đó các nhóm lựa chọn đề xuất cách
NỘI DUNG
A. AXIT NITRIC
I – CẤU TẠO PHÂN TỬ
- CTPT : HNO3
- CTCT :
..
..
.... O :
H :O
.. : N .
.
..O:
CT eletron
CT cÊu t¹o
- Liên kết O- H phân cực.
- Nitơ có hóa trị IV và số oxihoá là +5
II – TÍNH CHẤT VẬT LÝ
- Là chất lỏng không màu . Bốc khói mạnh trong
không khí ẩm
- Axít nitric không bền , phân hủy 1 phần
4HNO3 → 4 NO2 + O2 + 2H2O
- Dung dịch axit có màu vàng hoặc nâu .
- Axít nitric tan vô hạn trong nước
(Thực tế dùng HNO3 68%, D=1,40g/cm3 )
III . TÍNH CHẤT HÓA HỌC
1 . Tính axít :
- Là một trong số các axít mạnh nhất , trong
dung dịch :
HNO3 → H+ + NO3- Dung dịch axít HNO3 có đầy đủ tính chất của
một dung dịch axít .
( Tác dụng với oxit bazơ , bazơ , muối của axit
yếu hơn )
CuO
+ HNO3→ CuCl2 + H2O
Fe(OH)3
+ HNO3→ FeCl3 + 3H2O
CaCO3
+ HNO3→ CaCl2 + CO2↑ + H2O
2 .Tính oxi hóa :
- Là một trong những axít có tính oxi hóa mạnh
nhất.
- Tuỳ vào nồng độ của axít và bản chất của chất
thực hiện các thí nghiệm để kiểm chứng các tính chất
hóa học đã dự đoán của axit nitric
+ Các nhóm tiến hành làm thí nghiệm sau đó giáo viên
cử đại diện một số nhóm báo cáo quá trình thí nghiệm.
Nêu hiện tượng giải thích viết phương trình phản ứng
xảy ra từ đó nêu các tính chất hóa học chung của axit
nitric các nhóm khác góp ý bổ sung giáo viên hướng
dẫn học sinh chuẩn hóa kiến thức về tính chất hóa học
của axit nitric.
c)Sản phẩm đánh giá kết quả hoạt động
- Sản phẩm nêu được cách tiến hành kết quả thí
nghiệm theo bảng
TT Tên
Cách
Hiện
Giải thích,
TN
tiến hành tượng
PTHH
1
2
3
…
- Học sinh rút ra được các tính chất hóa học của axit
nitric gồm có:
* Axit nitric là một axit mạnh có đầy đủ các tính chất
của một axit.
+ Tác dụng với chất chỉ thị: làm quỳ tím chuyển màu đỏ.
+ Tác dụng với bazơ oxit bazơ tạo thành muối và
nước.
+ Tác dụng với muối của axit yếu hơn tạo ra muối nitrat
* Có tính oxi hóa mạnh:
+ Tác dụng với hầu hết kim loại (trừ Au và Pt) tạo
thành muối và không giải phóng hiđro.
+ Tác dụng với phi kim.
+ Tác dụng với nhiều hợp chất vô cơ và hữu cơ.
- Dự kiến một số khó khăn vướng mắc của học sinh và
giải pháp hỗ trợ.
+ Thí nghiệm HNO3(đ) với kim loại, sinh ra khí NO2
có màu nâu, cần nhắc HS lấy bông tẩm kiềm đặt lên
trên thành ống nghiệm.
- Đánh giá kết quả hoạt động:
+ Thông qua quan sát: Giáo viên chú ý quan sát khi
các nhóm tiến hành thí nghiệm kịp thời phát hiện
những thao tác khó khăn vướng mắc của học sinh và
có giải pháp hỗ trợ hợp lý.
+ Thông qua hoạt động chung của cả lớp: Đánh giá
bằng nhận xét giáo viên cho các nhóm tự đánh giá quá
trình thí nghiệm của mình và cho các nhóm nhận xét
đánh giá lẫn nhau giáo viên nhận xét đánh giá chung.
Khắc sâu: Tại sao HNO3 khi td với kl lại có tính khác
biệt với HCl, H2SO4 loãng?
Axit nitric là chất oxi hóa mạnh, oxi hóa nhiều đơn
chất, hợp chất vô cơ và hữu cơ. Khả năng oxi hóa của
HNO3 là do trong dung dịch có ion NO3- , trong đó
nguyên tử N có số oxi hóa cao nhất là +5. Tùy thuộc
vào nồng độ của axit và độ mạnh yếu của chất khử mà
khử mà HNO3 có thể bị khử đến : NO2 , NO , N2O
, N2 , NH4NO3 .
a. Với kim loại :
- HNO3 oxihóa hầu hết các kim loại (trừ vàng và
platin ) không giải phóng khí H2 , do ion NO3 có
khả năng oxi hoá mạnh hơn H+ .
* Với những kim loại có tính khử yếu : Cu , Ag
HNO3 đặc bị khử đến NO2
Cu + 4HNO3(đ)→ Cu(NO3)2 +2NO2+2H2O
HNO3 loãng bị khử đến NO
3Cu + 8HNO3(l) → 3Cu(NO3)2 + 2NO + 4H2O
* Khi tác dụng với những kim loại có tính khử
mạnh hơn : Mg, Zn ,Al . . .
- HNO3 đặc bị khử đến NO2
- HNO3 loãng bị khử đến N2O hoặc N2
- HNO3 rất loãng bị khử đến NH3 (NH4NO3)
8Al + 30HNO3(l) → 8Al(NO3)3 + 3N2O+15H2O
5Mg + 12HNO3(l) → 5Mg(NO3)2 + N2 + 6H2O
4Zn + 10HNO3(l) → Zn(NO3)2 +NH4NO3 + 3H2O
- Fe, Al bị thụ động hóa trong dung dịch HNO 3
đặc nguội .
b. Tác dụng với phi kim :
- Khi đun nóng HNO3 đặc có thể tác dụng được
với C, P ,S . . .
Ví Dụ :
C + 4HNO3(đ) → CO2 + 4NO2 + 2H2O
S + 6HNO3(đ) → H2SO4 +6NO2+2H2O
Nhận xét: Thông thường:
PK + HNO3 → oxit (hoặc axít) + sp khử
+ (H2O)
PK có số oxh cao nhất
c. Tác dụng với hợp chất :
- H2S , HI, SO2 , FeO , muối sắt (II) . . . có thể
tác dụng với HNO3 - Nguyên tố bị oxi hóa trong
hợp chất chuyển lên mức oxi hóa cao hơn:
3FeO +10HNO3(l) → 3 Fe(NO3)3+ NO + 5H2O
3H2S + 2HNO3(l) → 3S + 2NO + 4H2O .
- Nhiều hợp chất hữu cơ như giấy , vải , dầu
HNO3 có thể bị khử đến các sản phẩm khác nhau của
nitơ.
GV: Cho HS xem video thí nghiệm. Nhúng kl Al, Fe
vào HNO3 đặc, nguội rồi nhúng vào dd axit HCl,
H2SO4 loãng → dùng bình bằng Al, Fe để đựng HNO3 đặc.
Lưu ý với HS:
- 1VHNO3 +3HCl → nước cường thuỷ
hoà tan được Au và Pt.
Au + HNO3 + 3HCl →AuCl3 + NO + 2H2O
+ Giải thích hoạt tính của nước cường thuỷ.
HNO3 + 3HCl → Cl2 + NOCl + 2H2O
(nitrozilclorua)
thông . . . bốc cháy khi tiếp xúc với HNO3 đặc
→ Vậy : HNO3 có tính axít mạnh và có tính
oxihóa .
IV . ỨNG DỤNG :(SGK)
V – ĐIỀU CHẾ :
1 . Trong phòng thí nghiệm :
to
NaNO3(r ) + H2SO4(đ)
→ HNO3 +NaHSO4 .
Hơi HNO3 thoát ra được dẫn vào bình làm
lạnh và ngưng tụ ở đó.
2. Trong công nghiệp:
- Được sản xuất từ amoniac
- Ở nhiệt độ 850 – 9000C , xúc tác hợp kim Pt và
Ir :
NOCl → NO + Cl; 3Cl + Au →AuCl3
Hoạt động 3: Tìm hiểu ứng dụng và điều chế axit 4NH3 + 5O2 → 4NO + 6H2O
∆H = - 907kJ
nitric
a) Mục tiêu hoạt động: Nêu được các phương pháp - Oxi hóa NO thành NO2 :
2NO + O2 → 2NO2 .
điều chế HNO3 trong PTN và CN.
- Chuyển hóa NO2 thành HNO3 :
Một số ứng dụng chủ yếu của axit HNO3
4NO2 +2H2O +O2 → 4HNO3 .
b) Phương thức hoạt động:
- HS nghiên cứu SGK cho biết phương pháp điều chế - Dung dịch HNO3 thu được có nồng độ 60 62% . Chưng cất với H2SO4 đậm đặc thu được d2
và ứng dụng của HNO3
HNO3 96 – 98 % .
- Yêu cầu 1 đại diện trình bày.
c) Sản phẩm hoạt động:
- HS báo cáo về phương pháp điều chế axit HNO3
trong PTN và trong CN và ứng dụng quan trọng của
nó.
Hoạt động 4: Luyện tập
a)Mục tiêu hoạt động:
- Củng cố khắc sâu kiến thức đã học trong bài về tính chất vật lý tính chất hóa học điều chế axit nitric.
- Tiếp tục phát triển năng lực tự học sử dụng ngôn ngữ hóa học phát hiện và giải quyết vấn đề thông qua
môn học.
Nội dung hoạt động: hoàn thành các câu hỏi bài tập trong phiếu học tập số 2.
b)phương thức tổ chức hoạt động
-Ở hoạt động này GVcho HS hoạt động cá nhân là chủ yếu bên cạnh đó có thể cho học sinh cặp đôi hoặc
trao đổi nhóm nhỏ để chia sẻ kết quả giải quyết các câu hỏi bài tập trong phiếu học tập 2.
- Hoạt động chung của lớp: giáo viên mời 1 số học sinh lên trình bày kết quả lời giải các học sinh khác góp ý
bổ sung giáo viên giúp học sinh nhận ra những chỗ sai sót cần chỉnh sửa và chuẩn hóa kiến thức phương
pháp giải bài tập.
Hoạt động 5:Hoạt động vận dụng và tìm tòi mở rộng
a)Mục tiêu hoạt động:
- Hoạt động vận dụng và tìm tòi mở rộng được thiết kế cho học sinh về nhà làm nhằm giúp học sinh vận
dụng kiến thức kỹ năng đã học trong bài giảng để giải quyết các câu hỏi bài tập gắn với thực tiễn và mở rộng
kiến thức cho học sinh không bắt buộc tất cả sinh phải làm.
b)Nội dung hoạt động:
Một trong những ứng dụng thực tiễn của HNO3 trong cuộc sống là dùng để thử tuổi vàng (9k, 10k,
14k…..) thông qua internet, em hãy tìm hiểu ứng dụng này của axit nitric.
c)Phương thức tổ chức hoạt động: Giáo viên hướng dẫn học sinh về nhà làm hướng dẫn học sinh tìm
nguồn tài liệu tham khảo.
d)Sản phẩm hoạt động bài viết của học sinh trình bày trên bảng word
e)Kiểm tra đánh giá kết quả hoạt động:
- GV có thể cho học sinh báo cáo kết quả hoạt động vận dụng và tìm tòi mở rộng vào đầu giờ của buổi học
kế tiếp giáo viên kịp thời động viên khích lệ học sinh.
VI. CÂU HỎI, BÀI TẬP KIỂM TRA, ĐÁNH GIÁ THEO ĐỊNH HƯỚNG PHÁT TRIỂN NĂNG LỰC
5. Bảng mô tả các mức độ nhận thức và câu hỏi/bài tập kiểm tra đánh giá:
Nội
Loại câu
Nhận biết
Thông hiểu
Vận dụng
Vận dụng
dung
hỏi/bài tập
cao
Câu hỏi/bài
+ Tính chất
+ Giải thích + Nhận biết
tập định tính hóa học của
được một số axit nitric, so
axit nitric,
tính chất hóa với các axit
muối nitrat.
học của axit khác.
+ Các phương nitric,
muối + Bằng phương
pháp điều
nitrat.
pháp hóa học
chế; nhận
phân biệt được
biết, ứng
muối nitrat so
dụng của axit
với các muối
nitric.
khác.
+ Cách nhận
biết muối
nitrat.
Bài tập định
Các bài tập
Axit
lượng
yêu cầu HS
nitric
phải sử dụng
Muối
các kiến thức,
nitrat
kĩ năng để
giải quyết
(tính khối
lượng, thể
tích dung
dịch, tìm tên
kim loại, oxit
kim loại hay
muối)
Giải thích được Phát hiện
một số hiện
được một số
Bài tập thực
tượng thí
hiện tượng
hành
nghiệm liên
trong thực
quan đến thực tiễn và sử
tiễn
dụng kiến
thức hóa học
để giải thích
6. Câu hỏi/bài tập kiểm tra, đánh giá chủ đề theo định hướng phát triển năng lực
a. Mức độ nhận biết
Câu 1. Sấm chớp (tia lửa điện) trong khí quyển sinh ra chất nào sau đây?
A. CO
B. H2O
C. NO
D.NO2
Câu 2. Trong phòng thí nghiệm, nitơ tinh khiết được điều chế từ:
A. không khí
B. NH3 và O2
C. NH4NO2
D. Zn và HNO3
Câu 3. Nitơ có thể có các số oxi hóa trong các hợp chất là:
A. chỉ có số oxihóa -3 và +5
B. chỉ có số oxihóa +3 và +5
C. có số oxihóa từ -4 đến +5
D. có thể có các số oxihóa: -3, +1, +2,+3, +4, +5
Câu 4. Số oxi hoá của nitơ được sắp xếp theo thứ tự giảm dần như sau :
A. NH3 ; N2 ; NO2-; NO ; NO3
B. NO ; N2O ; NH3 ; NO3C. NH3 ; NO ; N2O ; NO2 ; N2O5 D. NO3- ; NO2 ; NO; N2O ; N2 ; NH4+
Câu 5. Diêm tiêu có chứa:
A. NaNO3
B. KCl
C. Al(NO3)3
D. CaSO4
Câu 6. Một dung dịch có chứa ion NO 3 . Để nhận biết sự tồn tại của ion này trong dung dịch người
ta có thể dùng cách nào sau đây?
A. Cô cạn dung dịch, đun nóng muối ta sẽ thu được chất khí.
B. Cho vài giọt CuSO4 vào thì dung dịch có màu xanh.
C. Đun nóng nhẹ dung dịch với Cu kim loại và dung dịch H 2SO4 loãng ta sẽ thu. được khí
không màu hóa nâu trong không khí.
D. Để dung dịch hồi lâu ngoài không khí thì dung dịch sẽ ngả vàng
Câu 7: Cho các muối nitrat NaNO 3, Cu(NO3)2, Mg(NO3)2, Fe(NO3)3, AgNO3, KNO3, Pb(NO3)2,
Al(NO3)3. Có bao nhiêu muối bị nhiệt phân sinh ra oxit kim loại và NO2 và O2?
A. 2
B. 4
C. 5
D. 6
Câu 8. Màu nâu của dd Fe(NO3)3 là do:
−
A. Màu của Fe(OH)3.
B. Màu của ion NO3 bị hidrat hóa.
C. Màu của ion Fe3+ bị hidrat hóa.
D. Màu của ion Fe 2+ bị hidrat hóa .
Câu 9. Câu nào sau đây sai?
A. Axit nitric là chất lỏng không màu, mùi hắc, tan có hạn trong H2O.
B. N2O5 là anhiđrit của axit nitric.
C. HNO3 là một trong những hoá chất cơ bản và quan trọng.
D. Dung dịch HNO3 có tính oxi hoá mạnh.
Câu 10. Các kim loại nào sau đây không tác dụng với HNO3 đặc, nguội:
A. Cu, Al.
B. Cu, Fe.
C. Fe, Al.
D. Zn, Cr.
b. Mức độ hiểu
Câu 11. Để nhận biết 3 axit đặc nguội: HCl, HNO 3, H2SO4 đựng trong 3 lọ riêng biệt mất nhãn ta
dùng thuốc thử sau:
A. Al
B. Cu
C. Fe
D. CuO
Câu 12. Kim loại tác dụng với HNO3 không sinh ra chất khí nào sau đây?
A. NO
B. NO2
C. N2
D. N2O5
Câu 13. Nhiệt phân Fe(NO3)3trong không khí thu được sản phẩm gồm:
A. FeO, NO2, O2. B. Fe, NO2, O2.
C. FeO, NO2.
D. Fe2O3, NO2, O2.
Câu 14. Để điều chế HNO3 trong phòng thí nghiệm người ta cần dùng các hóa chất:
A. Dung dịch NaNO3 và dd H2SO4 đặc. B. NaNO3 tinh thể và dd H2SO4 đặc.
C. NaNO3 tinh thể và dd HCl đặc.
D. Dung dịch NaNO3 và dd HCl đặc.
Câu 15. Axit nitric tinh khiết, không màu để ngoài ánh sáng lâu ngày sẽ chuyển thành:
A. màu đen sẫm.
B. màu vàng.
C. màu trắng đục. D. không chuyển màu.
Câu 16. Hiện tượng nào xảy ra khi cho mảnh đồng kim loại vào dd HNO3 đặc?
A. Không có hiện tượng gì.
B. Dung dịch có màu xanh, H2 bay ra.
C. Dung dịch có màu xanh, có khí màu nâu bay ra.
D. Dung dịch có màu xanh, có khí không màu bay ra.
Câu 17. Hóa chất để phân biệt ba dung dịch HCl, HNO3, H3PO4 gồm:
A. đồng kim loại và dung dịch AgNO3.
B. giấy quỳ và bazơ.
C. đồng kim loại và giấy quỳ.
D. dung dịch AgNO3 và giấy quỳ.
Câu 18. Trong công thức cấu tạo của HNO3 , N có hóa trị
A. 5
B. 2
C.3
D.4
Câu 19. Cho HNO3 đặc vào than nung nóng có khí bay ra là:
A. CO2
B. NO2
C. Hỗn hợp khí CO2 và NO2.
D. Không khí có khí bay ra.
Câu 20. Nhiệt phân AgNO3 thu được các chất thuộc phương án nào?
A. Ag2O , NO2
B. Ag2O , NO2 , O2 C. Ag, NO2 , O2
D. Ag2O , O2
Câu 21. Nhiệt phân Cu(NO3)2 thu được các chất thuộc phương án nào?
A. Cu, O2, N2
B. Cu, NO2, O2
C. CuO, NO2 , O2
D. Cu(NO2)2, O2
c. Mức độ vận dụng thấp
Câu 22. Hòa tan hoàn toàn 6,5g Zn vào dung dịch axit HNO 3 thu được 4,48 lít khí (đktc). Vậy nồng
độ axit này thuộc loại nào?
A. Đặc
B. Loãng
C. Rất loãng.
D. Không xác định được.
Câu 23.Cho 3,2 g đồng tác dụng hết với dung dịch HNO3 đặc. Thể tích khí NO2 thu được là:
A. 1,12 lít
B. 0,1 lít
C. 4,48 lít
D. 2,24 lít
Câu 24. Một oxit nitơ có công thức NOx trong đó N chiếm 30,43% về khối lượng. Công thức của
oxit nitơ đó là:
A. NO
B. NO2
C. N2O2
D. N2O5
Câu 25. Phản ứng giữa HNO3 với FeO tạo ra khí NO. Tổng các hệ số trong phương trình oxi hoá khử này bằng:
A. 22
B. 20
C. 16
D. 12
Câu 26. Cho 12,8g đồng tan hoàn toàn trong dung dịch HNO 3 thấy thoát ra hỗn hợp hai khí NO và
NO2 có tỉ khối đối với H2 =19. Thể tích hỗn hợp đó ở điều kiện tiêu chuẩn là:
A. 1,12 lít
B. 2,24 lít
C. 4,48 lít
D. 0,448 lít
Câu 27. Khi hòa tan 30g hỗn hợp đồng và đồng (II) oxit trong dung dịch HNO 3 1M lấy dư, thấy
thoát ra 6,72 lít khí NO (ở đktc). Hàm lượng % của đồng (II) oxit trong hỗn hợp ban đầu là:
A. 4,0%
B. 2,4%
C. 3,2%
D. 4,8%
Câu 28. Sản phẩm khí thoát ra khi cho dd HNO 3 loãng phản ứng với kim loại đứng sau hiđro trong
dãy hoạt động hóa học của kim loại là
A. NO
B. NO2
C. N2
D.Tất cả đều sai
Câu 29. Có ba lọ axit riêng biệt chứa các dung dịch : HCl, HNO 3 , H2SO4 không có nhãn. Dùng các
chất nào sau đây để nhận biết?
A. Dùng muối tan của bari, kim loại đồng.
B. Dùng giấy quỳ tím, dd bazơ.
C. Dùng dung dịch muối tan của bạc.
D. Dùng dd phenolphtalein, giấy quỳ.
Câu 30. Thể tích NH3 cần dùng để điều chế 6300 kg HNO3 nguyên chất là
A. 2240 lít.
B. 2240 m3.
C. 2240 dm3.
D. Không có giá trị nào đúng.
d. Mức độ vận dụng cao
Câu 31. Nếu toàn bộ quá trình điều chế HNO 3 có hiệu suất 80% thì từ 1 mol NH 3 sẽ thu được một
lượng HNO3 là:
A. 63g
B. 50,4 g
C. 78,75g
D. Kết quả khác
Câu 32. Cho 6,4 g Cu tác dụng với 120ml dd X gồm HNO3 1M và H2SO4 loãng 0,5M thu được V lít
NO duy nhất(đktc). Giá trị của V là:
A. 0,672
B. 1,568
C.1,344
D.1,792
Câu 33. Trộn 1 lít dung dịch HNO3 0,02M với 1 lít dung dịch NaOH 0,01M. Thu được dung dịch có
pH là:
A. 3,2
B. 2,3
C. 7,3
D. 3,7
Câu 34. Cho 3,6gam một kim loại M tác dụng với HNO 3,thu được 2240ml khí NO duy nhất
(đktc).Vậy M là:
A. Mg(24)
B. Ca(40)
C. Zn(65)
D. Fe(56)
Câu 35. Cho 19,5gam một kim loại M tác dụng với HNO3,thu được 4,48lít khí NO duy nhất
(đktc).Vậy M là:
A. Mg(24)
B. Ca(40)
C. Zn(65)
D. Fe(56)
Câu 36. Cho m gam Al và Mg vào dung dịch HNO 3 đặc, nguội, dư. Thu được 0,672 lít khí NO 2 duy
nhất(đktc) và 0,54gam chất rắn không tan. Vậy m có giá trị là:
A. 0,9
B. 0,54
C. 1, 22
D. 0,80
Câu 37. Đem nung nóng m gam Cu(NO 3)2, sau một thời gian thì dừng lại, làm nguội và đem cân
thấy khối lượng giảm 0,54 gam so với ban đầu. Khối lượng Cu(NO3)2 đã bị nhiệt phân là:
A. 0,94
B. 0,8
C. 1,2
D. 0,54
Câu 38.Cho 6,4 gam Mg và Ca vào dung dịch HNO 3 dư. Thu được 8,96 lít khí NO2 duy
nhất(đktc).Vậy khối lượng của Ca trong hỗn hợp là:
A. 4
B. 2,4
C. 6,4
D. 5
Câu 39. Cho m gam CuO tác dụng vừa đủ với 20g dd HNO3 31,5%.Giá trị của m là:
A. 4
B. 5
C. 6
D. 3
Câu 40.Cho V ml dd Ba(OH)2 0,1M tác dụng vừa đủ với 100ml dd HNO3 0,1M. Giá trị của V là:
A. 50ml
B. 100ml
C. 150ml
D. 200ml
Câu 41. Cho 10 gam CaCO3 tác dụng vừa đủ với 50 gam dd HNO3 C%. Giá trị của C% là:
A. 25,2%
B. 30%
C. 50,4%
D. 68%
Câu 42. Trong phân tử HNO3 có đặc điểm cấu tạo:
A. Có một liên kết cộng hóa trị.
B. Có một liên kết phối trí.
C. Có hai kiên kết đôi.
D. Tất cả sai.
Câu 43. phản ứng giữa HNO3 và FeO tạo ra khí NO.Tổng hệ số trong phương trình là:
A. 22
B.10
C. 21
D. 30
Câu 44. Nhiệt phân hoàn toàn 13,24 gam muối nitrat của một kim loại A, thu được một oxit kim loại
và 2,24 lít hh hai khí đktc. A là:
A. Cu
B.Al
C. Mg
D. Pb
Câu 45. Cho 0,28mol Al vào dd HNO3 dư, thu đuợc khí NO và dd chứa 62,04 gam muối.Số mol NO
thu được là:
A. ,02mol
B. 0,3 mol
C. 0,4mol
D. 0,1mol
Câu 46. Hỗn hợp X gồm Al, Fe2O3, Fe3O4, CuO trong đó oxi chiếm 25,39% khối lượng hỗn hợp. Cho m
gam hỗn hợp X tác dụng với 8,96 lít CO (điều kiện tiêu chuẩn) sau một thời gian thu được chất rắn Y và hỗn
hợp khí Z có tỉ khối so với hiđro là 19. Cho chất rắn Y tác dụng với dung dịch HNO 3 loãng dư thu được dung
dịch T và 7,168 lít NO (điều kiện tiêu chuẩn, sản phẩm khử duy nhất). Cô cạn dung dịch T thu được 3,456m
gam muối khan. Giá trị của m gần với giá trị nào sau đây nhất?
A. 42,5
B. 35,0
C. 38,5
D. 40,5