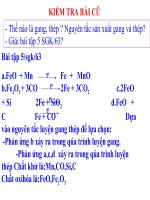hoa hoc 9 tiet 25 sat
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (1.13 MB, 17 trang )
<span class='text_page_counter'>(1)</span>
<span class='text_page_counter'>(2)</span> Nêu tính chất hoá học của nhôm và viết PTHH minh hoạ ĐÁP ÁN 1. Phản ứng với phi kim: a. Với oxi: 4Al + 3O2 → 2Al2O3 b. Với Clo: 2Al + 3Cl2 → 2AlCl3 2. Phản ứng với dung dịch axit: VD: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2 Al không phản ứng với H2SO4 đặc nguội, HNO3 đặc nguội 3. Phản ứng với dung dịch muối: VD: 2Al + 3CuCl2 → 2AlCl3 + 3Cu 4. Phản ứng với dung dịch kiềm: VD: 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2.
<span class='text_page_counter'>(3)</span> Tiết 25 – Bài 19.
<span class='text_page_counter'>(4)</span> Hoạt động nhóm - 8 phút Nhiệm vụ: a. Đọc cách tiến hành thí nghiệm theo hướng dẫn trong bảng 2. b. Tiến hành TN, quan sát hiện tượng, viết PTHH và kết luận. c. Kết luận chung về TCHH của Sắt và so sánh với Nhôm. Cách tiến hành. Hiện tượng. 1. Uốn cong sợi dây sắt thành hình lò xo, đầu cột một mẫu than. Đốt cháy đỏ, đưa nhanh vào lọ khí O2. 2. Cho một ít sản phẩm của phản ứng Fe cháy trong khí Clo vào nước, lắc nhẹ, nhỏ dung dịch NaOH vào. Xác định công thức sản phẩm phản ứng của Fe với Clo. 3. - Cho một ít bột sắt vào 3 ống nghiệm đựng dd HCl (1), HNO3 đặc (2), H2SO4 đặc (3). - Nhỏ dd NaOH vào dd sản phẩm ống nghiệm (1), so sánh hiện tượng với TN2. 4. Ngâm đinh sắt vào dung dịch CuSO4 5. Cho một ít bột sắt vào dung dịch NaOH GPT. . Kết luận, PTHH.
<span class='text_page_counter'>(5)</span> TÍNH CHẤT HOÁ NGHIỆM HỌC CỦA SẮT Bảng 2 GÓC TRẢI Hiện tượng Thí nghiệm Kết luận - PTHH 1. Đốt dây sắt trong oxi 2. Cho sp [Fe + Cl2] vào nước, lắc nhẹ. - Nhỏ dd NaOH vào dd trên. → công thức sp [Fe + Cl2] 3. - Cho bột sắt vào: + dd HCl (1) + HNO3 đặc (2) + H2SO4 đặc (3) - Nhỏ dd NaOH vào dd sản phẩm (1) 4. Đinh sắt vào dd CuSO4 5. Bột sắt vào dd NaOH. sắt cháy không có ngọn lửa tạo hạt nhỏ nâu đen. 1. Phản ứng với Oxi:. - tan → dd vàng nâu - xuất hiện kết tủa đỏ nâu Fe(OH)3. 2. Phản ứng với Clo:. * (1): bọt khí, dd lục nhạt (2),(3): không hiện tượng * Xuất hiện kết tủa trắng xanh Fe(OH)2 chất rắn đỏ bám đinh sắt, màu xanh dd nhạt dần Không hiện tượng. 3Fe + 2O2 2Fe + 3Cl2. o. t . o. t . Fe3O4. 2FeCl3. [ FeCl3 + 3NaOH → Fe(OH)3↓+ 3NaCl ]. 3. Phản ứng với dung dịch axit:. Fe + 2HCl → FeCl2 + H2. [ FeCl2 + 2NaOH → Fe(OH)2↓+ 2NaCl ]. * Không phản ứng với HNO3 đặc nguội, H2SO4 đặc nguội. 4. Phản ứng với dung dịch muối:. Fe + CuSO4 → FeSO4+ Cu. Không phản ứng với dd kiềm. Kết luận: * Sắt có đủ TCHH của kim loại. * Giống nhôm: Không phản ứng với HNO3 đặc nguội, H2SO4 đặc nguội * Khác nhôm : không tan trong dung dịch kiềm, là kim loại nhiều hoá trị. CC GAP. GPT.
<span class='text_page_counter'>(6)</span> Cá nhân + nhóm - 8 phút Nhiệm vụ: a. Cá nhân HS nghiên cứu nội dung SGK: Thí nghiệm – PTHH – Kết luận. b. Thảo luận nhóm, trả lời câu hỏi: - Phân tích hoá trị của Fe trong từng trường hợp? - Rút ra kết luận về TCHH của Sắt và so sánh với Nhôm? c. Thống nhất trong nhóm ghi nội dung vào Bảng 1 Bảng 1 I. Tính chất hoá học của sắt: (không lấy ví dụ từ SGK trừ phản ứng với oxi và Clo) ..................................................................................................................................... ..................................................................................................................................... ..................................................................................................................................... ..................................................................................................................................... II. Kết luận TCHH của Fe và so sánh với Al: ..................................................................................................................................... ..................................................................................................................................... . GAD GTN.
<span class='text_page_counter'>(7)</span> GÓC PHÂN TÍCH Bảng 1 I. Tính chất hoá học của sắt: 1. Phản ứng với phi kim: a. Với oxi: 3Fe + 2O2 t Fe3O4 ( Fe hoá trị II và III) b. Với Clo: 2Fe + 3Cl2 t 2FeCl3 (Fe hoá trị III) 2. Phản ứng với dung dịch axit: Fe + H2SO4loãng → FeSO4 + H2 (Fe hoá trị II) Sắt không tác dụng với HNO3 đặc nguội, H2SO4 đặc nguội 3. Phản ứng với dung dịch muối: Fe + 2AgNO3 → Fe(NO3)2 + 2Ag (Fe hoá trị II) o. o. II. Kết luận TCHH của Fe và so sánh với Al: * Sắt có những tính chất hoá học của kim loại. * Giống nhôm: - Đủ tính chất của kim loại. - Không phản ứng với HNO3 đặc nguội, H2SO4 đặc nguội) * Khác nhôm: không tan trong dung dịch kiềm, là kim loại nhiều hoá trị. GTN.
<span class='text_page_counter'>(8)</span> Cá nhân + nhóm – 8 phút Nhiệm vụ: 1. Cá nhân: nghiên cứu nội dung trong bảng hỗ trợ sau: BẢNG HỖ TRỢ Điều kiện. Hoá trị của Fe. - Với Oxi. cần nhiệt độ cao.. Cả II và III. - Với Clo, Brôm. cần nhiệt độ cao.. III. - Với Lưu huỳnh (II). cần nhiệt độ cao.. II. - Với dung dịch axit HCl, H2SO4 loãng. tiếp xúc. II. - Với dung dịch muối. tiếp xúc. II. Phản ứng của sắt. Sắt không phản ứng với : HNO3 đặc nguội, H2SO4 đặc nguội, dung dịch kiềm.. 2. Thảo luận nhóm: * Ghi kết quả vào bảng 3 cho phù hợp * So sánh TCHH của Sắt với Nhôm..
<span class='text_page_counter'>(9)</span> GÓC ÁP DỤNG Thí nghiệm. Bảng 3 Hiện tượng. a. một ống nghiệm có chất rắn đỏ bám trên đinh sắt, dd nhạt màu xanh ; một ống nghiệm không có hiện tượng. b. một ống nghiệm có xuất 2- Cho một sợi dây sắt uốn hiện bọt khí tạo dung dịch cong thành lò xo, đốt nóng đỏ màu lục nhạt; 2 ống nghiệm trên ngọn lửa đèn cồn rồi đưa không có hiện tượng gì. nhanh vào bình khí Clo 3- Trộn đều hỗn hợp bột sắt với c. sợi dây sắt loé sáng lưu huỳnh cho vào ống nghiệm nhưng không có ngọn lửa rồi đun nóng trên đèn cồn. tạo hạt nhỏ màu nâu đen 4- Cho một ít bột sắt vào 3 d. một chất rắn tan và ống nghiệm đựng dd HCl, tạo khí không màu; H2SO4 đặc và HNO3 đặc một chất không tan. e. xuất hiện chất rắn nóng 5- Cho 2 đinh sắt sạch vào đỏ, để nguội chuyển dần 2 ống nghiệm đựng dung thành màu nâu đen. dịch ZnSO4 và Cu(NO3)2 6- Cho một ít bột nhôm và f. màu vàng lục của khí bột sắt vào 2 ống nghiệm biến mất, sản phẩm là đựng dung dịch NaOH. chất bột màu nâu đỏ 4 + b 2 + f 3 + e 1 + c. GTN GPT. PTHH. 1- Uốn cong sợi dây Fe thành lò xo, đầu cột mẫu than. Đốt cháy đỏ, đưa nhanh vào lọ O2.. . 5 +. a. 6 +. d.
<span class='text_page_counter'>(10)</span> GÓC ÁP DỤNG Thí nghiệm. Bảng 3 Hiện tượng. GTN. PTHH. 1- Uốn cong sợi dây Fe thành lò xo, đầu cột mẫu than. Đốt cháy đỏ, đưa nhanh vào lọ O2.. c. sợi dây sắt loé sáng nhưng không có ngọn lửa tạo hạt nhỏ màu nâu đen. 3Fe + 2O2. 2- Cho một sợi dây sắt uốn cong thành lò xo, đốt nóng đỏ trên ngọn lửa đèn cồn rồi đưa nhanh vào bình khí Clo 3- Trộn đều hỗn hợp bột sắt với lưu huỳnh cho vào ống nghiệm rồi đun nóng trên đèn cồn. 4- Cho một ít bột sắt vào 3 ống nghiệm đựng dd HCl, H2SO4 đặc và HNO3 đặc. f. màu vàng lục của khí biến mất, sản phẩm là chất bột màu nâu đỏ. 2Fe + 3Cl2. 5- Cho 2 đinh sắt sạch vào 2 ống nghiệm đựng dung dịch ZnSO4 và Cu(NO3)2 6- Cho một ít bột nhôm và bột sắt vào 2 ống nghiệm đựng dung dịch NaOH.. e. xuất hiện chất rắn nóng đỏ, để nguội chuyển dần thành màu nâu đen.. Fe. + S. Fe3O4. o. t . o. t . 2FeCl3. o. t . FeS. b. 1 ống nghiệm có bọt khí tạo dd màu lục nhạt; 2 ống Fe + 2HCl → FeCl2 + H2 nghiệm không hiện tượng gì a. 1 ống nghiệm có chất rắn Fe + Cu(NO3)2 → đỏ bám đinh sắt, dd nhạt màu xanh ; 1 ống nghiệm Fe(NO3)2 + Cu không hiện tượng. d. một chất rắn tan và tạo khí không màu; một chất không tan.. 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2. Fe không tan trong kiềm.
<span class='text_page_counter'>(11)</span> Sắt cháy trong oxi tạo oxit sắt từ Fe3O4 5.
<span class='text_page_counter'>(12)</span> dd NaOH. Fe. * *. * *. * *. Cl23x ddFeCl Fe(OH)x3 FeCl. Phản ứng của sắt với Clo 5.
<span class='text_page_counter'>(13)</span> dd NaOH Fe. Fe. Fe. H2. H2SO4đặc HNO3đặc. ddHCl Fe(OH)2. Phản ứng của Sắt với dung dịch axit 5.
<span class='text_page_counter'>(14)</span> Fe. Fe. Cu dung dịch CuSO4. Phản ứng của Sắt với dung dịch muối CuSO4 5.
<span class='text_page_counter'>(15)</span> Điền dấu x vào ô trống nếu có phản ứng. Al. Fe. Khí Oxi. x. x. dd H2SO4 loãng. x. x. dd CuCl2. x. x. H2SO4 đặc nguội. o. o. Khí Clo. x. x. dd ZnSO4. x. o. dd MgCl2. o. o. dd Ca(OH)2. x. o.
<span class='text_page_counter'>(16)</span> Bài tập 2/60 sgk a. Để tạo Fe2O3 từ Fe : Fe → FeCl3 → Fe(OH)3 → Fe2O3 b. HS khá: * Fe → FeCl2 → Fe(OH)2 → Fe(OH)3 → Fe2O3 * Fe → Fe3O4 → (FeCl2 + FeCl3) → Fe(OH)3 → Fe2O3 Bài tập 5/60sgk - Viết PTHH - Fe dư → CuSO4 pư hết → A gồm Fe dư và Cu - Cho A vào HCl dư thì Fe tan hết → rắn còn lại là Cu (sp của CuSO 4 với Fe) - Dung dịch B là FeSO4 - Từ nCuSO4 → nFeSO4 → nNaOH → VNaOH - Hoàn thành các bài tập 1 – 5 (SGK) theo hướng dẫn. - Tìm hiểu hợp kim sắt: + Hợp kim là gì? + Nguyên liệu sản xuất gang, sản xuất thép? + PTHH xảy ra trong quá trình luyện gang thép?.
<span class='text_page_counter'>(17)</span>
<span class='text_page_counter'>(18)</span>