Maladies oculaires - part 3 potx
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (1.33 MB, 44 trang )
10) Liens internet
FFESSM
Fédération Française d'Etudes et de Sports sous-marins
CMAS
Confédération Mondiale des activités subaquatiques
CROSS
Centres Régionaux d'Opérations de Sécurité et de Sauvetage
PADI
Professional Association of Diving Instructors
NAUI
National Association of Underwater Instructors
MEDSUBHYP
Site actuellement "défacé"
MP
Médecine et plongée
© WebRing Inc.
Le Cercle Aquatique
<< Prev
| Ring Hub | Join |
Rate
|
Next >>
Search
Accueil | Photothèque | Annonces | Art | Histoire | Liens | Vue |
Maladies
| Chirurgie | Homepage |
Nous écrire
Rétinopathie diabétique
Rev 12-06-2004
jmm
Fond d'oeil normal
Généralités
Le
diabète
est une des cinq principales causes de
cécité
en Europe. Son traitement exige
une étroite
collaboration
entre l'ophtalmologiste, le diabétologue et le médecin
généraliste.
L'équilibre
du diabète et un éventuel traitement par
laser
sont les garants
d'une vision conservée.
La prévalence est de 2% à 2,5% de la population française, 90% des patients ayant un
diabète de type 2.
Il y a diabète quand la glycémie à jeun est supérieure ou égale à 1,26g/l à deux reprises
(normes de l'ANAES).
L'élément primordial pour surveiller la bonne stabilité du diabète est la mesure de
l'hémoglobine glyquée (ou glycosylée) appelée HbA1c, qui ne doit pas dépasser 7%. Des
valeurs supérieures montrent un diabète instable et mal équilibré qui peut entraîner des
complications à différents endroits (yeux, reins, pieds, principalement). La nouvelle
campagne d'information du 14 au 20 juin 2004 de l'ALFEDIAM
met l'accent sur ce
point: "Vous avez du diabète ! Retenez 7 et soyez en dessous pour prévenir les
complications".
Historique
Susruta
dès l'Antiquité évoquait ce qu'il appelle :" l'urine de miel, cette maladie qui
frappe les riches le malade maigrit, se fatigue, la soif est importante, les mictions
nombreuses. Les fourmis s'attroupent autour de l'urine, les infections sont fr
é
quentes. "
Au cours des siècles on comprit que le pancréas était l'organe nécessaire pour la
régulation de la glycémie. Paul Langerhans en 1869 décrivit les ilô
ts qui portent son nom
et qui sécrètent l'insuline. A cette époque on n'avait pas individualisé l'insuline et on
disait : "Le diabétique, s'il ne se soigne pas, sera emporté par la tuberculose; s'il se
soigne, il succombera au coma acétonémique."
En 1855 Eduard von Jaeger décrivit une rétinopathie diabétique et en fit le dessin; on y
voit des exsudats et des hémorragies. Le développement de l'ophtalmoscope
permit
l'essor de l'examen du fond d'oeil du diabétique.
Jaeger 1855
La découverte de l'insuline en 1922 par
Banting
et
Best
fut un grand progrès pour le
traitement des patients. Cela leur valut le prix Nobel. Le traitement du diabète s'améliora
nettement depuis cette date.
Le premier vrai traitement de la rétinopathie diabétique (RD) fut fait par
Meyer
-
Schwickerath
dans les anné
es 60, par photocoagulation. L'introduction de l'angiographie
fluorescéinique permit de mieux définir les stratégies thérapeutiques.
Classification des diabètes
Diabète de type 1 :
Les débuts de la maladie sont insidueux et le patient ne se rend compte de rien. Puis
apparaît un amaigrissement, une polydipsie (soif importante) et une polyurie (urines
abondantes). C'est un sujet jeune qui présente un diabète de type 1, autrefois appelé
diabète insulino
-dépendant ou diabète juvénile. Le traitement sera le plus souvent une
insulinothérapie après un bilan général fait au cours d'une hospitalisation.
On en décrit deux sous
-groupes:
les diabètes auto
-immuns avec anticorps anti-ilôts de Langerhans
les diabètes idiopathiques
Diab
è
te de type 2 :
Ce diabète atteint généralement les patients pléthorique de plus de 50 ans, autrefois
appelé diabète gras ou diabète non insulino
-
dépendant. Là aussi un bilan général sera
nécessaire et un traitement adapté, avec souvent un régime et des hypoglycé
miants oraux.
Plus de 50% sont familiaux.
Autres diabètes :
Les diabètes iatrogènes, d'origine pancréatique, gestationnels.
Etiopathogénie
La rétinopathie diabétique est une
maladie du capillaire rétinien
qui devient anormal et
va avoir un comportement responsable de la pathologie oculaire. On observe une
disparition des péricytes qui sont les cellules qui entourent les capillaires. Les cellules
endothéliales des capillaires ne sont plus régulées par les péricytes et vont être plus
volumineuses et plus nombreuses; on note également une membrane basale qui devient 3
fois plus épaisse que la normale. On assiste alors à une rupture de la barrière hémato
-
rétinienne, conséquence d'une altération des jonctions inter-endothé
liales. Va ainsi surgir
une hyperperméabilité du réseau capillaire qui correspond à la diffusion du colorant lors
de l'angiographie fluorescéïnique.
Des
anomalies hémorhéologiques
vont perturber encore plus le fonctionnement des
capillaires. On décrit une augmentation de l'agrégabilité plaquettaire et érythrocytaire, et
des variations de concentrations en divers facteurs (Antithrombine III, facteur VIII ).
La
néovascularisation
va être l'aboutissement de ces dysfonctionnements. La
modification de l'architecture des capillaires va provoquer des zones d'ischémie
rétinienne qui vont être le point d'appel de néovaisseaux, redoutables. Ils seront
responsables (sans traitement) d'hémorragies dans le vitré, de voiles gliaux, de
décollements de rétines, de cécité.
Conséquences de la rétinopathie diabétique (RD)
Comme le diabète entraîne une
hyperperméabilité capillaire
on va assister à
l'apparition
d'un
oedème rétinien
et généralement
maculaire
qui va être responsable de baisse de
vision.
L'autre caractéristique de la maladie est de donner des
occlusions des capillaires
rétiniens
, ce qui va provoquer une
ischémie rétinienne
. Ces territoires d'ischémie vont
entraîner l'apparition de
néovaisseaux
extrêmement fragiles qui auront tendance à
avancer dans le vitré et à saigner.
Ces deux grands types de RD peuvent s'associer et on assiste alors à des ischémies en
périphérie rétinienne et des exsudats maculaires.
Anomalies du fond d'oeil
Différents tableaux cliniques s'observent : du moins grave au plus grave :
Absence de rétinopathie diabétique à l'examen biomicroscopique
RD non proliférante minime :quelques microanévrismes et quelques
microhémorragies, éventuellement une légère diffusion du colorant
RD non proliférante modérée : nombreux microanévrismes et hémorragies
rétiniennes, petits territoires d'ischémie
RD préproliférante : vastes territoires d'ischémie visibles à l'angiographie, vastes
hémorragies, veines moniliformes ou en chapelet
RD proliférante minime : néovaisseaux prérétiniens sur une surface inférieure à
une
demi papille
RD proliférante modérée : néovaisseaux prépapillaires dans moins d'un tiers de la
surface papillaire, néovaisseaux prérétiniens dans une surface supérieure à
une demi
papille
RD proliférante sévère : néovaisseaux papillaires sur plus d'un tiers de la surface
papillaire
RD proliférante compliquée d'hémorragie du vitré, de décollement de rétine par
traction ou de glaucome néovasculaire
Maculopathie diabétique oedémateuse
Maculopathie ischémique
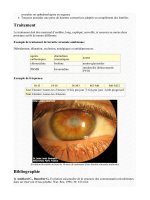
Aspect d'une rétinopathie diabétique proliférante:
Madame X consulte pour un amaigrissement récent, une fatique importante. La prise de
sang met en évidence une glycémie à 3,96g/l et une HbA1C à 10,6%. L'examen
ophtalmologique montre une rétinopathie préproliférante à droite et proliférante modérée
à
gauche, qu'il faut panphotocoaguler pour
é
viter tout risque de c
é
cit
é
.
Rétinopathie diabétique non proliférante minime
Rétinopathie diabétique proliférante
Photo Professeur André Mathis Hô
pital de Toulouse
Rangueil France
Quelques uns de ces clichés angiographiques (
cliquer
pour agrandir les images):
Clichés Dr Patrice Déglise
Dépistage et Surveillance de la RD :
Recommandations de l'ALFEDIAM
Dépistage
de la rétinopathie diabétique
Diabète de type 1:
* Examen du fond d'oeil dès la découverte du diabète (chez les enfants, premier examen
à l'âge de 10 ans)
*Fond d'oeil annuel, puis premi
è
re angiographie d
è
s les premiers signes de r
é
tinopathie
Oeil droit:
rétinopathie diabétique
non
-
proliférante sévère
Oeil gauche:
rétinopathie diabétique
proliférante modérée
diabétique (et éventuellement de façon systématique après 5 années de diabète)
Diabète de type 2:
*Examen du fond d'oeil à la découverte du diabète et angiographie dès les premiers
signes de rétinopathie diabétique (et éventuellement angiographie systématique à la
découverte du diabète)
*Puis surveillance annuelle ou plus fréquente selon les résultats du premier fond d'oeil
Surveillance
de la rétinopathie diabétique
* Pas de rétinopathie diabétique : surveillance annuelle du fond d'oeil
* Rétinopathie diabétique minime : FO + angiographie annuels
* Rétinopathie diabétique non proliférante modérée :
-
FO + angiographie tous les 6 mois à un an fonction de la maculopathie associée
-
si traitement par laser maculaire, FO + angiographie 4 à 6 mois après le traitement
* Rétinopathie diabétique non proliférante sévère (ou préproliférante):
FO + angiographie tous les 6 mois (sauf conditions particulières)
PPR à envisager en cas de grossesse, d'équilibration rapide de la glycémie, de chirurgie
de la cataracte, de Rétinopathie Diabétique Proliférante ou de Rétinopathie Diabétique
Préproliférante controlatérale, chez un sujet à suivi aléatoire
* Rétinopathie diabétique proliférante :
Photocoagulation panrétinienne (rapidité fonction de la gravité de la RD)
FO + angiographie 2 à 4 mois mois après la fin du traitement
(Dans certains cas particuliers, des contrôles angiographiques peuvent être indiqués à
des
intervalles de temps plus rapprochés que ceux prescrits)
Traitements
Le but du traitement général est d'obtenir une hémoglobine glycosylée (ou glyquée)
inférieure à 7%, suivant les recommandations de l'ANDEM, une tension artérielle
inférieure ou égale à 14/8, un arrêt du tabac, un contrôle du poids et un bilan lipidique
correct.
Les progrès actuels des traitements sont dus à une meilleure auto
-
surveillance, une
amélioration des techniques d'insulinothérapie et une bonne éducation des diabétiques.
L'exercice physique sera un facteur favorable.
Le traitement de la RD associe un équilibre aussi parfait que possible du diabète et une
photocoagulation laser.
Panphotocoagulation rétinienne (PPR)
Photo Professeur André Mathis Hôpital de Toulouse
-
Rangueil France
La rétinopathie diabétique proliférante :
Le but est de détruire les zones ischémiques qui entraînent un appel de néovaisseaux.
Après avoir mis une goutte de collyre anesthésique, on pose sur l'oeil un verre
d'observation à trois miroirs (ou autre). On réalise quatre à six séances de 500 impacts
chacune pour arriver à un total de 2000 à 3000 impacts.
On utilise un laser argon monochromatique vert ou bien un laser krypton en cas
d'opacités (hémorragie du vitré). Les impacts font 500µm de diamètre, avec un temps
d'exposition de 0,1 seconde, la puissance utilisée étant fonction du résultat. On cherche à
obtenir un impact rétinien d'un blanc franc.
Les résultats sont généralement excellents et on voit disparaitre les né
ovaisseaux dans les
trois mois qui suivent le traitement. Cela permet d'éviter la cécité. Le patient gardera un
rétrécissement du champ visuel comme cicatrice.
Certaines RD proliférantes entraînent une photocoagulation en urgence et le patient est
alors hospitalisé pour ce traitement; il s'agit d'une course contre la montre. S'il se produit
une hémorragie du vitré sévère, tout laser sera impossible.
En cas d'hémorragie du vitré on peut être amené à réaliser une
vitrectomie
, et à
remplacer le vitré. Cettte opération chirurgicale s'accompagnera d'un
laser
per
-
opé
ratoire
endoculaire. Le chirurgien rétinologue est habitué à ce type de chirurgie difficile. C'est
lui qui posera l'indication de la vitrectomie en fonction de différents critères cliniques,
g
é
n
é
raux et angiographiques.
La maculopathie diabétique
La forme exsudative est particulièrement difficile à
traiter. L'ophtalmologiste peut parfois
réaliser une photocoagulation laser périmaculaire (en grille ou grid), mais l'indication est
difficile à poser et la réalisation du laser est délicate.
Il n'y a pas de traitement de la maculopathie ischémique.
Un cas particulier
Le diabète mitochondrial
associe une dystrophie maculaire réticulé
e (pattern dystrophy)
à un trouble de la glyco
-
régulation, une surdité et parfois une atteinte neuro
-
musculaire.
Ce diabète par cytopathie mitochondriale a une transmission maternelle (les
spermatozoides n'ont pas de mitochondries) et correspond au MIDD des anglo
-saxons
(Maternally inherited diabetes and deafness). Cette maladie est due à une mutation
ponctuelle de l'ARNt de la leucine.
Le pronostic visuel est bon.
Diabète mitochondrial
Photo Professeur André Mathis Hôpital de Toulouse
-
Rangueil France
Nous ne ferons qu'
évoquer
la maladie de Wolfram
, qui associe un
diabète insulino
-
dépendant
, une
atrophie optique
bilatérale, un
diabète insipide
et une
surdité
.
Etude de nouveaux traitements
Le traitement suivant est en phase d'
évaluation
, et en fonction des résultats il sera
peut
-
être
utilisé dans quelques années:
Aptamer
(
EYE001
) : cette molécule dont le nom commercial est
Macugen
est un
oligonucléotide anti
-
VEGF
(
V
ascular
E
ndothelial
G
rowth
F
actor). Ce produit injecté
par voie intravitréenne a pour but de se lier au VEGF présent dans l'oeil malade pour
éviter que le VEGF ne se lie à son récepteur normal. Cette molécule a montré une
certaine activité dans des modèles in vitro et in vivo, bloquant les néovascularisations. Il
présenterait aussi une action contre les fuites vasculaires responsables des
oedème
maculaires du diabétique
.
Conclusion
On a assisté à des progrès importants dans le traitement de la rétinopathie diabétique. Il
s'agit là d'une pathologie fréquente qui est parfois sous
-estimée ou négligée. On ne
devrait plus détecter de rétinopathie diabétique au stade de complications. Une éducation
de la population et des acteurs de la Santé semble importante pour éviter nombre de
cécités.
Bibliographie sommaire
GRANGE J.D. La rétinopathie diabétique. Société française d'ophtalmologie. Masson
1995.
MASSIN
-
KOROBELNIK P., GAUDRIC A.
-
La maculopathie diabétique. J. Fr.
Ophtalmol., 1994, 17, 427
-453.
VAGUE P., RACCCAH D.
- Histoire naturelle de la résistance à l'insuline et de
l'hyperinsulinisme dans le diabète non insulino
-dépendant. In : Journées de Diabé
tologie
de l'Hôtel
-
Dieu Flammarion Médecine
-
Sciences, Paris, 1990, p. 201
-
209.
SCHEEN A., NEMERY A., LUYCKS A., LEFEBVRE P.
- Etiologie et
physiopathologie du diabète sucré. Encycl. Méd. Chir. (Paris). Glande endocrine
Nutrition, 100366 clO r, 1986, 18 p.
ALAERTS L., SLOSSE J. - Les complications oculaires du diabète. Bull. Soc. Belge
Ophtalmol., 1957, 115, 9
-
25.
AMALRIC P.
-
Essai de traitement de la rétinopathie diabétique exsudative. Soc.
Ophtalmol. Paris, 1960, 516, 359
-
363.
ASHTON N.
-
Vascular changes in diabetes with particular reference to the retinal
vessels. Brit. J. Ophthalmol., 1949, 33, 407.
BAILLiART P.
-
La circulation rétinienne à l'é
tat normal et pathologique. 0. Doin, Paris,
1923, p. 330.
BALAVOINE C.
-
Myopie forte et rétinopathie. Probl. Act. Ophtalmol., S. Karger,
Basel, 1957, 1, 683
-
688.
FROGUEL P., ZOUALi H., VIONNET N. et al.
-
Familial hyperglycerma due to
mutations in glucokinase. Definition of a subtype of diabetes mellitus. New Engl. J.
Med., 1993, 328, 687
-
702.
KRISKA A.M., LAPORTE R.E., PETTiTT D.J. et al.
-
The association of physical
activity with obesity, fat distribution and glucose intolerance in Pima lndians.
Diabetologia, 1993, 36, 863
-
869.
HERSH P.S., GREEN W.R., THOMAS J.V.
-
Tractional venous loops in diabetic
retinopathy. Am. J. Ophthalmol., 1981, 92, 661
- 671.
KINYOUN J.L., MARTIN D.C., FuJIMOTO W.Y., LEONETTi D.L.
-
Ophthalmoscopy
Versus Fundus Photographs for Detecting and Grading Diabetic Retinopathy. Invest.
Ophthalmol. Vis. Sci., 1992, 33, 1888
-1893.
KLEIN BFX., Moss S.E., KLEIN R., MAGLi Y.L., HOYER C.H.
- Neuroretinal Rim
Area in Diabetes Mellitus. Invest. Ophthalmol. Vis. Sci., 1990, 31, 805
-809.
LEWIS H.
- Anterior hyaloidal fibrovascular proliferation. In : Medical and Surgical
Retina. H. LEwis, S.J. RYAN. Cv Mosby, St
-Louis, 1994, 326-329.
Sites internet
Un seul lien qui résume l'ensemble du monde du diabète et propose de nombreux liens
(associations, sociétés savantes, laboratoires )
Accueil | Photothèque | Annonces | Art | Histoire | Liens | Vue |
Maladies
| Chirurgie | Homepage |
Nous écrire
Les phacomatoses
Introduction
Les
phacomatoses
regroupent différentes maladies :
la neurofibromatose NF1 de Von Recklinghausen
la neurofibromatose NF2
la sclérose tubéreuse de Bourneville (ci
-
dessous)
le syndrome de Sturge
-
Weber
-
Krabbe
la maladie de Von Hippel
-
Lindau
et diverses
dysembryoplasies neuro
-
ectodermiques
.
Leur origine est en effet un dysfonctionnement du
tissu ectodermique embryonnaire
qui formera la peau, le système nerveux et l'oeil. Ces trois éléments seront donc atteints
à
des degrés divers dans toutes ces maladies.
Sclérose tubéreuse de Bourneville
Avecl'aimable autorisation du Professeur Bonafé
Service de Dermatologie CHU Toulouse
-
Rangueil France
Définition
Cette affection
rare
(1 sur 6.000
à
30.000 naissances) associe des anomalies
oculaires
à
des perturbations des
reins
, du
coeur
, du
cerveau
et de la
peau
. Les tumeurs qui
atteignent ces différents organes sont
bénignes
et sont dues à des anomalies de certaines
cellules embryonnaires
. La plupart des lésions sont des
hamartomes
.
Historique
Décrit pour la première fois en
1862
par Von Recklinghausen, ce n'est finalement qu'en
1880
que
Bourneville
donne le nom "sclérose tubéreuse" à ce syndrôme qui depuis porte
son nom. Le terme de sclérose fut donnée pour illustrer la
consistance
ferme des
formations et le mot
tubéreux
(du latin
tuberosus
'garni de protubérances') est en rapport
avec l'aspect des lésions, qui sont
proéminentes
.
Génétique
C'est une maladie familiale,
héréditaire autosomique dominante
, donc les garçons sont
autant touchés que les filles. La
pénétrance
et
l'expression
sont variables, on peut ainsi
voir différentes formes cliniques dans une même famille.
On a pu cartograhier en
1987
les gènes responsables. Il semble qu'il y ait 2 gènes
responsables, le gène
TSC 1
localisé sur le chromosome 9 (en
9q34
) , appelé gène
hamartin
, et le gène TSC 2 sur le chromosome 16, appelé gène
tuberin
(en position
16p13.3
). Ce gène semble avoir un rôle de supression de tumeurs.
Il n'y a pas de test génétique prénatal pour l'instant.
La lésion initiale de cette maladie est un
hamartome astrocytaire
, qui est une espèce de
formation que l'on va retrouver à différents endroits de l'organisme.
Signes cliniques
Signes neurologiques :
Ils sont prédominants dans le tableau clinique. Ils entraînent souvent une enquête
étiologique. On trouve :
des crises d'épilepsies fréquentes
des troubles mentaux
un retard intellectuel, dans 75% des cas
C'est l'IRM qui va mettre en évidence des formations intracérébrales de tubercules qui
auront tendance à se calcifier.
Signes dermatologiques :
Avecl'aimable autorisation du Professeur Bonafé
Service de Dermatologie CHU Toulouse
-
Rangueil France
Ils aident au diagnostic car ils sont très fréquents :
macules dépigmentées à rechercher en lumière de Wood, la dépigmentation étant
due à des mélanocytes raréfiés et des mélanosomes immatures
angiofibromes cutanés : leur emplacement est typique, sur la face, de part et d'autre
du nez, leur taille est assez réduite (un à quelques millimètres). On peut les traiter
par dermabrasion.
la peau de chagrin lombaire apparaît après l'âge de 5 ans et est décrite comme une
zone rugueuse de la région lombaire
les fibromes péri-ungéaux ou tumeur de Koenen sont de petits angiofibromes de la
taille d'un petit pois, dans les sillons ungéaux (ongles). Ils apparaissent à la puberté.
Signes oculaires
Ce sont des
phacomes
, des
hamartomes astrocytaires
localisés autour de la papille, et
souvent trouvés par hasard ou bien dans le cadre d'un bilan général pour troubles
neurologiques. On les observe dans 50% des cas.
Classiquement on en décrit deux catégories :
Le type I qui est un nodule cotonneux, plat ou peu saillant, de 1
à
2 diam
è
tres papillaires.
Le type II plus postérieur, qui est une tumeur mûriforme en "amas de grains de tapioca".
L'angiographie fluorescéinique montre une lésion qui masque le fond choroïdien, puis le
caractère vasculaire de la tumeur apparaît, et enfin apparaî
t une hyperfluorescence diffuse
de la tumeur.
Cliché Dr Claude Levy
Ces lésions peu évolutives n'entraînent en principe pas de baisse de la vue qui aura plutôt
une origine centrale, à cause des lésion intracérébrales.
Traitement
Il n'y a pas de traitement spécifique de cette maladie, en revanche on peut juguler
l'épilepsie par différents traitements médicaux et parfois enlever les tumeurs.
Un entourage attentif augmente tr
è
s nettement le confort de vie des patients.
Quelques sites internet :
Orphanet
Association Sclérose Tubéreuse de Bourneville
(mise à jour) ASTB 44, rue É mile Lepeu
75011 Paris (01 43 67 49 19)
en anglais:
National Tuberous Sclerosis Association
Tuberous Sclerosis International
OMIM
Accueil | Photothèque | Annonces | Art | Histoire | Liens | Vue |
Maladies
| Chirurgie | Homepage |
Nous écrire
Séquence de Pierre Robin SPR
Syndrome de Pierre Robin
Rev 01-02-2004
jmm
Nous remercions beaucoup la m
ère de l'enfant qui a accepté de nous confier le cliché ci-dessous et nous a permis de
l'utiliser pour cette page web.
Séquence de Pierre Robin
1) Définition
Le syndrome de Pierre Robin
atteint environ un enfant sur 8000 naissances et associe
trois éléments:
une fente palatine en forme de U
une micrognathie (petite mâchoire inférieure, hypoplasie mandibulaire)
une glossoptose (chute de la langue en arrière pouvant donner des difficultés
respiratoires(dyspnée ou détresse respiratoire)
Il peut
ê
tre isol
é
ou bien entrer dans le cadre d'un syndrome polymalformatif.
On a tendance à parler plutôt de
séquence Pierre Robin
(SPR) car on est en présence
d'une ensemble d'anomalies qui découlent les unes des autres.
2) Historique
Maxime Ménard (1872-1926) et Odilon Marc Lannelongue (1840-1911) décrivirent en
1891 différentes affections congénitales dont le SPR.:
Affections congénitales de la tête et du cou. Lannelongue Paris, 1891
Pierre Robin (1867-1950) a détaillé cette pathologie en 1923, devant un enfant qui
présentait une hypoplasie mandibulaire et une langue qui tombait vers l'arrière, gênant la
respiration.
La glossoptose. Son diagnostic, ses conséquences, son traitement. Pierre Robin Bulletin de
l’Académie nationale de médecine, Paris, 1923, 89: 37. J Med Paris, 1923, 43: 235-237.
La glossoptose, un grave danger pour nos enfants. Pierre Robin Paris, Gaston Doin, 1927.
Glossoptosis due to atresia and hypertrophy of the mandible. Pierre Robin American Journal
of Diseases of Children, Chicago, 1934, 48: 541.
3) Clinique
L'étiopathogénie de ce syndrome n'est pas connue, mais on pense qu'il s'agit d'une
hypoplasie mandibulaire embryonnaire qui s'accompagne d'une malposition de la langue,
entraînant une fente palatine.
Sur le plan ophtalmologique il est possible de constater différentes anomalies, dans 10 à
30% des cas, plus ou moins associées:
une cataracte
un ptosis
une forte myopie
un glaucome dysgénésique
un décollement de rétine
le vitré est liquéfié et optiquement vide, il existe souvent un décollement postérieur
du vitré avec hyaloïde postérieure épaissie et fenêtrée
la périphérie rétinienne peut être plus ou moins altérée (atrophie, clumping,
palissades )
La SPR est souvent sporadique. Une hérédité autosomique est possible dans 10 à 15%
des cas.
La SPR peut rentrer dans le cadre de maladies polymalformatives, comme le syndrome
de Stickler qui est une arthro-ophtalmopathie héréditaire à transmission autosomique
dominante dont l'expression phénotypique est très variable. On peut aussi évoquer le
syndrome de Wagner qui est très proche du syndrome de Stickler (certains auteurs
pensent qu'il s'agit de la même entité), avec une vitréorétinopathie.
La SPR peut se retrouver
é
galement dans
le syndrome de Weissenbacher
-
Zweymuller
ou
le syndrome velocardiofacial.
4) Evolution
Elle est souvent favorable quand le Pierre Robin est isolé et ne s'associe pas à des
troubles généraux sévères.
On est amené à fermer chirurgicalement la fente palatine. La position de la langue va se
normaliser progressivement. Verticale au début, elle va retrouver une position
physiologique horizontale. Un environnement médicalisé attentif est nécessaire pour
éviter les fausses routes et les troubles respiratoires.
5) Liens
en français:
Association Tremplin
en anglais:
e
-medicine excellente page réalisée par un ORL
OMIM
la référence
Accueil | Photothèque | Annonces | Art | Histoire | Liens | Vue |
Maladies
| Chirurgie | Homepage |
Nous écrire
Thérapie génique
Rev 15-01-2003
jmm
1) Frankenstein: une introduction à la thérapie génique ?
Des chercheurs ont créé ce que la
Nature
n'a pas osé imaginer. En effet le mensuel
Nature Biotechnology,
de
février 2002
, relate le travail de l'équipe japonaise du
Pr
Shigeyuki Yokohama
(Université de Tokyo). Elle a créé une
nouvelle paire de
nucléotides
qui fut incorporée dans de l'ADN d'
Escherichia coli
. Ainsi aux quatres bases
naturelles
A(adénine)
,
G(guanine)
,
T(thymine)
et
C(cytosine)
, les japonais ont ajouté
les bases
S (2
-
amino
-
6
-
(2
-
thienyl)purine)
et
Y (pyridin
-
2
-
one)
. Ceci a permis la
formation d'un
nouvel acide aminé non naturel
, la
3
-
chlorotyrosine
.
On va ainsi parvenir à créer des
organismes chimériques
inconnus sur Terre
Une société pratiquant l'
evolutionary biotechnology history (évolution dirigée)
:
Evologic
(pas de site internet pour l'instant mais le nom evologic est réservé).
2) La thérapie génique, qu'est ce que c'est ?
ADN en double hélice
Il s'agit d'une nouvelle approche thérapeutique, qui consiste à
adapter le
fonctionnement des cellules
de l'organisme en modifiant, dans chaque cellule, les
commandes qui sont situées dans les
chromosomes
. Cela doit permettre de soigner
certaines maladies (rôle curatif) ou, un jour, d'éviter que certaines pathologies ne
surviennent (r
ô
le pr
é
ventif).
On imagine ainsi proposer dans l'avenir cette thérapie en ophtalmologie pour différentes
maladies que l'on va citer. Le nombre de patients atteints est primordial pour susciter des
recherches; certaines maladies orphelines ont peu d'espoir d'intéresser la recherche dans
un premier temps.
3) Historique de la thérapie génique
Les années 80 permirent d'explorer l'ensemble des gènes humains, le
génome
, et de les
répertorier. On pense qu'on connaitra la totalité des gènes humains d'ici quelques années.
Cette science est la
génomique
, qui demande beaucoup de travail et d'argent pour
accéder à ce décryptage.
Les premières tentatives thérapeutiques apparurent en
1990
grâce à une stratégie
ex
vivo
: les cellules du patient sont prélevées et vont être cultivées en laboratoire en
association avec les vecteurs. Une fois leur ADN modifiée, elles sont réinjectées au
patient.Les chercheurs se sont rendus compte que l'expression du gène n'est pas toujours
efficace. Les premières maladies que l'on pensait traiter était la myopathie de
Duchenne
ou l'
hémophilie
.
4) Rappels de génétique
Les
chromosomes
sont les éléments situés dans les
noyaux
des cellules et sont formés
par une longue molécule, l'
ADN
(
a
cide
d
ésoxyribo
n
ucléique).
L'ADN est composée d'un grand nombre de parties unitaires,
les gènes
, qui vont
fabriquer les
protéines
destinées aux fonctionnement de l'organisme. On assiste là à une
'
expression
' des gènes. On peut dire, schématiquement (et de façon fausse), qu'il y a un
gène qui est responsable de la couleur des yeux, un autre qui est responsable de la taille
de l'individu
Il y a ainsi entre
50.000 et 100.000 gènes
qui dirigent l'organisme.
Les gènes sont formés d'un assemblage d'éléments placés côté à côte, appelés
nucléotides
formés d'un sucre à 5 atomes de carbone, le désoxyribose, d'un groupement
de phosphate et d'une base azotée parmis les quatre possibles :
adénine
,
guanine
,
thymine
et
cytosine
. Ces bases azotées sont complémentaires deux à deux et reliées par
des liaisons faibles hydrogènes. Elle se relient ainsi:
adénine
-
thymine
et
cytosine
-
guanine
.
Un g
è
ne : un fragment d'ADN
Le
génotype
(ensemble des gènes) de chacun de nous correspond à un
phénotype
(taille,
couleur des yeux ).
5) Buts de la thérapie génique
La thérapie génique va essayer de
modifier les gènes
qui sont déficients et fonctionnent
mal. Il faut donc agir au sein de chaque cellule malade sans altérer les cellules saines. Le
but recherché, complexe à atteindre, est donc la modification de la production des
protéines.
Pour cela il faut :
connaître les gènes responsables de la maladie. On réalise un
séquençage
de
l'ADN, c'est à dire une étude des nucléotides qui la composent (
génomique
structurale, informationnelle et fonctionnelle). L'étude de l'emplacement des gènes
permet de savoir où se trouve la zone responsable de la pathologie.
créer un gène sain en synthétisant une chaine de nucléotide
incorporer cette chaine dans un vecteur viral ou non
-
viral
sélectionner avec précision les cellules cibles qui devront permettre l'entrée du gène
introduire le vecteur avec le gène dans la cellule
lui éviter d'être détruit dans le cytoplasme par les enzymes, les lysosomes
lui permettre de passser dans le noyau cellulaire
l'incorporer dans le génome de la cellule
faire en sorte que le gène soit 'exprimé', et qu'il permette la synthèse de la protéine
saine, en quantité suffisante
espèrer une action pérenne et éviter les effets secondaires
6) Les vecteurs
Pour aller modifier les gènes des cellules, il faut utiliser des
vecteurs
dont le rôle est
d'apporter le
transgène
nécessaire aux cellules. Une nouvelle science émerge
actuellement, la
vectorologie
.
On décrit deux types de vecteurs:
Les
virus
qui ont la capacité de pénétrer les cellules et de mélanger leur matériel
géné
tique avec celui des cellules. Ce sont donc de bons candidats vecteurs, mais il y
a différentes difficultés qu'il faut surmonter. La
virulence
du virus doit d'abord être
très atténuée pour ne pas rendre malade le patient, et il faut aussi diminuer les
réactions immunitaires
qui vont s'attaquer au virus.
Il faut donc baisser autant que
possible son pouvoir antigénique pour éviter les réaction immunologiques
(formation d'anticorps, mobilisation des lymphocytes, activation du complément ).
Les virus ont l'habitude de s'adresser
à
un grand nombre de types cellulaires, alors
que nous désirons que le virus n'infecte qu'un type de cellule (respiratoire par
exemple). Les chercheurs essayent donc de mettre au point des technique qui
modifient la surface du virus pour que les antigènes de surface s'accordent avec les
cellules cibles (respiratoires par exemple) et n'aillent pas pénétrer d'autres cellules.
On utilise surtout des
rétrovirus
et moins souvent des
adénovirus
ou le
virus
adéno
-
associé
.
Les
vecteurs synthétiques
, à base d'ADN, de protéines, de lipides ou de polymè
res
cationiques n'ont pas de risque de virulence puisque ce sont des particules
inertes
.
Des inconvénients existent, principalement un
problème d'efficacité
: il faut au
moins 100.000 molécules d'ADN par cellule cible pour qu'une seule séquence
parvienne à pénétrer dans le noyau. A cette concentration commencent à se poser
des problèmes de toxicité. Ensuite, il faut que l'ADN soit libéré de son vecteur.
L'ADN étant une molécule polyanionique, donc négative, elle a du mal à traverser
la paroi des cellules qui est formée de molécules lipidiques négatives. Dans la
nature on assiste à une
compaction de l'ADN
par des molécules composées
d'acides aminés chargés positivement comme les
histones
, qui sont donc chargées
de
condenser
l'ADN.
Une solution élégante sera peut
-être la création de
chromosomes artificiels
humains et
déjà diverses équipes travaillent sur ce projet. Cela permettrait une meilleure expression
du gène qui serait alors contrôlé par ses propres séquences régulatrices.
7) Les maladies génétiques ophtalmologiques
Différentes pathologies sont consécutives à des dysfonctionnements génétiques; on a
ainsi répertorié
240 gènes
responsables de maladies de la vision.
Certains
glaucomes
, familiaux, sont dus à une altération du gène
GLC1A
du
chromosome
1q
, qui code pour la protéine
TIGR
(Trabecular meshwork Inducible
Glucocorticoid Response protein). On a retrouvé cette molécule dans certains
photorécepteurs où elle est nommée
MYOC
(myociline). On retrouve dans
différentes études des pressions intra
-
oculaires très élevées pour ces groupes de
patients avec une sévérité importantes des atteintes du nerf optique. On connaît une
famille de plus de 1000 personnes qui possèdent une
mutation
spécifique
Asn473Lys dans le troisi
è
me exon du g
è
ne. Des tests biologiques permettent de
adénovirus (icosahèdre à 252 capsomères)
réalisation ophtalmo.net
rétrovirus
réalisation ophtalmo.net
savoir si les sujets sont prédisposés, mais cela entraîne des problèmes de coûts et
d'éthique.
Les protéines du cristallin appelées cristallines peuvent être affectées par des
mutations et entraîner des
cataractes
, comme par exemple la cataracte polaire
antérieure due à une altération du gène 17p13.
Les opacités de la cornée appelées
dystrophies cornéennes
sont souvent en rapport
avec une mutation génétique. Ainsi on décrit le gène
BIGH3
dont les différentes
mutations (R124L, P501T ) vont être responsables d'aspects phénotypiques variés
(dystrophie de Reis
-Bücklers, dystrophie grillagée, dystrophie granulaire ).
Les
rétinopathie pigmentaires
: ces maladies associent un fond d'oeil typique avec
la présence de pigment (ostéoblastes), de vaisseaux atrophiques et une papille pâle,
à des signes cliniques typiques : héméralopie (vision quasi nulle quand vient le
soir), réduction du champ visuel qui devient en 'canon de fusil' puis cécité. Ce
groupe de maladies correspond à une grande diversité génétique. Ainsi on a mis en
évidence plus de cent gènes responsables.
Les maladies rétiniennes de l'enfant :
1.
L'amaurose congénitale de Leber :
Cette maladie de l'enfant, qui associe
une cécité à des signes ophtalmologiques constants (fond d'oeil normal,
nystagmus pendulaire ) semble recouvrir différents aspects génotypiques.
Ainsi on décrit les mutations 17p13.1 du gène
LCA1
qui rendent les
photorécepteurs incapable de revenir à l'obscurité, et les mutations du gène
RPE65
situé en 1p31, qui au contraire conduisent à une situation de
photorécepteurs toujours dans le noir. Voir l'exp
érimentation de Acland.
2.
La maladie de Stargardt
: elle associe une baisse très importante de l'acuité
visuelle vers 7
-
12 ans à des aspects variés du fond d'oeil. Le gène
ABCR
(ABC Retinal) localisé en
1p22.1
est là porteur de différentes mutations qui
vont donner des aspects phénotypiques différents. En fonction du type de
mutation (mutation faux
-sens ou mutations tronquantes) on aura des patients
qui présenteront soit un Fundus flavimaculatus, soit un Stargardt, soit une
Rétinopathie Pigmentaire. Cette étude montre qu'on ne peut pas associer un
gène à une maladie, mais plutôt une mutation d'un gène à un phénotype.
3.
Le syndrome de Usher 1A
: l'aspect du patient est typique et associe une
rétinopathie pigmentaire et une surdité. Différentes mutations génétiques sont
responsables de cet état clinique uniforme (celles des gènes US1A, US1B,
US1C, US1D, US1E). Ces gènes semblent coder pour différentes molécules
de type myosine.
Les
DMLA
(dégénérescences maculaires liées à l'âge). Il semble que plusieurs
gènes, non encore identifiés, soient responsable de ce type de maladie, sans oublier
que des facteurs de risque existent (tabac, hypercholestérolémie, soleil, iris clair).
On a pu proposer le gène
ABCR
déjà vu, comme facteurs prédisposant. Par ailleurs
il y a sans doute des gènes 'protecteurs' qui vont protéger les patients de cette
affection, comme l'allèle epsilon 4 de l'apolipoprotéine E.
8) Difficult
é
s
On se rend compte qu'on
ne peut pas associer un gène à une maladie
. On vient de voir
qu'on peut avoir une maladie qui correspond à de nombreux gènes, ou bien au contraire
qu'un seul gène peut donner différentes maladies en fonction de ses mutations ou de son
expression.
Tout ceci ne doit pas démoraliser les patients qui attendent avec angoisse les progrès de
la biologie moléculaire, mais il faut prendre conscience de la grande difficulté des études
et des complications que cela entraîne pour le diagnostic prénatal des maladies ou la
thérapie génique des pathologies.
Le diagnostic prénatal en ophtalmologie est difficile et la consultation de
conseil
génétique
permettra dans une premier temps d'étudier toute la parentèle connue.
On demandera parfois un
caryotype
(syndrome polymalformatif) et plus rarement une
étude biomoléculaire
pour mettre en évidence des anomalies génétiques. Ainsi il faudra
rechercher une délétion du chromosome 11 en cas d'
aniridie
car il y a prédisposition au
néphroblastome (voir la g
énétique de l'embryologie).
Ces tests qui font quasiment partie de la Recherche doivent être faits avec parcimonie à
cause de l'hétérogénéité génétique qui rend les conclusions délicates.
9) La réalité de la thérapie génique
Janvier 2003
Un deuxième enfant du programme de thérapie génique pour le
traitement des "bébés
-bulle", dépourvus de défenses immunitaires et obligés de
vivre en milieu stérile, a développé "très récemment" une maladie similaire à la
leucémie, a annoncé le
15 janvier 2003
l'Agence française de sécurité sanitaire des
produits de santé (
AFSSAPS
).
L'essai sur des patients souffrant du Déficit immunitaire combiné sévère (
SCID
),
une maladie mortelle, à l'hôpital
Necker
-
Enfants malades de l'Assistance
publique
-
Hôpitaux de Paris
(AP-HP), avait été
suspendu en octobre dernier, trois
ans après son démarrage, un premier enfant ayant développé des symptômes
similaires à ceux du second. Depuis, les huit patients faisaient l'objet d'une
surveillance clinique et biologique renforcée.
Dans le premier cas, la maladie s'est déclarée alors que l'enfant âgé de trois ans
avait été traité à l'âge d'un mois. Dans le deuxième, on sait seulement que l'enfant
avait aussi été traité quand il était bébé et a développé le cancer presque trois ans
plus tard.
Un traitement par chimiothérapie a été entrepris pour les deux enfants, avec "une
réponse thérapeutique satisfaisante", précise
l'AFSSAPS
dans un communiqué.
Par ailleurs, "des investigations similaires à celles réalisées pour le premier enfant
ont été immédiatement entreprises pour une meilleure compréhension de la nature
de cette complication, afin de d
é
velopper des m
é
thodes susceptibles de pr
é
venir ce