Maladies oculaires - part 5 pot
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (1.18 MB, 44 trang )
Accueil | Photothèque | Annonces | Art | Histoire | Liens | Vue |
Maladies
| Chirurgie | Homepage
Le phototraumatisme rétinien dû
aux observations des phénomènes solaires
Rev 27-09-2005
jmm
Eclipse annulaire de soleil du 3/10/2005
Une éclipse annulaire de soleil aura lieu le
3 octobre 2005
. Ce phénomène sera
observable en Europe, en Afrique et en Asie. En France, il sera visible sous forme
partielle entre 9h43 et 12h39, heures locales, selon le lieu d’observation. Le pourcentage
de la surface du disque solaire occultée par la Lune, ou degré d’obscuration, sera
maximal dans le sud-ouest (environ 83 %) et minimal dans le Nord (55%).
L’observation d’un tel événement nécessite impérativement de se protéger les yeux afin
d’éviter toute lésion oculaire.
Pour en savoir plus :
Institut de Mécaniques Célestes de Paris : informations sur ce phénomène astronomique et les
risques ophtalmiques de son observation ainsi que les éphémérides de l’éclipse (présentées en temps
universel) : />Communiqué de la Direction Générale de la Santé pour la métropole
Communiqué de la Direction Générale de la Santé pour Mayotte
Communiqué de la Direction Générale de la Santé pour la Réunion
Transit de V
é
nus du 8 juin 2004
Le 8 juin 2004, la planète Vénus est passée devant le Soleil. Ce phénomène céleste
exceptionnel a été observable dans 142 pays. En France, il a été observé entre 7h20 et
13h25, selon le lieu d’observation. L’observation d’un tel événement nécessite
impérativement de se protéger les yeux afin d’éviter toute lésion oculaire.
Lire les impératifs pour l'observation (fichier pdf): Direction G
énérale de la Santé
Voir aussi l'Ecole Supérieure d'Optique qui nous promet des images du phénomène.
Le prochain transit aura lieu le 6 juin 2012.
Eclipse de soleil du 31 mai 2003
Source : Direction Générale de la Santé. 8, avenue de Ségur 75007 Paris. Ré
daction : mai
2003
Prévention des risques ophtalmologiques
Les autorités sanitaires invitent les personnes qui souhaiteraient observer cette éclipse
dans de bonnes conditions de sécurité, à se munir de
lunettes de protection spéciales
,
destin
é
es
à
une observation directe du soleil.
Les personnes désireuses de se procurer ces lunettes de protection peuvent les trouver
chez des opticiens ou des pharmaciens.
Le 31 mai 2003, une
éclipse annulaire
de soleil a été visible au
nord de l'Europe
, au
lever du soleil. En France, cette éclipse fut visible sous forme d'
éclipse partielle dans le
nord-est du territoire national
, au nord d'une ligne joignant Caen à Annecy.
L'occultation maximale fut observée en
Alsace
pour atteindre 80% et a diminué au fur et
à mesure que l'on s'éloigne de cette région.
Cette éclipse a été maximale au lever du soleil soit le matin entre 5h30 à l'est et 5h50 à
l'ouest des régions où l'éclipse était observable. Le phénomène est resté donc
très bas
sur l'horizon
et s'est achevé lorsque le soleil a atteint une hauteur de 6° seulement. A
cette heure le rayonnement visible et infrarouge du soleil reste faible, car il doit traverser
une distance importante dans l'atmosphère, qui absorbe une part importante des
rayonnements de courte longueur d'onde et les ultraviolets, ce qui donne au soleil une
couleur rouge, partiellement voilée par la brume matinale.
En outre le phénomène ne fut observable que dans des conditions privilégiées, c'est à
dire
par temps parfaitement clair et à la condition de pouvoir observer la ligne d'horizon, c'est
à dire en pratique à partir d'un point haut en zone parfaitement dégagée. La situation est
donc différente de celle d'une éclipse plus spectaculaire survenant en milieu de journée,
comme celle du
11 août 1999
.
Les risques d'
accidents ophtalmologiques
sont plus faibles en raison de l'heure matinale
de l'éclipse, mais ne sont pas nuls, c'est pourquoi il est utile de rappeler que l'observation
directe du soleil présente des risques pour l'œil particulièrement chez les enfants.
Ces risques sont de deux natures :
- Des lésions cornéennes à type de kératite, douloureuses mais réversibles en
quelques jours. Ce risque sera pratiquement inexistant le 31 mai en raison de la
survenue très matinale de l'éclipse.
- Des lésions rétiniennes à type de brûlures rétiniennes liées à l'effet thermique du
rayonnement solaire et à un effet photochimique sur les cellules rétiniennes
particulièrement fragiles. Cet effet peut être irréversible et conduire à une altération
définitive de la vue.
Pour observer cette éclipse dans de parfaites conditions de sécurité il convient de se
munir de
lunettes spéciales de protection
, comme celles qui avaient été largement
utilisées lors de l'éclipse du 11 août 1999. Certaines personnes ont peut-être conservé les
lunettes utilisées lors de l'éclipse de 1999 ; cependant, sauf si elles ont été conservées
dans de bonnes conditions sous protection, la qualité du filtre aluminisé risque d'être
dégradée rendant leur protection aléatoire.
Il convient également de mettre en garde contre l'utilisation de moyens de protection de
fortune, comme des verres fumés, les films radiologiques ou de simples lunettes de soleil
dont la faculté de protection est insuffisante. En aucun cas l'éclipse ne doit être observée
avec des instruments d'optique (jumelles, t
é
l
é
objectif, ).
Les autorités sanitaires invitent donc les personnes qui souhaiteraient observer cette
éclipse dans de bonnes conditions de sécurité, à se munir de lunettes de protection
spéciales, destinées à une observation directe du soleil. Les personnes désireuses de se
procurer ces lunettes de protection pourront les trouver chez des opticiens ou des
pharmaciens.
Des informations sur cette éclipse et les risques ophtalmologiques liés à l'observation
directe sont disponibles sur le site Internet de l'Association astronomique de France.
Eclipse de soleil du 11 août 1999
Selon l'Institut de Veille Sanitaire, il y a eu
143
patients, sur trente millions
d'observateurs en France, qui ont présenté une atteinte rétinienne.
On note une baisse d'acuité visuelle dans 71% des cas (55% de femmes; 45% de
personnes âgées de 15 à 29 ans).
Pour
16
d'entre eux l'acuité visuelle reste inférieure à 1/20ème avec, dans
7
cas, une
atteinte bilatérale.
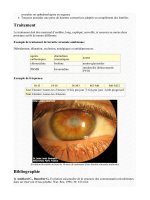
Voici un des clichés qui illustre cet héliotraumatisme rétinien : la lésion ronde et claire
située au centre de la photo correspond à la brûlure rétinienne irréversible. Cela donne
une impression de zone noire (scotome) dans le champ de vision, devant le patient.
Merci au Dr Patrice Coffe qui nous a fourni ce cliché
Pour vous
é
viter de vous br
û
ler les yeux, suivez ces conseils simples:
A noter:
• les enfants sont plus vulnérables car les milieux oculaires sont très transparents
• sur les zones où l'éclipse est partielle le risque est plus important car le soleil n'est
que partiellement caché
•
n'essayez pas de prendre des photos de l'astre
Ce qu'il FAUT faire:
Impérativement porter des
lunettes adaptées aux éclipses
solaires, comme celles ci-
dessous, portant un marquage
CE, conforme à la directive
89/686/CEE INRS n°0070-
F54501 Vandoeuvre.
Vous les trouvez chez tous les
opticiens et grandes surfaces
de France, pour environ 1 euro
la paire.
On peut également projeter
l'image du soleil, grâce à un
miroir sur le mur de la maison
d'en face, sans regarder jamais
l'astre.
Ce qu'il NE faut PAS faire:
Regarder le soleil sans protection ou avec un
système faussement protecteur
(radiographies, lunettes de soleil, cd, etc.)
Utiliser un système grossissant, car cela
augmente le risque (jumelles, lunette
astronomique, télescope)
Vous êtes sûr d'abimer votre rétine de façon
irré
versible, ce qui va entrainer une baisse de
vision définitive.
Il n'y a pas de traitement pour ce type de
lésion.
On peut être sûr qu'il y aura des inconscients
qui ne respecteront pas les avis; une seule
inconnue, leur nombre
Ce qu'est une éclipse: la lune qui passe devant le soleil et projette sur la Terre une bande
d'ombre.
De très nombreux sites web de qualité vous donnent tous les renseignements de
localisation, de durée et l'historique des éclipses:
Ciel et Espace
Observatoire de Paris
Groupe Astronomie de Spa asbl
Exploratorium: Solar Eclipse Links Page
EclipseChaser Home Page
Accueil | Photothèque | Annonces | Art | Histoire | Liens | Vue |
Maladies
| Chirurgie | Homepage |
Nous écrire
Les fibres myélinisées de la rétine
"Fibres à myéline"
Rev 14
-
07
-
2002
jmm
Définition
Il s'agit de la présence de
myéline
autour des fibres optiques rétiniennes, ce qui est
anormal
car il y a habituellement, chez l'Homme, un limitation de la myélinisation au
niveau du nerf optique. Cette
myélinisation
a commencé au niveau du
ganglion génicul
é
latéral
et s'est propagée le long du nerf optique, ou elle doit s'arrê
ter au niveau de la lame
criblée.
En revanche la myélinisation des fibres optiques de nombreux animaux est normale.
Cliché Pr André Mathis
CHU Toulouse
-
Rangueil France
Le
Dr Bernard Zalc
directeur de l'unité
INSERM U
-
495
Biologie des Interactions
Neurones/Glie (H
ôpital de la Salpétrière Paris France) nous apporte des précisions très
intéressantes:
"Le nerf optique est constitué
uniquement par les axones des cellules ganglionnaires de la
rétine (
CGR
). Tous ces axones sont myélinisés. La myélinisation débute à partir de la
papille, c'est à dire que tout le trajet axonal intra rétinien des CGR est, normalement, non
myélinisé, et la myélinisation débute dans le nerf optique au sortir du canal optique. Il
existe cependant des espèces, comme le
lapin
, chez lesquelles les axones des CGR sont
myélinisés sur tout leur trajet, y compris dans la rétine. La myélinisation est effectué
e par
les
oligodendrocytes
.
Ces cellules ne sont pas g
é
n
é
r
é
es dans le nerf optique, mais envahissent le nerf optique
à
partir de
foyers sources diencéphaliques
. Chez le
rat
et la
souris
, les précurseurs
d'oligodendrocytes pénètrent dans le nerf optique à partir du jour embryonnaire E14.5
(souris) et E16.5 (rat) à partir de la portion chiasmatique (en provenance des sites
diencéphaliques d'émergence) et migrent vers la portion rétinienne.
Ces cellules migrent le long du nerf optique et se multiplient dans le nerf optique. Chez la
souris, la myélinisation proprement dite (cad l'enroulement du prolongement
oligodendrocytaire autour de l'axone) débute au jour postnatal P6. Chez l'homme les
première fibres se myélinisent au cours du
9ème mois
, c'est à dire en fin de gestation
(c'est pourquoi le nouveau
-
né voit très mal) et se poursuit
jusque vers le 3ème
-
4ème
mois
post natal. Il est généralement admis que la
myélinisation
progresse, globalement,
selon un
gradient rétino
-
chiasmatique
. Ceci suggère que les premières cellules à avoir
pénétré dans le nerf optique sont celles qui migrent le plus loin et sont donc les premiè
res
à atteindre la portion rétinienne du nerf optique et étant les plus "anciennes" sont les
premières à myéliniser. Cependant cette règle générale souffre de nombreuses
exceptions
Comment se fait
-
il que les oligodendrocytes ne pénètrent pas dans la rétine? Une très
jolie
étude du groupe de
Mellitta Schacher
a montré qu'il existe dans la papille un
"bouchon" d'une molécule appelée
Tenascin C
, qui repousse les oligodendrocytes
(
Bartsch U, Faissner A, Trotter J, Dorries U, Bartsch S, Mohajeri H, Schachner
M.
Tenascin demarcates the boundary between the myelinated and nonmyelinated part of
retinal ganglion cell axons in the developing and adult mouse.J Neurosci. 1994 Aug;14
(8):4756
-68).
De façon intéressante, chez le
lapin
, ce bouchon de tenascin C n'existe pas, et c'est ainsi
que l'on explique que les
oligodendrocytes
poursuivent leur migration, traversent la
papille et commencent à myéliniser les axones des CGR dans leur trajet rétinien.
Cependant chez les
souris
chez lesquelles le
gène
Tenascine C a été invalidé, il n'y a pas
de modification notable de la migration des oligodendrocytes, et notamment ceux
-ci
n'entrent pas dans la rétine.
Nous venons de montrer que cela est probablement d
û au fait qu'il existe une autre
molécule, la
nétrin
-
1
, synthétisée par les
astrocytes
formant une sorte de bouchon dans
la papille qui chez la souris exerce, en post natal, la même fonction que la
tenascine C
et
prévient la migration des oligodendrocytes dans la rétine (
SPASSKY N., DE CASTRO
F., LE BRAS B., HEYDON K., QUÉ RAUD
-
LESAUX F., BLOCH
-
GALLEGO E.,
CHÉ DOTAL A., ZALC B. AND THOMAS J.
-
L.
Directional guidance of
oligodendroglial migration by class 3 semaphorins and netrin
-1. (2002) J. Neurosci.22
(14): à paraitre dans le Numéro du 15 Juillet 2002).
Compte tenu du fait que les
CGR
sont situées en superficie de la rétine et que la lumière
doit traverser toute l'épaisseur de la rétine pour atteindre les cônes et bâtonnets, j'ai
toujours pens
é
qu'il
é
tait important que les axones des CGR ne soient pas my
é
linis
é
s dans
leur trajet intrarétinien, car la gaine de myéline devrait constituer un obstable à la
pénétration de la lumière."
et il précise encore:
"Le
gradient rétino
-
chiasmatique
de myélinisation a été décrit chez la
souris
, le
rat
et
je crois aussi le
lapin
. Mais comme je l'indique c'est une situation globalement exacte qui
souffre des exceptions. Par exemple, chez la
souris
cela peut varier en fonction du
fond
génétique
et il existe des souches chez lesquelles le
gradient est chiasmato
-
rétinien
donc identique à la description à laquelle vous faites ré
ference chez l'homme. Je ne serais
donc pas surpris si chez l'homme différent cas de figure peuvent se rencontrer."
Clinique
Cette anomalie rétinienne est
sans conséquence
sur la vision, et est plutôt une curiosité
assez rare
puisqu'on ne la retrouve que chez 0,3 à 1% des patients. On aperçoit, en
examinant le fond d'oeil, une
nappe blanchâtre
qui siège habituellement
autour de la
papille
, mais peut parfois se voir à distance, au niveau des vaisseaux temporaux.
Cliché Pr André Mathis
CHU Toulouse
-
Rangueil France
Evolution
Les fibres à myéline n'évoluent pas, mais doivent être différenciées d'autres pathologies
(choriorétinite ).
On a tout de même décrit de
rares diminution
ou disparition de ces fibres en cas
d'
atrophie optique
ou de
n
é
vrite optique
.
Cliché Pr André Mathis
CHU Toulouse
-
Rangueil France
Bibliographie
Bartsch U, Faissner A, Trotter J, Dorries U, Bartsch S, Mohajeri H, Schachner M.
Tenascin demarcates the boundary between the myelinated and nonmyelinated part of
retinal ganglion cell axons in the developing and adult mouse. J Neurosci. 1994 Aug;14
(8):4756
-
68.
Chavis PS, Tabbara KF.
Demyelination of retinal myelinated nerve fibers in Behcet's
disease. Doc Ophthalmol. 1998;95(2):157
-
64.
Colello RJ, Schwab ME.
A role for oligodendrocytes in the stabilization of optic axon
numbers. J Neurosci. 1994 Nov;14(11 Pt 1):6446
-
52.
Gupta A, Khandalavala B, Bansal RK, Jain IS, Grewal SP.
Atrophy of myelinated
nerve fibers in pituitary adenoma. J Clin Neuroophthalmol. 1990 Jun;10(2):100
-
2.
Hittner HM, Antoszyk JH.
Unilateral peripapillary myelinated nerve fibers with
myopia and/or amblyopia. Arch Ophthalmol. 1987 Jul;105(7):943
-
8.
Hunter SF, Leavitt JA, Rodriguez M.
Direct observation of myelination in vivo in the
mature human central nervous system. A model for the behaviour of oligodendrocyte
progenitors and their progeny. Brain. 1997 Nov;120 ( Pt 11):2071
-
82.
Kasmann
-
Kellner B, Ruprecht KW.
Unilateral peripapillary myelinated retinal nerve
fibers associated with strabismus, amblyopia, and myopia. Am J Ophthalmol. 1998
Dec;126(6):853.
Kodama T, Hayasaka S, Setogawa T.
Myelinated retinal nerve fibers: prevalence,
location and effect on visual acuity. Ophthalmologica. 1990;200(2):77
-
83.
Lee MS, Gonzalez C.
Unilateral peripapillary myelinated retinal nerve fibers associated
with strabismus, amblyopia, and myopia. Am J Ophthalmol. 1998 Apr;125(4):554
-
6.
Lopez Sanchez E, Marin Montiel J, Frances Munoz E, Menezo Rozalen JL.
[A case
of loss of retinal myelinated nerve fibers in a chronic glaucoma] Arch Soc Esp Oftalmol.
2002 Jan;77(1):39
-
42. Spanish.
Rosen B, Barry C, Constable IJ.
Progression of myelinated retinal nerve fibers. Am J
Ophthalmol. 1999 Apr;127(4):471
-3.
Silvestri G, Sehmi K, Hamilton P.
Retinal vascular abnormalities. A rare complication
of myelinated nerve fibers? Retina. 1996;16(3):214
-8.
Teich SA.
Disappearance of myelinated retinal nerve fibers after a branch retinal artery
occlusion. Am J Ophthalmol. 1987 Jun 15;103(6):835
-7.
Tolhurst DJ, Lewis PR.
Effect of myelination on the conduction velocity of optic nerve
fibres. Ophthalmic Physiol Opt. 1992 Apr;12(2):241
-3.
Traboulsi EI, Lim JI, Pyeritz R, Goldberg HK, Haller JA.
A new syndrome of
myelinated nerve fibers, vitreoretinopathy, and skeletal malformations.
Arch Ophthalmol.
1993 Nov;111(11):1543-5.
Velasque L, Mortemousque B.
[Myelinated retinal nerve fibers. Review of the
literature] J Fr Ophtalmol. 2000 Nov;23(9):892
-6. French.
Accueil | Photothèque | Annonces | Art | Histoire | Liens | Vue |
Maladies
| Chirurgie | Homepage |
Nous écrire
Maculopathie en torpille
Torpedo maculopathy
Rev 14-03-2003
jmm
Définition
Il s'agit d'une
anomalie
maculaire
rare
qui n'a pas d'incidence sur la vision et qui est
souvent découverte par hasard.
On décrit "une
lésion ovale
caractérisée par deux parties séparées: une lésion
dépigmentée claire, et un croissant hyperpigmenté temporal." A l'angiographie "La
dépigmentation donne lieu à une transmission de la fluorescence choroïdienne. La partie
hyperpigmentée demeure hypofluorescente".
Cohen S.Y, Quentel G.
Diagnostic
angiographique des maladies rétiniennes
EMC 1997.
Aucun traitement n'est nécessaire.
Maculopathie en torpille
Bibliographie
Angioi
-
Duprez K, Maalouf T.
[Torpedo maculopathy] J Fr Ophtalmol. 2000 Feb;23
(2):200. French.
Cohen S.Y, Quentel G.
Diagnostic angiographique des maladies rétiniennes EMC 1997.
Rigotti M, Babighian S, Carcereri De Prati E, Marchini G.
Three cases of a rare
congenital abnormality of the retinal pigment epithelium: torpedo maculopathy.
Ophthalmologica. 2002 May
-Jun;216(3):226-7.
Merci Anne.
Accueil | Photothèque | Annonces | Art | Histoire | Liens | Vue |
Maladies
| Chirurgie | Homepage |
Nous écrire
Maladie de Best
Dystrophie maculaire vitelliforme
Vitelliform macular dystrophy
Rev 19
-
01
-
2003
jmm
Dystrophie de Best en "oeuf sur le plat"
Nous remercions beaucoup le Docteur Christian
Hamel,
Directeur de Recherches et
responsable de l'équipe génétique Inserm U. 254 à Montpellier France.
Définition
La maladie de
Best
(Best's disease) est une
dystrophie maculaire génétique bilatérale,
encore appelée
dystrophie vitelliforme juvénile
, qui entraîne une baisse tardive de la
vision.
Elle a été décrite la première fois en
1883
par
Adams,
puis en
1905
par Friedrich
Best
(1871
-
1965).
Clinique
On peut découvrir l'anomalie par hasard chez des enfants ou à l'occasion d'un bilan
familial. On est souvent étonné de la discordance qu'il y a entre le peu de signes
fonctionnels et l'importance des lésions anatomiques.
Il s'agit aussi parfois d'adultes qui se plaignent d'une
baisse d'acuité visuelle
. L'examen
met en évidence une tâche jaune au niveau de la macula, avec un aspect de "jaune d'oeuf
sur le plat" (egg
-yolk). Les deux yeux peuvent présenter des lésions différentes.
Ceci correspond à l'accumulation de matériel de
lipofuschine
(periodic acid-Schiff
positive) au sein de l'
épithélium pigmentaire
(
EP
) et en dessous de cet
EP
. Il semble
que l'anomalie touche d'abord l'
EP
avant d'altérer les photorécepteurs.
Il existe des formes à disques vitelliformes multiples.
Examens complémentaires
L'aspect
typique
de l'électro
-
oculogramme (
EOG
) avec un rapport d'
Arden inférieur à
1,5
fait le diagnostic.
L'EOG
peut être anormal alors qu'aucune lésion rétinienne n'est encore apparue.
Lors de l'angiographie on note d'abord une auto
-
fluorescence du disque, qui va
apparaître sombre après l'injection, avec une légère imprégnation aux temps tardifs.
L'ERG est normal et la dyschromatopsie d'axe bleu
-
jaune.
Diagnostic différentiel
On doit différencier la maladie de Best de :
la dystrophie pseudovitelliforme de l'adulte
: les troubles visuels n'apparaissent
en principe qu'après 50 ans. C'est la
normalité de l'EOG
(ou sa quasi-normalité)
qui fait la différence avec la maladie de Best. On assiste à une néovascularisation
dans 10% des cas environ, ce qui peut faire diminuer la vision. Le pronostic de
l'affection est assez bon, les sujets conservant une acuité visuelle efficace pendant
de longues ann
é
es.
Cliché Pr Mathis CHU Rangueil Toulouse France
Dystrophie pseudo-vitelliforme
la choriorétinopathie séreuse centrale (voir le chapitre) L'aspect est différent, mais
un soulèvement rétinien de la région maculaire chez le jeune peut faire discuter le
diagnostic.
Evolution
1) Au stade
prévitelliforme
, quand il n'y a pas la lésion rétinienne, la
vision est très
bonne
.
2) Au stade de
disque vitelliforme
, l'acuité visuelle diminue souvent un peu.
3) Après cette phase vitelliforme typique, on assiste à une
fragmentation
du matériel
avec apparition d'un aspect "oeuf brouillé". La
vision baisse nettement
à ce moment.
4) Les éléments de la formation vont alors sédimenter et donner une image de
pseudo
-
hypopion
avec niveau liquide.
5) L'
atrophie de la région maculaire
termine l'é
volution, qui peut parfois se compliquer
de néovascularisation sous-rétinienne, avec scotome central majeur.
Cette évolution n'est pas obligatoire, et parfois aussi les patients peuvent sauter des
é
tapes.
Cliché Pr Mathis CHU Rangueil Toulouse France
Sédimentation du matériel
Génétique
Cette maladie est
autosomique dominante
de
pénétrance variable
. On note une grande
variabilité phénotypique
.
Le gène
VMD2
(
V
itelliform
M
acular
D
ystrophy) a été localisé en
11q13
.
Petrukhin
en
1998
proposa le terme de
bestrophine
pour la protéine codée par le gène.
On ne sait pas quel est son rôle. Il a toutefois été spéculé qu'elle pourrait intervenir dans
le
recyclage de l'acide docosahexaenoïque
(un des acides gras intervenant dans la
composition des phospholipides membranaires des segments externes des
photorécepteurs), une fonction qui est assurée par l'
EP
. En effet, l'expression est
majoritaire dans l'EP et dans le testicule. Dans ce dernier organe, comme dans la rétine,
on trouve une forte proportion d'acide docosahexaeno
ï
que dans les membranes.
Maladie de Best
Traitement
Actuellement, il n'y a pas de traitement de la maladie de Best.
Bibliographie
Adams J. E.
Case showing peculiar changes in the macula. Trans. Ophthalm. Soc.U.K.,
1883, 3, 113-114.
Allikmets, R.
; Seddon, J. M.; Bernstein, P. S.; Hutchinson, A.; Atkinson, A.; Sharma, S.;
Gerrard, B.; Li, W.; Metzker, M. L.; Wadelius, C.; Caskey, C. T.; Dean, M.; Petrukhin,
K. : Evaluation of the Best disease gene in patients with age-related macular
degeneration and other maculopathies. Hum. Genet. 104: 449-453, 1999.
Best, F.
: Ueber eine hereditaere Maculaaffektion. Z. Augenheilk. 13: 199-212, 1905.
Brecher, R.;
Bird, A. C. : Adult vitelliform macular dystrophy. Eye 4: 210-215, 1990.
Deutman, A. F.
: Electro-oculography in families with vitelliform dystrophy of the
fovea: detection of the carrier state. Arch. Ophthal. 81: 305-316, 1969.
Forsman, K.; Graff, C.; Nordstrom, S.; Johansson, K.; Westermark, E.; Lundgren,
E.; Gustavson, K H.; Wadelius, C.; Holmgren, G.
: The gene for Best's macular
dystrophy is located at 11q13 in a Swedish family. Clin. Genet. 42: 156-159, 1992.
Gomez A, Cedano J, Oliva B, Pinol J, Querol E.
The gene causing the Best's macular
dystrophy (BMD) encodes a putative ion exchanger. DNA Seq. 2001 Dec;12(5-6):431-5.
Goodstadt, L.
; Ponting, C. P. : Sequence variation and disease in the wake of the draft
human genome. Hum. Molec. Genet. 10: 2209
-
2214, 2001.
Graff, C.; Eriksson, A.; Forsman, K.; Sandgren, O.; Holmgren, G.; Wadelius, C.
:
Refined genetic localization of the Best disease gene in 11q13 and physical mapping of
linked markers on radiation hybrids. Hum. Genet. 101: 263-270, 1997.
Hamel CP, Griffoin JM, Bazalgette C, Lasquellec L, Duval PA, Bareil C, Beaufrere
L, Bonnet S, Eliaou C, Marlhens F, Schmitt-Bernard CF, Tuffery S, Claustres M,
Arnaud B.
Molecular genetics of pigmentary retinopathies: identification of mutations in
CHM, RDS, RHO, RPE65, USH2A and XLRS1 genes. J Fr Ophtalmol. 2000 Dec;23
(10):985-95.
Jung, E. E.
: Ueber eine Sippe mit angeborener Maculadegeneration. Giessen: Seibert
(pub.) 1936.
Kramer, F.; White, K.; Pauleikhoff, D.; Gehrig, A.; Passmore, L.; Rivera, A.;
Rudolph, G.; Kellner, U.; Andrassi, M.; Lorenz, B.; Rohrschneider, K.;
Blankenagel, A.; Jurklies, B.; Schilling, H.; Schutt, F.; Holz, F. G.; Weber, B. H. F.
:
Mutations in the VMD2 gene are associated with juvenile-onset vitelliform macular
dystrophy (Best disease) and adult vitelliform macular dystrophy but not age-related
macular degeneration. Europ. J. Hum. Genet. 8: 286-292, 2000.
Marchant D, Gogat K, Boutboul S, Pequignot M, Sternberg C, Dureau P, Roche O,
Uteza Y, Hache JC, Puech B, Puech V, Dumur V, Mouillon M, Munier FL,
Schorderet DF, Marsac C, Dufier JL, Abitbol
M.Identification of novel VMD2 gene
mutations in patients with best vitelliform macular dystrophy. Hum Mutat. 2001 Mar;17
(3):235.
Musarella MA.
Molecular genetics of macular degeneration. Doc Ophthalmol. 2001
May;102(3):165-77. Revie
Nordstrom, S. : Epidemiological studies of hereditary macular degeneration (Best's
disease) in Swedish and Swedish-American populations.In: Eriksson, A. W.;
Forsius, H. R.; Nevanlinna, H. R.; Workman, P. L.; Norio, R. K.
: Population
Structure and Genetic Disorders. New York: Academic Press (pub.) 1980. Pp. 431-443.
O'Gorman, S.; Flaherty, W. A.; Fishman, G. A.; Berson, E. L.
: Histopathologic
findings in Best's vitelliform macular dystrophy. Arch. Ophthal. 106: 1261-1268, 1988.
Petrukhin, K.; Koisti, M. J.; Bakall, B.; Li, W.; Xie, G.; Marknell, T.; Sandgren, O.;
Forsman, K.; Holmgren, G.; Andreasson, S.; Vujic, M.; Bergen, A. A. B.; McGarty-
Dugan, V.; Figueroa, D.; Austin, C. P.; Metzker, M. L.; Caskey, C. T.; Wadelius, C.
:
Identification of the gene responsible for Best macular dystrophy. Nature Genet. 19:
241-247, 1998.
Scholl HP, Schuster AM, Vonthein R, Zrenner E.
Mapping of retinal function in Best
macular dystrophy using multifocal electroretinography. Vision Res. 2002 Apr;42
(8):1053-61.
Tavsanli BC, Pappu KS, Mehta SQ, Mardon G.
Dbest1, a Drosophila homolog of
human Bestrophin, is not required for viability or photoreceptor integrity. Genesis. 2001
Nov;31(3):130
-6.
Weber, B. H. F.; Walker, D.; Muller, B.; Mar, L.
: Best's vitelliform dystrophy
(VMD2) maps between D11S903 and PYGM: no evidence for locus heterogeneity.
Genomics 20: 267-274, 1994.
White, K.; Marquardt, A.; Weber, B. H. F.
: VMD2 mutations in vitelliform macular
dystrophy (Best disease) and other maculopathies. Hum. Mutat. 15: 301-308, 2000.
Sites web
Online Mendelian Inheritance in Man
Accueil | Photothèque | Annonces | Art | Histoire | Liens | Vue |
Maladies
| Chirurgie | Homepage |
Nous écrire
Maladie de Bietti
Dystrophie cristallline de Bietti
Bietti's crystalline dystrophy (BCD)
Rev 10
-
09
-
2002
jmm
Définition
La maladie de Bietti
est une
maladie rare
qui peut être classée dans les
rétinopathies
pigmentaires
et qui est surtout décrite en
Chine
.
Sa transmission est
autosomique récessive
.
Cette pathologie associe:
une
rétinopathie cristalline
toujours présente
parfois une
dystrophie cornéenne
ressemblant à la
dystrophie de Schnyder
.
C'est en
1937
que
Bietti
décrivit cette association chez trois patients.
Clinique
Les premiers signes apparaissent habituellement entre 20 et 40 ans, et associent une
baisse de vision
et une
héméralopie
(diminution de la vision crépusculaire). On assiste
progressivement à un
rétrécissement du champ visuel
et parfois à une
cécité
vers 50 ou
60 ans.
Les
dépôts cornéens
ont la forme de
cristaux jaunâtres
, et sont localisés
prè
s du limbe
cornéen
, dans les couches superficielles de la cornée. Ces éléments sont des
complexes
lipidiques
que l'on retrouve dans la
rétine
, la
cornée
et les
lymphocytes
circulants, ce
qui semble correspondre à un trouble du métabolisme lipidique.
La
rétinopathie cristalline
est associés à une
sclérose
des vaisseaux choroïdiens. On
décrit une atrophie progressive de la rétine, avec diminution du nombre d'inclusions.
L'angiographie fluorescéïnique montre bien l'atrophie de la chorio
-capillaire, au bout de
quelques années d'évolution.
On sait que la localisation du gène est en
4q35
-
4qtel
mais le gène responsable n'a pas
encore
é
t
é
d
é
couvert. La d
é
couverte de ce g
è
ne devrait permettre de pr
é
ciser les causes
de ce
dysfonctionnement métabolique des acides gras
.
Maladie de Bietti
Diagnostic différentiel
Fundus albipunctatus
Rétinite ponctuée albescente
Drusens
Oxalose
Cystinose
Syndrome de Sjö gren
-
Larson
Rétinopathie du tamoxifène
Site web
Online Mendelian Inheritance In Man
Bibliographie
Bietti G
Ueber familiaeres vorkommen von "retinitis punctata albescens" (verbunden mit
"dystrophia marginalis cristallinea corneae"), glitzern des glaskoerpers und anderen
degenerativen augenveraenderungen. Klin Mbl Augenheilk 99:737
-
757, 1937.
Bietti, G. B.
: Su alcune forme atipiche o rare di degenerazione retinica. Boll. Oculist.
16: 1159
-
1239, 1937.
Jiao X, Munier FL, Iwata F, Hayakawa M, Kanai A, Lee J, Schorderet DF, Chen
MS, Kaiser
-
Kupfer M, Hejtmancik JF.
Genetic linkage of Bietti crystallin
corneoretinal dystrophy to chromosome 4q35. Am J Hum Genet. 2000 Nov;67(5):1309
-
13.
Bagolini, B.; Ioli
-
Spada, G.
Bietti's tapetoretinal degeneration with marginal corneal
dystrophy. Am. J. Ophthal. 65: 53
-
60, 1968.
Grizzard, W. S.; Deutman, A. F.; Nijhuis, F.; Aan de Kerk, A.
Crystalline
retinopathy. Am. J. Ophthal. 86: 81
-
88, 1978.
Jurklies B, Jurklies C, Schmidt U, Wessing A, Bornfeld N.
[Corneoretinal dystrophy
(Bietti)
Long
-
term course of one patient over a period of 30 years, and interindividual
variability of clinical and electrophysiological findings in two patients] Klin Monatsbl
Augenheilkd. 2001 Aug;218(8):562
-9. German.
Kaiser
-
Kupfer MI, Chan CC, Markello TC, Crawford MA, Caruso RC, Csaky KG,
Guo J, Gahl WA
Clinical biochemical and pathologic correlations in Bietti's crystalline
dystrophy. Am J Ophthalmol 1994 118:569582
Lee J, Jiao X, Hejtmancik JF, Kaiser
-
Kupfer M, Chader GJ
Identification, isolation,
and characterization of a 32-kDa fatty acid-
binding protein missing from lymphocytes in
humans with Bietti crystalline dystrophy (BCD). 1998 Mol Genet Metab 65:143154
Richards BW, Brodstein DE, Nussbaum JJ, Ferencz JR, Maeda K, Weiss L
)
Autosomal dominant crystalline dystrophy. 1991 Ophthalmology 98:658665
Usui T, Tanimoto N, Takagi M, Hasegawa S, Abe H.
Rod and cone a
-
waves in three
cases of Bietti crystalline chorioretinal dystrophy. Am J Ophthalmol. 2001 Sep;132
(3):395
-402.
Weinberg DV, Sieving PA, Bingham EL, Jampol LM, Mets MB.
Bietti crystalline
retinopathy and juvenile retinoschisis in a family with a novel RS1 mutation. Arch
Ophthalmol. 2001 Nov;119(11):1719
-21.
Welch, R. B.
Bietti's tapetoretinal degeneration with marginal corneal dystrophy:
crystalline retinopathy. Trans. Am. Ophthal. Soc. 75: 164
-179, 1977.
Wilson DJ, Weleber RG, Klein ML, Welch RB, Green WR
Bietti's crystalline
dystrophy: a clinicopathologic correlative study. 1989 Arch Ophthalmol 107:213221
Maladies
| Chirurgie | Homepage |
Nous écrire
Maladie de Coats
Rev 03-11-07
jmm
Généralités
Il s'agit d'une maladie qui atteint préférentiellement les garçons (75% des cas) et que l'on
découvre souvent avant l'âge de dix ans, souvent autour de 5 ans. Elle se caractérise par
des anomalies (télangiectasies) des capillaires rétiniens, ce qui est responsable d'une
exsudation qui va faire baisser la vision, habituellement de façon unilatérale (95% des
cas). Elle a été décrite par Coats en 1908.
Maladie de Coats Cliché Dr Jean
-
Michel Muratet
Clinique