Maladies oculaires - part 7 potx
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (1.54 MB, 44 trang )
A partir du 7ème mois, débute la myélinisation partant du cerveau vers la lame criblée. Il
existe des anomalies par excès et par défaut.
Hypothèse embryologique
Pour PEDLER l'anomalie serait causée par un incomplet développement de la sclère
entrainant un déplacenient postérieur de la sclère responsable à son tour d'un
déplacement postérieur de la tête du nerf optique et de la lame criblée aidée par la
pression intra
-oculaire.
Si à l'origine, on admet un défaut de la paroi sclérale, il peut s'agir d'un événement tardif
dans la vie prénatale survenant après la fermeture de la fente embryonnaire. La cause
semble donc être un défaut de maturation de la sclérotique péripapillaire.
Evolution
La grande complication est le décollement de rétine.
Il ne faudra pas confondre cette anomalie avec une tumeur de la rétine, un
rétinoblastome.
Traitement
Il n'y a pas de traitement de cette anomalie de formation oculaire; on s'attachera à la
surveillance des anomalies associées et éventuellement leur traitement si cela est
possible.
Accueil | Photothèque | Annonces | Art | Histoire | Liens | Vue |
Maladies
| Chirurgie | Homepage |
Nous écrire
Néovaisseaux choroïdiens idiopathiques du
jeune
Idiopathic choroidal neovascularization CNV
Rev 01-05-2003
jmm
Définition
Il s'agit de la survenue brutale de
néovaisseaux choroïdiens
chez un sujet
jeune
, parfois d'une
vingtaine d'années. Cette pathologie
rare
est une
urgence ophtalmologique
et doit bénéficier d'un
traitement rapide par
laser
.
Clinique
Le patient de moins de 50 ans se plaint de
métamorphopsies
(déformation des images) ou bien de
baisse de vision
unilatérale, survenue récemment.
L'examen met en évidence une acuité plus ou moins conservée, et une lésion maculaire ou
paramaculaire
(décollement séreux)
, parfois
hémorragique
.
Une
angiographie
en urgence montrera un foyer de
néovaisseaux
, avec une
hyperfluorescence
précoce et localisée, augmentant rapidement tout au long de la séquence angiographique, et
aboutissant à une
diffusion
large du colorant aux temps tardifs.
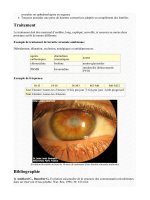
Néovaisseaux choroïdiens du sujet jeune
Cliché en lumière verte et en lumière bleue
Dr Jauzac Clinique St Nicolas Toulouse France
Hotspot apparaissant dès le temps choroïdien
Evolution
Sans traitement on assisterait à une altération définitive de la vision de l'oeil atteint. Grâce à une
photocoagulation laser
conventionnelle en urgence, la lésion est détruite, ce qui est objectivé par
l'angiographie ci-dessous. Un
scotome
persistera mais sera limité au territoire de la
photocoagulation.
Cicatrice après laser
Pr André Mathis CHU Rangueil-Toulouse France
Une
surveillance régulière
sera réalisée, mais il est très fréquent que cet épisode soit unique, sans
que l'on sache quelle est la cause de cette maladie étrange mais sévère. Cohen retrouve 17%
d'étiologies indéterminées dans une étude rétrospective. Les autres étiologies étaient la myopie forte
pour 62%, la pseudo-histoplasmose présumée pour 12% des cas, les stries angioïdes
pour 5% des cas
et des causes diverses pour 4% des cas.
Bibliographie
Bottoni FG, Deutman AF.
Idiopathic sub-retinal neovascular membranes in the macula
(hemorrhagic macular choroidopathy of young adults). Clinical report and effectiveness of laser
treatment. Doc Ophthalmol. 1986;64(3):311-43.
Cohen SY, Laroche A, Leguen Y, Soubrane G, Coscas GJ.
Etiology of choroidal
neovascularization in young patients. Ophthalmology. 1996 Aug;103(8):1241-4.
Cohen SY, Quentel G.
Diagnostic angiographique des maladies rétiniennes Encyclopédie Médico-
Chirurgicale Elsevier1997
Ho AC, Yannuzzi LA, Pisicano K, DeRosa J.
The natural history of idiopathic subfoveal choroidal
neovascularization. Ophthalmology. 1995 May;102(5):782-9.
Derosa JT, Yannuzzi LA, Marmor M, Fotino M, Sorenson JA, Spaide RF.
Risk factors for
choroidal neovascularization in young patients: a case-control study. Doc Ophthalmol. 1995-96;91
(3):207-22.
Accueil | Photothèque | Annonces | Art | Histoire | Liens | Vue |
Maladies
| Chirurgie | Homepage |
Nous écrire
Neuropathie optique héréditaire de Leber
Leber's hereditary optic neuropathy LHON
Theodor Leber
The history of ophthalmology vol 11
Rev 13-06-2004
jmm
Définitions
L'ophtalmologiste allemand Theodor
Leber
(1840
-
1917) décrit cette maladie à
la fin des
années 1800 et lui reconnut son caractère de
neuropathie optique familliale
. Les
récentes études ont bien montré sa
transmission maternelle
et l'atteinte préférentielle
des
garçons
.
La prévalence est d'environ 1 cas pour 55 000 habitants (orphanet
)
Transmission
La Neuropathie optique héréditaire de Leber est due à des mutations de l'
ADN
mitochondrial maternel
du patient, cet ADN venant exclusivement de sa mère à cause
de l'absence de mitochondries dans les spermatozoïdes paternels. On en trouve en
revanche dans les ovules f
é
minins.
La transmission n'est donc pas mendélienne.
On a constaté une
pénétrance variable
de la pathologie, peut-être en rapport avec
l'imprégnation androgénique et la consommation tabagique. Différentes auteurs ont dé
crit
18 mutations différentes qui peuvent être isolées ou associées entre elles.
Quelques cas isolés ont tout de même été décrits.
Clinique
L'âge moyen est de 27 à 34 ans, bien qu'on ait décrit des extrêmes entre 1 et 70 ans. Tout
commence par un perte de la vision centrale, un scotome, sans aucune douleur.
L'évolution de la maladie peut se faire soit vers la perte progressive de la vision en
parfois deux ans, soit vers une cécité brutale ou vers une amélioration spontanée. Ainsi
l'atteinte de la paire de nucléotides
14484
s'accompagne d'amélioration dans 37% des cas
(au bout de 16 mois), alors que la mutation de la paire de nucléotides
11778
s'associe
généralement à une cécité.
Une description précise de ces mutations est présente sur
O
nline
M
endelian
I
nheritance
in
M
an (OMIM).
L'
atteinte bilatérale
est la règle avec un décalage moyen de deux mois entre les deux
côtés.
L'examen met en évidence des télangiectasies péripapillaires, une microangiopathie, un
pseudo
-
oedème et des tortuosités vasculaires. Puis apparaît une atrophie optique.
Maladie de Leber
Cliché Pr André Mathis CHU Rangueil
-
Toulouse France
L'angiographie ne montre pas de diffusion du colorant.
Dans les cas sporadiques
, on fait appel à la technique de
PCR
(
P
olymerase
C
hain
R
eaction) pour faire le
diagnostic
. On prélève 10 ml de sang sur tube EDTA pour
étudier l'ADN mitochondrial (ADNmt) à partir des leucocytes. La recherche d'une
mutation au nucléotide
11778
est réalisé par amplification PCR entre deux amorces
nucléotidiques (nt 11720
-11740 et nt 11839-11820) encadrant la mutation. Le
fragment amplifié est soumis à une digestion par l'enzyme de restriction SfaNI qui
clive la séquence normale d'ADNmt au nt 11787, puis migre sur un gel d'agarose
0,7%.
Chez un
patient sain
la digestion par
SfaNI
de l'ADN amplifié donne deux
fragments de
67
et
52
paires de base (pb).
Chez le
patient malade
le fragment
119pb
n'est pas clivé, ce qui montre que le site
de coupure de
SfaNI
a disparu, éliminé par la présence de la mutation.
La
mutation 11778
entraine le remplacement de la guanine par l'adénine en
position 11778. Ceci provoque l'insertion d'histidine à la place de l'arginine sur le
site du 340ème acide aminé de l'unité ND4, ce qui entraîne son
dysfonctionnnement. La mutation est présente chez la femme qui va la transmettre
à
toute sa descendance. Mais cette transmission d'ADN muté et normal se fait de
façon asymétrique au cours de la méiose. Les proportions seront différentes en
fonction des générations. Cette présence de 2 types d'ADN est appelée
"
hétéroplasmie
".
Le test de
PCR
peut rester
négatif (50% des cas)
. On utilisera alors une nouvelle
enzyme de restriction nommée
Mae III
.
Il peut s'agir d'une autre mutation que 11778, comme
4917
(36% des Leber né
gatifs
11778) et
13708
(43% des Leber négatifs 11778).
Pathologies associées
On constate parfois des troubles de la conduction cardiaque, syndromes de Wolff
-
Parkinson-White et Lown-Ganong-Levine ou QT long.
De rares troubles neurologiques ont été décrits.
Biochimie
La mutation entraîne un
mauvais fonctionnement de la chaîne respiratoire des cellules
de l'organisme, située au niveau des mitochondries.
L'ADN mitochondrial code en effet pour 13 des 67 peptides de la chaine respiratoire
mitochondriale.
Il y a une
d
é
ficience
au niveau des polypeptides du Complexe I, notamment au niveau
des sous
-
unités de ND1 à ND6 (ND: NADH déshydrogénase) au rôle fondamental, et
des sous
-
unités des complexes III, IV et V. L'enzyme
oxydoréductase NADH
-
Coenzyme Q
est abaissée de 80% dans de nombreux cas.
Traitement
Aucun traitement n'existe. On espère qu'un jour on pourra utiliser la
thérapie génique
à
un stade précoce, avant l'atrophie optique définitive.
Attention aux confusions
Il ne faut pas confondre cette
neuropathie optique de Leber
avec les
anévrysmes
miliaires de Leber
(appelés aussi Télangiectasie rétinienne congénitale) qui
correspondent à une forme de la maladie de Coats
.
Il ne faut pas non plus la confondre avec l'
amaurose congénitale de Leber
décrite
en 1869 par Leber et qui associe un fond d'oeil normal à un réflexe oculo
-digital,
une photophobie et un
nystagmus
. Ce sont des enfants qui sont très tôt malvoyants
et dont le tracé électrorétinographique est très altéré en photopique et scotopique,
souvent éteint.
Le fond d'oeil reste normal dans l'enfance et évolue ensuite vers une
rétinopathie
pigmentaire
typique avec des ostéoblastes et une atrophie optique. Sur le plan
général on peut assister à l'association avec un syndrome cérébro
-
hépato
-
rénal
(Zellweger) ou des anomalies neurologiques graves.
85% des patients sont de sexe
mâle
et la transmission génétique est généralement
autosomique récessive
. Trois gènes ont pour l'instant été identifiés. Aucun
traitement n'existe.
Il ne faut pas non plus confondre avec la
neurorétinite stellaire idiopathique de
Leber
. Il s'agit d'un adulte jeune qui présente un oedème papillaire souvent
bilatéral, un décollement séreux péripapillaire et des exsudats maculaires radiaires.
Sans traitement on assiste à une amélioration progressive en six à douze semaines,
mais il peut persister une certaine baisse de la vision.
Bibliographie
Leber, T. :
Ueber hereditaere und congenital angelegte Sehnervenleiden Graefes Arch.
Ophthal. 17: 249
-
291, 1871.
Adams, J. H.; Blackwood, W.; Wilson, J. :
Further clinical and pathological
observations on Leber's optic atrophy. Brain 89: 15
-
26, 1966.
Brown, M. D.; Lott, M. T.; Voljavec, A. S.;
Torroni, A.; Wallace, D. C. :
Mitochondrial DNA cytochrome b mutations associated with Leber's hereditary optic
neuropathy and evidence for deleterious interactions between mutations. (Abstract) Am.
J. Hum. Genet. 49 (suppl.): 973, 1991.
Brown, M. D.; Voljavec, A. S.; Lott, M. T.; MacDonald, I.; Wallace, D. C. :
Leber's
hereditary optic neuropathy; a model for mitochondrial neurodegenerative diseases.
FASEB J. 6: 2791
-
2799, 1992.
Morlet, C. :
Hereditary optic atrophy as a possible menace to the community. Med. J.
Aust. 2: 499
-502, 1921.
Newman, N. J.; Wallace, D. C. :
Mitochondria and Leber's hereditary optic neuropathy.
Am. J. Ophthal. 109: 726730, 1990.
Oostra, R. J.; Bolhuis, P. A.; Wijburg, F. A.; Zorn
-
Ende, G.; Bleeker
-
Wagemakers, E. M. :
Leber's hereditary optic neuropathy: correlations between
mitochondrial genotype and visual outcome. J. Med. Genet. 31: 280
-
286, 1994.
Pagot V., Malecaze F., Rotig A., Simorre V., Maillard P., Mathis A., Munnich A.
,
Neuropathie optique de Leber: nouvelles perspectives diagnostiques. Journal Fran
çais
d'Ophtalmologie, 1992, vol.15, num 1, 19
-
23.
Accueil | Photothèque | Annonces | Art | Histoire | Liens | Vue |
Maladies
| Chirurgie | Homepage |
Nous écrire
Oedème Maculaire Cystoïde (OMC)
Cystoid macular edema
Rev 05
-
08
-
2002
jmm
Généralités
L'
oedème maculaire cystoïde
(
OMC
) est une affection rétinienne assez fré
quente, et qui
entraîne une
baisse de la vision
. En fonction de son étiologie, on assistera à une
disparition
de cet oedème ou bien, au contraire, à une
persistance
des lésions.
L'OMC correspond à la formation de cavités (
logettes
) au sein de la
couche rétinienne
plexiforme externe
(couche des fibres de Henlé), et/ou dans la
couche granuleuse
interne
. Ces logettes sont disposées en rayon de roue, avec parfois une logette centrale.
Sa fréquence a tout de même diminué depuis les progrès de la chirurgie de la cataracte,
grâce à la phacoémulsification et aux traitements pré
-
opératoires.
Clinique
Le patient se plaint d'une
baisse de la vision
, et parfois de
métamorphopsies
(les lignes
droites deviennent ondulées) ou de
scotome central
(quand il lit il ne voit pas toutes les
lettres du mot qu'il fixe). Ces signes peuvent être uni ou bilatéraux.
L'examen de la rétine à la lampe à fente met en évidence une ligne de profil antérieur
convexe, et on peut parfois discerner les logettes maculaires.
Examens complémentaires
L'examen complémentaire décisif est l'
angiographie fluorescéinique du fond d'oeil
, qui
montre une accumulation du colorant dans les logettes. Si elle existe, la logette centrale
est la dernière à apparaître, souvent à 10 ou 15 mn de l'injection de fluorescéine.
Clichés Dr Patrice Déglise
Clinique du Parc Toulouse France
Etiologies
Elles sont très nombreuses. Les principales sont:
la rétinopathie diabétique,
l'occlusion de la veine centrale de la rétine,
le syndrome d'Irvine
-
Gass après chirurgie de la cataracte (surtout autrefois, après
les extractions intracapsulaires du cristallin),
les membranes épirétiniennes,
toutes les pathologies vasculaires (maladie de Coats, télangiectasies ),
les maladies dégénératives (dmla, dystrophies rétiniennes, birdshot ),
les inflammations (uvéites postérieures, pars planites ).
Diagnostic différentiel
C'est le rétinoschisis juvénile lié à l'X, évoqué dans un autre chapitre. En principe la
différence se fait sur l'examen clinique (pas de rétinoschisis ici), les circonstances de
survenue (diabète, post
-
chirurgical).
Evolution
Elle peut se faire, au bout de quelques mois,
vers la
guérison
sans séquelle ou avec
diminution de l'acuité visuelle
,
vers une
dégénérescence
maculaire cystoïde avec une vision qui reste abaissée,
vers un
trou maculaire
avec un scotome central définitif.
Traitement
Il faudra
traiter la cause
quand cela est possible (diabète, uvéite) et/ou associer un
traitement
avec acétazolamide (Diamox®), et anti-inflammatoires locaux non-
stéroïdiens ou stéroïdiens.
Bibliographie
Bhagat N, Von Hagen S, Zarbin MA.
Perimetric sensitivity and retinal thickness in
eyes with macular edema resulting from branch retinal vein occlusion. Am J Ophthalmol.
2002 Mar;133(3):428
-
9.
Fine IH, Packer M, Hoffman RS.
Prevention of posterior segment complications of
phacoemulsification. Ophthalmol Clin North Am. 2001 Dec;14(4):581
-
93.
Furuichi M, Chiba T, Abe K, Kogure S, Iijima H, Tsukahara S, Kashiwagi K.
Cystoid macular edema associated with topical latanoprost in glaucomatous eyes with a
normally functioning blood
-
ocular barrier. J Glaucoma. 2001 Jun;10(3):233
-
6.
Haritoglou C, Gass CA, Schaumberger M, Ehrt O, Gandorfer A, Kampik A.
Macular changes after peeling of the internal limiting membrane in macular hole surgery.
Am J Ophthalmol. 2001 Sep;132(3):363
-
8.
Ladd BS, Solomon SD, Bressler NM, Bressler SB.
Photodynamic therapy with
verteporfin for choroidal neovascularization in patients with diabetic retinopathy. Am J
Ophthalmol. 2001 Nov;132(5):659
-
67.
Mackay CJ.
Tomographic assessment of vitreous surgery for diabetic macular edema.
Am J Ophthalmol. 2002 Jan;133(1):166.
Martidis A, Duker JS, Puliafito CA
. Intravitreal triamcinolone for refractory cystoid
macular edema secondary to birdshot retinochoroidopathy. Arch Ophthalmol. 2001
Sep;119(9):1380
-
3.
Nagpal M, Nagpal K, Nagpal PN.
Postcataract cystoid macular edema. Ophthalmol
Clin North Am. 2001 Dec;14(4):651
-
9, ix.
Peyman GA, Canakis C, Livir
-
Rallatos C, Conway MD.
The effect of internal
limiting membrane peeling on chronic recalcitrant pseudophakic cystoid macular edema:
a report of two cases. Am J Ophthalmol. 2002 Apr;133(4):571
-2.
Sanchez
-
Tocino H, Alvarez
-
Vidal A, Maldonado MJ, Moreno
-
Montanes J,
Garcia
-
Layana A.
Retinal thickness study with optical coherence tomography in
patients with diabetes. Invest Ophthalmol Vis Sci. 2002 May;43(5):1588
-
94.
Sato Y, Lee Z, Shimada H.
Vitrectomy for diabetic cystoid macular edema. Jpn J
Ophthalmol. 2002 May
-
Jun;46(3):315
-
22.
Singh AD, Shields CL, Shields JA, Goldfeder A.
Bilateral exudative retinopathy as the
initial manifestation of retinitis pigmentosa. Br J Ophthalmol. 2002 Jan;86(1):116
-
7.
Smith SC.
Nonproliferative diabetic retinopathy and macular edema. Insight. 1999 Apr-
Jun;24(2):59
-
62; quiz 63
-
4.
Stanga PE, Downes SM, Ahuja RM, Chong NH, Antcliff R, Reck AC, Bird AC.
Comparison of optical coherence tomography and fluorescein angiography in assessing
macular edema in retinal dystrophies: preliminary results. Int Ophthalmol. 2001;23(4
-
6):321
-
5.
Stavrou P, Baltatzis S, Letko E, Samson CM, Christen W, Foster CS.
Pars plana
vitrectomy in patients with intermediate uveitis. Ocul Immunol Inflamm. 2001 Sep;9
(3):141
-
51.
Wand M, Shields BM.
Cystoid macular edema in the era of ocular hypotensive lipids.
Am J Ophthalmol. 2002 Mar;133(3):393
-
7.
Wand M, Gaudio AR, Shields MB.
Latanoprost and cystoid macular edema in high
-
risk aphakic or pseudophakic eyes. J Cataract Refract Surg. 2001 Sep;27(9):1397
-
401.
Yamamoto T, Akabane N, Takeuchi S.
Vitrectomy for diabetic macular edema: the
role of posterior vitreous detachment and epimacular membrane. Am J Ophthalmol. 2001
Sep;132(3):369
-
77.
Zhang H, Xia Y.
[Analysis of visual prognosis and correlative factors in retinal vein
occlusion] Chung Hua Yen Ko Tsa Chih. 2002 Feb;38(2):98
-
102. Chinese.
Accueil | Photothèque | Annonces | Art | Histoire | Liens | Vue |
Maladies
| Chirurgie | Homepage |
Nous écrire
Occlusion de la Veine Centrale de la Rétine
OVCR
&
occlusion de branches
Central Retinal Vein Occlusion CRVO
Rev 27
-
09
-
2002
jmm
Occlusion de la Veine Centrale de la Rétine gauche
Définition
L'
o
cclusion de la
v
eine
c
entrale de la
r
étine (
OVCR
) est une pathologie
très fréquente
et souvent source de
mauvaise vision ultérieure
, parfois de perte fonctionnelle de l'oeil.
Le réseau veineux rétinien
fait partie d'un "
circuit vasculaire clos
" (Gass) et son
obstruction va retentir aussitôt sur l'ensemble de la circulation rétinienne.
Il est très important de surveiller ces patients car de
graves complications
peuvent
survenir (glaucome néovasculaire) qui peuvent être évitées par un traitement
laser
approprié. Il est très fréquent que l'on ne retrouve pas d'étiologie, malgré des bilans
cardio
-
vasculaires complets. Cela montre bien notre peu de connaissances de cette
pathologie sévère. La fréquence des
glaucomes associés
nécessite aussi un contrôle
tonométrique régulier des patients.
A l'avenir on esp
è
re mieux analyser la crase sanguine et les ph
é
nom
è
nes de la
coagulation, pour mieux traiter les ovcr.
Clinique
Dès
1878
,
Julius Michel
décrivait les anomalies rétiniennes comme une
thrombose
de
la veine centrale de la rétine, terme qu'on a abandonné pour celui d'
occlusion
qui ne
préjuge pas de la cause de l'obstruction vasculaire.
Il s'agit typiquement d'un patient de plus de 60 ans, qui présente une
baisse de vision
unilatérale
, assez rapide, qui va d'un brouillard léger à la perte totale de la vision. L'oeil
est blanc et non douloureux. On ne remarque aucun autre signe fonctionnel.
L'examen clinique du fond d'oeil met en évidence une tétrade:
des dilatations veineuses, les veines sont sombres et tortueuses
un oedème papillo-rétinien, dû à la stase veineuse
des hémorragies rétiniennes, souvent en flammèches, suivant la direction des fibres
optiques
des nodules cotonneux, correspondant à la souffrance rétinienne
L'examen de l'oeil adelphe met souvent en évidence une artériosclérose, surtout chez le
sujet de plus de 60 ans.
Schématiquement, on décrit
quatre formes cliniques d'OVCR
:
La forme oedémateuse
, la plus fréquente (60% des cas). C'est l'oedème qui domine le
tableau clinique, la papille est hyperhémiée et oedémateuse, les nodules cotonneux sont
rares, les hémorragies sont visibles jusqu'à la périphérie. On décrit parfois un oed
ème
cystoïde maculaire. L'évolution de l'acuité visuelle est généralement assez bonne. On a
remarqué que
20% des formes
évoluent vers la forme ischémique.
La forme ischémique
, la plus redoutée (20% des cas). L'oedéme ré
tinien est assez faible,
les artères sont grêles et rigides, les hémorragies profondes. Le signe capital est la
présence de zones rétiniennes ischémiques caractérisées par des nodules dysoriques
nombreux et confluents. Le lit capillaire n'est pas perfusé. Cette ischémie va entraîner la
production locale de facteurs angiogéniques, avec apparition de né
ovaisseaux redoutables
car responsables sans traitement de la perte de l'oeil par glaucome néovasculaire,
hémorragies du vitré, ou soulèvement rétinien avec prolifération fibreuse. La
maculopathie ischémique qui peut exister s'accompagne d'une vison très abaissée et est
d'un pronostic sombre. Le devenir de cette forme est souvent mauvais et l'acuité visuelle
ne s'améliore pas.
La forme mixte oedémato
-
ischémique
. Elle associe les signes des deux précédentes et
peut évoluer vers une forme ischémique grave.
La forme régressive du sujet jeune
. Il s'agit de patients nettement plus
jeunes
, entre 30
et 40 ans qui vont pr
é
senter une OVCR de
tr
è
s bon pronostic
, avec une r
é
cup
é
ration
totale de l'acuité visuelle. Dès le trouble visuel on se rend compte que la vision est assez
bien conservée, les veines sont dilatées, les hémorragies peu nombreuses, avec un
oedème papillaire important. Cette entité clinique a été décrite dans les années soixante.
Angiographie
Cet examen capital dans ce type de pathologie, permet de bien examiner l'état vasculaire
du fond d'oeil, et d'envisager l'évolution future.
Il permet de bien différencier les formes cliniques qu'on a décrit précédemment.
La forme oedémateuse
, entraîne un retard de remplissage veineux, des hémorragies en
flammèches, une dilatation des gros troncs veineux qui sont distendus et sinueux, avec
diffusion du colorant à travers les parois. L'oedème rétinien diffus domine le tableau, le
lit capillaire dilaté est trop bien visible.
Forme oedémateuse
Cliquer pour agrandir chaque image
Clich
é
s Dr Patrice
D
é
glise
La forme ischémique
, correspond à un retard de remplissage, des hémorragies pontuées
profondes de taille variable, réparties sur tout le pôle postérieur et formant parfois
d'importantes plaques. Les nodules cotonneux dysoriques sont très présents, parfois
confluents et sont la traduction de la souffrance ischémiques des territoires rétiniens. On
admet qu'ils sont dus à l'interruption du transport axoplasmique avec accumulation du
matériel au voisinage de la papille qui est peu oedématiée. Les lésions artérielles sont
majeures avec rétrécissement du diamètre et rigidité de la paroi. De vastes territoires
ischémiques (non
-
perfusion) sont visibles.
Séquence angiographique complète
Clichés Dr Patrice
Déglise
La forme mixte
peut l'être d'emblée ou bien résulter de la transformation d'une forme
oedémateuse en forme ischémique. Donc il est important de réaliser des angiographies
régulièrment pour surveiller l'évolution de toute OVCR.
Forme clinique: l'occlusion de branche
En
1877 Leber
décrivait l'
occlusion d'une branche
veineuse, comme sur la photo ci-
dessous, qu'il nomma
rétinite hémorragique
: "l'une des branches veineuses est
anormalement foncée, presque noire et dilatée au double de son calibre, alors que son
segment juxta
-
papillaire est aussi fin qu'un fil".
Cette occlusion est souvent due à l'
écrasement
de la veine par une artère rigide et
artérioscléreuse. C'est le
signe du croisement
, bien décrit par Paul
Bonnet
avec
Paufique
en
1934
, comme un "signe de préthrombose" constatée souvent entre 60 et 70
ans.
Photo du fond d'oeil Angio du fond d'oeil
Séquence angiographique complète
Clichés Dr Patrice
Déglise
A l'
angiographie
on note:
un
retard
de remplissage de la veine occluse
une
dilatation
des capillaires rétiniens, avec éventuellement des territoires
d'
ischémie
comme sur les clichés ci
-
dessus
une
diffusion
de la fluorescéine au niveau des parois veineuses et capillaires,
responsable d'un oedème rétinien
souvent des anomalies artérielles ou artériolaires (
retard
de perfusion artériel)
Complications
La vraie complication redoutée, c'est le
glaucome néovasculaire (GNV)
qui est
gravissime
. Les zones d'
ischémies rétiniennes
vont entraîner la formation d'une
néovascularisation
très fragile et qui va se développer au niveau rétinien, puis au niveau
de l'
angle irido
-
cornéen
et de l'
iris
, Cette prolifération de néovaisseaux sur l'iris est
nommé
rubéose irienne
. En France nous réalisons des
angiographies
pour repérer et
détruire au
laser
les zones rétiniennes ischémiques responsables de cette
néovascularisation. Aux Etats
-
Unis, c'est l'apparition d'une rubéose irienne qui va
nécessiter la photocoagulation laser des zones rétiniennes ischémiques.
Dans le
GNV
la pression intra
-
oculaire (
PIO
) est très
élevée
, dépasse parfois 50 ou 70
mmHg et s'accompagne d'un oedème cornéen évident. L'oeil a la consistance de la
classique "bille d'ivoire". On assiste souvent à des
hémorragies
massives dans le vitré
ou
dans la chambre antérieure (
hyphéma
). Un geste chirurgical est parfois discuté, mais il
faut savoir que la chirurgie du glaucome néovasculaire n'est pas toujours couronnée de
succès, et ne peut pas toujours empêcher la perte de l'oeil (phtise du globe). Quand l'oeil
est fonctionnellement perdu et douloureux, on est parfois amené à l'énucléer. Le patient
le demande pour ne plus souffrir.
Les autres complications
proviennent des
hémorragies
du vitré qui peuvent entraîner
un remaniement fibrovasculaire avec
traction
sur la rétine et
décollement
de la rétine.
Le pronostic visuel est l
à
aussi tr
è
s
mauvais
, le traitement chirurgical
é
tant peu efficace.
Photo du fond d'oeil Angio du fond d'oeil
Plus qu'une complication, c'est une pathologie très fréquemment associée, le
glaucome
à
angle ouvert. Les ophtalmologistes sont très attentifs à cela, et un contrôle tonométrique
bilatéral est toujours réalisé. Un suivi est nécessaire car ce glaucome peut apparaître
quelques temps après l'OVCR.
Etiologies
L'occlusion de la veine centrale de la rétine se produit au niveau de la lame criblée, dans
la papille.
Toutes les pathologies vasculaires jouent un rô
le dans la survenue de l'OVCR, que ce soit
l'HTA, le diabète, l'artériosclérose, les troubles de la coagulation ou les hyperlipidémies.
On se penche depuis quelques temps sur
l'hyperhomocystéinémie
.
Le bilan réalisé est très variable en fonction des circonstances de survenue, de l'âge du
patient et de son état de santé.
On réalise en général une
prise de sang
pour la mesure de la formule numération
sanguine, plaquettes, glycémie, créatinine, triglycéridémie et cholestérolémie. Après une
recherche d'un
état inflammatoire
(VS, fibrinogène, protéine C réactive) on étudie
l'
hémostase
à la recherche d'une anomalie (TCA, TP, AT3 ).
Traitements
En fonction du
bilan
on peut utiliser différents
médicaments
:
des anticoagulants dans certains cas très précis (troubles de la crase sanguine), à
manipuler avec précautions car ils peuvent entraîner des hémorragies sévères
des anti-aggrégants plaquettaires, principalement pour protéger l'oeil adelphe.
Une
hémodilution isovolémique
peut être proposée en milieu hospitalier si le sujet est
assez jeune, l'OVCR
récente
(moins d'un mois) et si la forme clinique est
oedémateuse
.
On ne le fera pas dans les autres cas ou bien si le patient présente des contre
-indications
(insuffisance cardiaque, âge supérieur à 70 ans, insuffisance coronarienne, HTA mal
équilibrée). Le but est d'
améliorer l'hémorhéologie
en abaissant le taux d'
hématocrite
entre 33 et 38% selon les protocoles. La technique consiste à ponctionner un certain
volume de sang que l'on remplace par du plasma autologue ou un substitut plasmatique.
Le traitement par photocoagulation
laser
des zones rétiniennes
ischémiques
est
primordial
. La destruction de ces secteurs évitera l'appel de néovaisseaux. On le
réalisera très localement en cas d'occlusion de branche, ou de façon plus étendue
(panphotocoagulation par 3000 à 4000 impacts)
en cas de forme ischémique sévère.
En cas d'
oedème maculaire persistant
on peut proposer une photocoagulation laser en
grille (
grid maculaire
), mais l'efficacité sur la vision n'est pas toujours au rendez
-
vous,
car le but est d'
é
viter une aggravation de la maculopathie.
Il faut bien expliquer au patient que le laser n'améliorera pas sas vision, mais que son but
est d'éviter les complications.
Conclusion
Les occlusions de la veine centrale de la rétine
(OVCR) ou de ses
branches
sont
très
fréquentes
et d'évolution très variable. Les recherches é
tiologiques n'aboutissent souvent
pas, mais il est important de réaliser des angiographies régulières et les traitements
adaptés.
A l'avenir
on pourra peut-être bénéficier des traitements
anti
-
VEGF
((Vascular
Endothelial Growth Factor) que nous avons évoqués dans le chapitre de la DMLA
.
Bibliographie
Luksch A, Maar N, Tittl M, Ergun E, Findl O, Stur M, Schmetterer L.
Evaluation of
pulsatile choroidal blood flow in branch retinal vein occlusion. Graefes Arch Clin Exp
Ophthalmol. 2002 Jul;240(7):548
-
50.
Beaumont PE, Kang HK.
Clinical characteristics of retinal venous occlusions occurring
at different sites. Br J Ophthalmol. 2002 May;86(5):572
-
80.
Casares PZ, Gillet DS, Verity DH, Rowson NR.
Bilateral simultaneous central retinal
vein occlusion (CRVO) caused by waldenstrom's macroglobulinaemia with acquired von
willebrand's disease. Br J Haematol. 2002 Jul;118(1):344
-
7.
Cohen S.Y, Quentel G.
Diagnostic angiographique des maladies rétiniennes
Encyclopédie Médico
-Chirurgicale 1997.
Coscas G., Dhermy P.
Occlusions veineuses rétiniennes Société Française
d'Ophtalmologie Masson 1978.
Fajnkuchen F, Giraud C, Gatinel D, Chaine G.
Central retinal vein occlusion in bird-
shot retinochoroidopathy. Arch Ophthalmol. 2002 Jul;120(7):987-9.
Fegan CD.
Central retinal vein occlusion and thrombophilia. Eye. 2002 Jan;16(1):98-
106. Review.
Hayreh SS, Zimmerman MB, Podhajsky P.
Hematologic abnormalities associated
with various types of retinal vein occlusion. Graefes Arch Clin Exp Ophthalmol. 2002
Mar;240(3):180
-96.
Singer DR, Hasan K.
Homocysteine and other new risk factors for central retinal vein
occlusion: new challenges for the internal medicine physician. Eur J Intern Med. 2002
May;13(3):160
-
162.
Suarez De Figueroa M.
[Surgical decompression of branch retinal vein occlusion] Arch
Soc Esp Oftalmol. 2002 Jun;77(6):291
-
4.
Suarez De Figueroa M.
[Surgical decompression of branch retinal vein occlusion] Arch
Soc Esp Oftalmol. 2002 Jun;77(6):291
-
4. Spanish. No abstract available.
Weger M, Stanger O, Deutschmann H, Temmel W, Renner W, Schmut O,
Semmelrock J, Haas A.
Hyperhomocyst(e)inemia and MTHFR C677T genotypes in
patients with central retinal vein occlusion. Graefes Arch Clin Exp Ophthalmol. 2002
Apr;240(4):286
-
90.
Yoneya S, Saito T, Nishiyama Y, Deguchi T, Takasu M, Gil T, Horn E
. Retinal
oxygen saturation levels in patients with central retinal vein occlusion. Ophthalmology.
2002 Aug;109(8):1521
-6.
Zhang H, Xia Y.
[Analysis of visual prognosis and correlative factors in retinal vein
occlusion] Chung Hua Yen Ko Tsa Chih. 2002 Feb;38(2):98
-102. Chinese.
Accueil | Photothèque | Annonces | Art | Histoire | Liens | Vue |
Maladies
| Chirurgie | Homepage |
Nous écrire
Le rétinoblastome
Retinoblastoma
Rev 14-09-2004
jmm
Nous remercions beaucoup le
Dr Laurence Desjardins
(Institut Curie Paris France) qui nous
propose le chapitre ci-dessous.
Le rétinoblastome est une tumeur
hautement maligne
touchant essentiellement le nourrisson et le
jeune
enfant
.
Rétinoblastome de l'oeil droit
Leucocorie (pupille blanche)
C'est une tumeur génétiquement déterminée. Le
gène
du rétinoblastome siège sur le chromosome
13
q
. Pour que la tumeur se développe il faut que les deux allèles du gène soient mutés. Dans le
rétinoblastome bilatéral il existe une mutation génétique constitutionnelle présente dans toutes les
cellules de l'organisme et la deuxième mutation a lieu au niveau de la cellule rétinienne. C'est
pourquoi le gène du rétinoblastome fonctionne comme un gène récessif mais la maladie se transmet
selon un mode autausomal dominant. Dans le rétinoblastome unilatéral unifocal non héréditaire dans
la plupart des cas les deux mutations ont lieu dans la cellule rétinienne.
Les signes cliniques
Le strabisme
peut être un signe d'appel précoce permettant parfois de faire le diagnostic de petites
tumeurs se développant dans la région maculaire. C'est pourquoi il ne faut pas confondre le
strabisme accommodatif du nourrisson avec un strabisme unilatéral permanent pouvant témoigner
d'une atteinte organique de la r
é
tine.
La
leucocorie
ou reflet blanc dans la pupille est visible au début que sous certains éclairages et dans
certaines directions du regard. Puis elle devient permanente. Ces signes doivent impé
rativement faire
pratiquer un examen du fond d'oeil après dilatation.
Leucocorie de l'oeil gauche
Les autres signes sont plus tardifs.
On peut citer la buphtalmie, l'hétérochromie irienne, le pseudohypopion et dans les formes les plus
évolués l'exophtalmie tumorale.
Buphtalmie
Le diagnostic
Il repose sur l'examen du fond d'oeil sous anesthésie générale après dilatation maximum.
Le rétinoblastome endophytique
apparaît comme une tumeur blanche richement vascularisée se
d
é
veloppant vers la cavit
é
vitr
é
enne avec de nombreux flocons blanch
â
tres flottant dans le vitr
é
.
Rétinoblastome endophytique
Les formes exophytiques
se présentent sous forme d'un décollement de rétine derrière lequel on
aperçoit les masses saillantes parfois calcifiées en partie blanches avec dilatation angiomateuse des
vaisseaux.
Rétinoblastome exophytique
L'échographie
est utile montrant l'extension des lésions avec des masses très échogènes.
Le scanner
confirme le diagnostic en montrant des calcifications. Il précise l'envahissement du nerf
optique ainsi qu'une éventuelle extension cérébrale.
L'IRM
. est souvent préférable chez ces enfants et permet de bien analyser une extension éventuelle
au niveau du nerf optique.
Le diagnostic différentiel
Il se pose surtout avec la
maladie de Coats
qui est facile à diagnostiquer dans sa forme précoce où
il
existe des tellangiectasies rétiniennes périphériques caractéristiques; par contre les formes évoluées
au stade de décollement total de la rétine, les deux affections peuvent être très difficile à diffé
rencier.
L'absence de calcification est en principe un signe en faveur de la maladie de Coats.