Les troubles de l’intégration visuelle - part 7 docx
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (1.03 MB, 19 trang )
graphie fluorescéinique de ces lésions démontre habi-
tuellement une hypofluorescence précoce bloquée, suivie
d’une coloration irrégulière de la lésion au temps mi-
artérioveineux, suivie par une hyperfluorescence tardive
tachetée alors que le motif de la coloration devient plus
confluent (figure 4). Occasionnellement, l’hyperfluores-
cence tardive tachetée d’une lésion métastatique
ressemble à un nid d’abeille. Par contraste, le motif
fluorescéinique d’un mélanome amélanotique présente
souvent une hyperfluorescence tachetée à un temps plus
précoce. Quoi qu’il en soit, l’angiographie fluorescéinique
ne permet pas toujours de faire la distinction de façon
définitive entre ces deux entités.
L’échographie en mode A montre généralement une
réflectivité interne modérée à élevée, avec une pointe
initiale élevée (figure 5a). L’échographie en mode B mon-
tre habituellement une lésion plate/placoïde ou bombée
qui est solide sur le plan acoustique, et une absence
de signe d’excavation choroïdienne (figure 5b). Un autre
aspect caractéristique est que ces lésions n’ont habi-
tuellement pas la forme de champignons. Une forme de
champignon se produit généralement en présence d’un
mélanome uvéal primitif, lorsque celui-ci traverse la
membrane de Bruch. Bien qu’ils soient rares, des cas de
métastases choroïdiennes en forme de champignons ont
déjà été rapportés, simulant un mélanome choroïdien
8
.
observation est importante, puisqu’une affection multifo-
cale ou bilatérale n’est pas présente en cas de mélanome
amélanotique primitif.
Lorsque l’iris est touchée, le patient présente le plus
souvent un nodule métastatique unilatéral, mais une
atteinte bilatérale est aussi possible (figure 3). Le nodule
métastatique de l’iris est habituellement blanc jaunâtre,
charnu, solitaire et situé dans la partie inférieure de l’œil
3
.
La libération de cellules friables entraîne souvent une iritis
secondaire, une injection épisclérale et, occasionnelle-
ment, un pseudohypopion. Un glaucome secondaire
survient très fréquemment, soit dans presque 40 % des cas
7
.
Un examen oculaire complet est justifié parce que jusqu’à
un tiers des cas présentent également une métastase
choroïdienne ipsilatérale associée
7
. Seulement 10 % de ces
dépôts métastatiques sur l’iris présentent des vaisseaux
sanguins proéminents à l’intérieur de la tumeur, contraire-
ment aux mélanomes amélanotiques de l’iris, dans
lesquels des vaisseaux sanguins sont davantage visibles
7
.
Les patients ayant une métastase au corps ciliaire
peuvent présenter un grand vaisseau sentinel sur la sclère
sus-jacente, une iridocyclite, une erreur de réfraction ou
une masse visible, le plus souvent sur la moitié inférieure
de l’œil.
Les tests ancillaires
Divers tests ancillaires peuvent aider à poser un
diagnostic clinique de métastases choroïdiennes. L’angio-
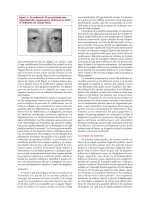
Figure 4 : Métastase choroïdienne.
Figure 4a : Photographie clinique d’une métastase
choroïdienne juxtapapillaire d’un cancer du sein.
Figure 4b : L’angiographie à la fluorescéine en
4 phases montre une hypofluorescence précoce et
une hyperfluorescence tachetée tardive typique
d’une métastase choroïdienne.
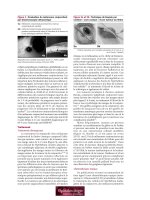
Figure 2 : Photographie clinique d’un œil droit montrant
une tumeur carcinoïde multifocale.
Figure 3 : Photographie clinique d’une métastase à
l’iris située dans le quadrant supérieur de l’iris droit.
(Courtoisie de Hugh McGowan)
(Courtoisie de Hugh McGowan)
a
b
Bien que la tomodensitométrie et l’imagerie par
résonance magnétique (IRM) puissent montrer une
métastase uvéale, ils sont d’une utilité limitée pour ce
qui est de préciser le diagnostic différentiel. Ils jouent
un plus grand rôle dans l’évaluation systémique des
tumeurs malignes primitives et la détermination de
la dissémination métastatique à d’autres sites.
Bien qu’elle ne soit pas souvent effectuée, on a
décrit une technique de biopsie intra-oculaire
9
. Cette
technique peut être importante quand les aspects
cliniques et les tests ancillaires décrits ci-dessus ne
permettent pas d’établir de façon concluante si la
lésion est une métastase ou un mélanome, un lym-
phome ou un granulome inflammatoire primitifs.
L’aspiration à l’aiguille fine peut être utile quand un
bilan systémique ne permet pas de diagnostiquer
une tumeur primitive et qu’un diagnostic tissulaire
est nécessaire pour mettre en place un traitement
approprié.
Il est également prudent de diriger le patient vers
un oncologue médical et un radio-oncologue afin
d’établir le stade de la maladie du patient et de
choisir un traitement approprié.
Le diagnostic différentiel
Le diagnostic différentiel d’une métastase choroï-
dienne de couleur crème comprend le mélanome
amélanotique primitif, l’hémangione choroïdien
primitif, la cicatrice disciforme exsudative, ainsi que
le granulome choroïdien primitif
1
. Dans certains cas
atypiques, il peut être difficile d’établir la distinction
entre le mélanome uvéal primitif et la métastase
Ophtalmologie
Conférences scientifiques
Figure 5 : Lésion métastatique à la choroïde.
Figure 5a : Échographie en mode A d’une lésion
choroïdienne montrant une réflectivité interne
moyenne.
Figure 5b : Échographie en mode B correspon-
dante d’une métastase choroïdienne montrant
une lésion bombée acoustiquement solide avec
décollement séreux de la rétine adjacent.
Figure 6 : Photographies cliniques et imagerie ancillaire
d’un mélanome amélanotique primitif.
Figure 6a : Photographie clinique d’un œil gauche
montrant un mélanome amélanotique.
Figure 6b : Échographie en mode B corres-
pondante montrant une lésion bombée avec
décollement séreux de la rétine adjacent.
Figure 6c : Échographie en mode A corres-
pondante montrant une réflectivité interne basse.
Figure 6d : Angiographie fluorescéinique
correspondante au temps précoce montrant
une hyperfluorescence précoce tachetée.
Figure 6e : Angiographie fluorescéinique au temps
tardif montrant une hyperfluorescence retardée au
centre, avec hypofluorescence bloquée en bordure.
a
a
b
c
d
e
b
uvéale (figure 6). On comprend qu’il est important
d’établir cette distinction, parce que le traitement et
le pronostic varient significativement entre ces deux
affections. Le tableau 1 illustre certaines des carac-
téristiques qui permettront de distinguer le
mélanome uvéal de la métastase uvéale.
Le diagnostic différentiel d’une métastase non
pigmentée de l’iris comprend le mélanome amélano-
tique, le nævus amélanotique, l’iritis granuloma-
teuse, le lymphome, la leucémie et le léiomyome
7
. Le
diagnostic différentiel d’une métastase pigmentée de
l’iris comprend le mélanome primitif de l’iris, le
nævus pigmenté, l’adénome, ainsi que les kystes de
l’iris
7
. Des antécédents d’affection maligne en con-
jonction avec un examen clinique typique aideront à
préciser le diagnostic différentiel. Dans les cas rares
où le diagnostic demeure incertain, une biopsie par
aspiration à l’aiguille fine peut être indiquée.
Le pronostic
En général, les métastases aux yeux et aux
annexes sont le signe d’un mauvais pronostic pour l’af-
fection primitive. Le temps de latence entre le diagnos-
tic du carcinome primitif et l’atteinte du globe oculaire
dépend du type de tumeur. Habituellement, les tumeurs
primitives qui tendent à produire des métastases
rapidement au globe oculaire sont les tumeurs au
poumon, au rein et à la prostate, alors que le cancer du
sein et le mélanome cutané métastasent plus tardive-
ment
1
. Dans leurs séries intitulées Metastatic Tumours
to the Eye and Orbit, Freedman et Folk ont constaté
que le laps de temps médian entre le diagnostic de la
tumeur primitive et le développement de métastases
choroïdiennes était d’environ trois ans avec le cancer
du sein et de un an avec le cancer du poumon
10
.
La durée de survie médiane varie également
selon le type d’affection primitive diagnostiquée.
Par exemple, la durée de survie médiane dans les
cas de métastases intra-oculaires d’un cancer du
poumon est de 6 mois, comparativement à 22 mois
dans les cas de cancer du sein
10
. Dans une revue
plus récente, Shields et ses collaborateurs ont déter-
miné que la durée moyenne de survie à la suite
d’un cancer du sein avec métastases à l’uvée était
de 21 mois, avec un taux de survie global de 24 % à
5 ans
4
. La durée médiane de survie des patientes
présentant un cancer du sein qui étaient plus âgées
ou qui avaient des métastases de l’orbite tendait à
être plus longue que celle des patientes plus
jeunes
10
. De façon similaire aux tendances obser-
vées dans le cas des métastases choroïdiennes, les
durées de survie médianes dans les cas de méta-
stases à l’iris étaient de 13 mois en présence de
cancer du sein et de 4 mois en présence de cancer
du poumon
7
. Les métastases oculaires de tumeurs
carcinoïdes seraient associées à des durées de
survie plus longues, avec une survie moyenne de
34 mois selon une revue récente
5
.
Le traitement
Les possibilités de traitement des métastases ocu-
laires dépendent de la santé générale du patient, de
la nature de l’atteinte oculaire, et de la tumeur primi-
tive sous-jacente. De plus, tout traitement devra faire
l’objet de discussions avec l’oncologue médical et le
radio-oncologue traitants. Il est certain que les
patients qui présentent des métastases oculaires qui
menacent leur vision et/ou des tumeurs qui aug-
mentent rapidement de volume, pourraient béné-
ficier d’une radiothérapie externe pour améliorer leur
vision et leur qualité de vie. La dose de radiation
peut varier entre 20 Gy sur une semaine à une dose
de 40 Gy fractionnée sur 4 semaines, et on l’admi-
nistre habituellement par une approche orbitale
latérale
2
. La durée de survie des patients n’est
habituellement pas assez longue pour que le patient
éprouve des effets secondaires oculaires, tels qu’une
rétinopathie radio-induite ou des cataractes radio-
induites. En général, de 80 % à 90 % des patients
répondent favorablement à la radiothérapie, et la
tumeur s’aplatit en un à deux mois, alors qu’il faut
légèrement plus de temps pour que le fluide sous-
rétinien se résorbe
1
. Les autres méthodes de radio-
thérapie comprennent la brachythérapie par plaques
d’iode-125 (I-125), de même que la radiothérapie
stéréotactique
2
.
La chimiothérapie est une autre approche
thérapeutique qui est efficace chez les patients qui
présentent de petites lésions peu actives et, en parti-
culier, chez les patients qui ont une maladie méta-
statique dans des endroits autres que l’œil
2
. Chez les
patients dont la maladie évolue en dépit de la
chimiothérapie, la radiothérapie externe serait
recommandée pour le traitement de la métastase
intra-oculaire. On choisira l’observation dans le cas
des patients qui présentent des lésions inactives
cliniquement, asymptomatiques ou de petite taille
qui ne menacent pas la vision
2
. L’énucléation peut
être indiquée chez les patients dont l’œil est rendu
aveugle et douloureux ou dans les rares cas où l’on
ne peut éliminer de façon concluante la possibilité
que la lésion soit un mélanome uvéal primitif de
grande taille.
Ophtalmologie
Conférences scientifiques
Tableau 1 : Caractéristiques pour le diagnostic
différentiel
Caractéristiques Mélanome Métastase
uvéal primitif uvéale
Couleur Peut être Jaune crème
amélanotique
Forme Forme de Plate ou
champignon bombée
Décollement de Généralement, DR Généralement,
la rétine (DR) peu important DR important
associé
Nombre de Unilatérale, Bilatérale et
lésions un site multifocale
Caractéristiques En mode A : En mode A :
à l’échographie réflectivité réflectivité basse
moyenne à élevée à moyenne
En mode B : En mode B :
vide acoustique, solidité
excavation de la acoustique
choroïde, en forme
de champignon
8. Shields JA, Shields CL, Brown GC, Eagle RC. Mushroom-shaped
choroidal metastasis simulating a choroidal melanoma. Retina
2002;22(6):810-813.
9. Shields JA, Shields CL. Diagnostic approaches to intraocular tumors.
In: Shields JA, Shields CL. Intraocular Tumors: A Text and Atlas.
Philadelphia: WB Saunders Co.; 1992:20-22.
10. Freedman MI, Folk JC. Metastatic tumours to the eye and orbit:
patient survival and clinical characteristics. Arch Ophthalmol
1987;105:1215-1219.
Réunion scientifique à venir
25 février au 3 mars 2006
32
nd
North American Neuro-Ophthalmology Society
(NANOS) Annual Meeting
Tucson, Arizona
Renseigements : Courriel :
Site web : />meetings/nanos2006/
Université de Toronto
Département d’ophtalmologie
et des sciences de la vision
Prochains événements
12 janvier 2006
CPI – D
r
Ronald Casey, Edmonton, Alberta
“Optic Nerve Head and Retinal Fibre Layer Analysis:
A Digital Revolution”
19 janvier 2006
CPI – D
r
Jeff Hurwitz, Chair, U of T Ophthalmology,
Toronto
“What to do with the tearing patient when the lacrimal
system is patent”
28 janvier 2006
2006 Toronto Cataract Course
Jan Spencer (416) 978-1617
9 février 2006
CPI – D
r
Paul Harasymowycz, Montréal, Québec
“Angle Closure Glaucoma: diagnosis and treatment”
Note : Les conférences des professeurs invités (CPI)
de cette année (septembre 2005 à mai 2006)
seront tenues à :
The Hospital for Sick Children
555 University Avenue, Toronto
Amphithéatre principal
Conclusions
Il est important que l’ophtalmologiste généraliste
comprenne bien la maladie métastatique intra-oculaire,
étant donné qu’il s’agit de l’affection maligne que l’on
trouve le plus fréquemment dans l’œil. Les carcinomes, le
plus souvent ceux du sein ou du poumon, produisent
fréquemment des metastases à l’œil. Cependant, comme
le patient n’a pas toujours des antécédents de carcinome
primitif, l’ophtalmologiste doit donc garder un niveau
élevé de suspicion clinique. Les cas suspects devraient
faire l’objet d’un examen clinique complet, d’une
angiographie fluorescéine, d’une échographie, ainsi que
d’un bilan systémique, pour établir la distinction entre
des lésions semblables. Le traitement le plus approprié
pour le patient dépend de la consultation avec l’onco-
logue médical et le radio-oncologue, ainsi que de la com-
préhension de l’état visuel et général du patient. La
majorité des patients présentant des lésions menaçant
leur vision répondent favorablement à la radiothérapie
externe. Bien que la maladie métastatique intra-oculaire
soit associée à un mauvais pronostic sur le plan de la
survie des patients, une évaluation effectuée en temps
utile, un diagnostic précis et un traitement mis en place
rapidement peuvent aider à améliorer la qualité de vie de
ces patients.
Le D
r
Somani est chargé d’enseignement de clinique au
Département d’ophtalmologie et des sciences de la vision, à
l’Université de Toronto. Il fait partie du personnel du Princess
Margaret Hospital, University Health Network, Toronto.
Remerciements : L’auteur souhaite remercier E. Rand Simpson,
qui a révisé le manuscript du présent article, les docteurs
Hugh D. McGowan et Allan Connor, pour les photographies
cliniques, et le D
r
Charles J. Pavlin, pour la biomicroscopie
ultrasonique. La prise en charge clinique a été fournie par
Lee Penney, coordonnateur de l’oncologie oculaire, et par le
personnel de soutien de la clinique d’oncologie oculaire.
Références
1. Volpe NJ, Albert DM. Metastases to the uvea. In: Albert DM, Jakobiec
FA. Principles and Practice of Ophthalmology. Philadelphia: WB Saun-
ders Co.; 2000.
2. Shields JA. Metastatic tumors to the uvea. Int Ophthalmol Clin 1993;
33(3):155-161.
3. Shields CL, Shields JA, Gross NE, et al. Survey of 520 eyes with uveal
metastases. Ophthalmol 1997;104:1265-1276.
4. Demirci H, Shields CL, Chao AN, Shields JA. Uveal metastasis from
breast cancer in 264 patients. Am J Ophthalmol 2003;136:264-271.
5. Harbour JW, De Potter P, Shields CL, Shields JA. Uveal metastases
from carcinoid. Ophthalmol 1994;101(6):1084-1090.
6. Truong SN, Fern CM, Costa DL, Spaide RF. Metastatic breast carci-
noma to the retina: optical coherence tomography findings. Retina
2002;22(6):813-815.
7. Shields JA, Shields CL, Kiratli H, De Potter P. Metastatic tumors to the
iris in 40 patients. Am J Ophthalmol 1995; 119:422-430.
© 2005 Département d’ophtalmologie et des sciences de la vision, Faculté de médecine, Université de Toronto, seul responsable du contenu de cette publication. Édition : SNELL Communication
Médicale Inc. avec la collaboration du Département d’ophtalmologie et des sciences de la vision, Faculté de médecine, Université de Toronto.
MD
Ophtalmologie – Conférences scientifiques est une marque
de commerce de SNELL Communication Médicale Inc. Tous droits réservés. L’administration d’un traitement thérapeutique décrit ou mentionné dans Ophtalmologie – Conférences scientifiques doit
toujours être conforme aux renseignements d’ordonnance approuvés au Canada. SNELL Communication Médicale se consacre à l’avancement de l’éducation médicale continue de niveau supérieur.
L’élaboration de cette publication a bénéficié d’une subvention à l’éducation de
Novartis Ophthalmics
130-019F
Les avis de changement d’adresse et les demandes d’abonne-
ment pour Ophtalmologie – Conférences Scientifiques doivent
être envoyés par la poste à l’adresse C.P. 310, Succursale H,
Montréal (Québec) H3G 2K8 ou par fax au (514) 932-5114 ou
par courrier électronique à l’adresse
Veuillez vous référer au bulletin Ophtalmologie – Conférences
Scientifiques dans votre correspondence. Les envois non
distribuables doivent être envoyés à l’adresse ci-dessus.
Poste-publications #40032303
SNELL
La version française a été révisée par le professeur Pierre Lachapelle,
Montréal.
Ophtalmologie
Conférences scientifiques
JANVIER/FÉVRIER 2006
Volume
4, numéro 1
COMPTE RENDU DES CONFÉRENCES
SCIENTIFIQUES DU DÉPARTEMENT
D’OPHTALMOLOGIE ET
DES SCIENCES DE LA VISION,
FACULTÉ DE MÉDECINE,
UNIVERSITÉ DE TORONTO
Département d’ophtalmologie
et des sciences de la vision
Faculté de médecine
Université de Toronto
60 Murray St.
Bureau 1-003
Toronto (Ontario) M5G 1X5
Le contenu rédactionnel d’Ophtalmologie –
Conférences scientifiques
est déterminé
exclusivement par le Département
d’ophtalmologie et des sciences de la vision,
Faculté de médicine, Université de Toronto.
Département d’ophtalmologie
et des sciences de la vision
Jeffrey Jay Hurwitz, M.D., Rédacteur
Professeur et président
Martin Steinbach, Ph.D.
Directeur de la recherche
The Hospital for Sick Children
Elise Heon, M.D.
Ophtalmologiste en chef
Mount Sinai Hospital
Jeffrey J. Hurwitz, M.D.
Ophtalmologiste en chef
Princess Margaret Hospital
(Clinique des tumeurs oculaires)
E. Rand Simpson, M.D.
Directeur, Service d’oncologie oculaire
St. Michael’s Hospital
Alan Berger, M.D.
Ophtalmologiste en chef
Sunnybrook and Women’s College
Health Sciences Centre
William S. Dixon, M.D.
Ophtalmologiste en chef
The Toronto Hospital
(Toronto Western Division and
Toronto General Division)
Robert G. Devenyi, M.D.
Ophtalmologiste en chef
La prise en charge des trous maculaires
PA R DAVID T. WONG, M.D., FRCSC
Les trous maculaires sont des lésions de la pleine épaisseur du tissu rétinien et centrés
au niveau de la fovea. Ils ont été décrits, pour la première fois, par Knapp, en 1869, dans un
cas de traumatisme oculaire
1
. Au cours des 100 années qui ont suivi, d’autres descriptions
de trous maculaires ont été publiées et de nouvelles théories cherchant à en expliquer les
causes ont vu le jour; mais aucun traitement n’a été conçu. La situation a toutefois consi-
dérablement évolué au cours des 20 dernières années. En 1988, en effet, Gass a conçu la
théorie de la traction tangentielle du vitré
2
, et en 1991, Kelly et Wendel ont montré que
l’ablation chirurgicale du vitré pouvait traiter efficacement cette maladie
3
. De nos jours, les
techniques modernes de diagnostic par imagerie permettent d’établir un diagnostic plus
précoce et de déterminer avec plus de précision l’état d’avancement de la maladie. Conjoin-
tement, les techniques chirurgicales modernes, appuyées par des traitements pharmaco-
chirurgicaux d’appoint, ont permis d’augmenter le taux de fermeture des trous maculaires,
améliorant ainsi les résultats obtenus au niveau de la vision. Ce numéro d’
Ophtalmologie –
Conférences scientifiques
décrit l’épidémiologie, l’histoire naturelle, le diagnostic et le traite-
ment des trous maculaires.
Epidémiologie
Les données sur la prévalence des trous maculaires situés dans l’épaisseur du tissu rétinien
sont limitées, et peu d’études basées sur la population ont été publiées sur ce sujet. L’étude
Beaver Dam Eye a constaté que cette prévalence est de 0,3 % sur l’ensemble de la population.
Cette prévalence passe de 0 % chez les sujets de moins de 54 ans, à 0,8 % chez les sujets âgés
de plus de 75 ans
4
. D’autres études ont confirmé ces chiffres.
5,6
On peut donc en déduire que
dans un pays comme le Canada, dont la population totale était estimée, en 2004, à 32 millions
d’individus, il y avait 96 000 personnes présentant des trous maculaires. L’âge de la population
augmentant, on peut s’attendre à ce que l’incidence des trous maculaires augmente. Pour des
raisons qui ne sont pas encore complètement élucidées, la probabilité d’avoir des trous
maculaires est trois fois plus élevée chez la femme que chez l’homme
7
. Est-ce que ce sont les
changements hormonaux ou démographiques (il y a, en effet, une proportion plus élevée de
femmes que d’hommes dans la tranche d’âge dite du « troisième âge ») qui sont à l’origine de
cette différence? : le débat est permanent sur ce sujet. Les causes idiopathiques sont à l’origine
de 85 % du nombre total de trous maculaires, alors que les causes induites par un traumatisme
n’interviennent que dans 15 % des cas.
Pathogenèse et évolution de la maladie.
De nombreuses théories sur la pathogenèse des trous maculaires ont été élaborées au fil
des ans. À l’origine, on expliquait la formation des trous maculaires par un traumatisme, accom-
pagné d’une séparation mécanique et d’une nécrose
9
. Plus tard, suite à de nouvelles descrip-
tions, on a constaté que les trous maculaires pouvaient se produire sans qu’il y ait eu de
traumatisme. La théorie de la dégénérescence kystique s’est développée à partir du manque
d’explication de l’origine des trous maculaires non traumatiques. Des kystes intra-rétiniens
situés au voisinage des trous maculaires ayant été décrits, il a été postulé que la dégénéres-
cence rétinienne constituait le mécanisme de formation des trous maculaires. On croyait égale-
ment que la dégénérescence kystique était provoquée par la diminution du flux vasculaire liée
à l’âge. Au fur et à mesure que ces kystes grossissaient, ils fusionnaient et formaient les trous
maculaires. De nombreux traitements destinés à augmenter le flux vasculaire (les vasodilata-
teurs comme l’acide nicotinique) ont été mis en avant, mais sans succès apparent.
Sachant que la traction du vitré constituait l’une des causes de déchirure rétinienne
périphérique, l’idée selon laquelle la traction antéro-postérieure du vitré était à l’origine de la
formation des trous maculaires a été décrite pour la première fois en 1924. Toutefois, l’impos-
sibilité de détecter une traction du vitré sur le trou maculaire a fait que cette théorie a été diffi-
MC
Département
d’ophtalmologie et des
sciences de la vision
FACULTY OF MEDICINE
University of Toronto
Disponible sur Internet à :
www.ophtalmologieconferences.ca
cilement acceptộe. Dautres auteurs ont essayộ dunier
les thộories. Ils ont suggộrộ un ô mộcanisme combinộ ằ,
associant la diminution de lộpaisseur de la macula aux
transformations induites par la formation de kystes due
une insufsance vasculaire, et, par la suite, la traction
exercộe par le vitrộ sur un tissu maculaire devenu plus
n, conduisant, ainsi, la formation des trous
10
.
Cest seulement en 1988, quand Gass a crộộ un sys-
tốme de classication, que lattention sest dộplacộe de la
traction antộro-postộrieure du vitrộ vers la traction tangen-
tielle sexerỗant le long de linterface vitro rộtinienne, pour
expliquer la formation des trous maculaires. Il en rộsulta
un regain dintộrờt pour les trous maculaires
11
. Gass a sug-
gộrộ que la contraction tangentielle crộe un dộplacement
de photorộcepteurs, avec perte de photorộcepteurs
12
. Au
dộbut, lhistopathologie des opercules na rộvộlộ aucune
perte de photorộcepteurs. Cependant, des ộtudes histo-
pathologiques plus rộcentes, menộes sur des opercules de
trous maculaires, ont mis en ộvidence une certaine perte
de tissu fovộal, incluant des photorộcepteurs
13
.
Le passage dun stade lautre, dans lộvolution des
trous maculaires, est liộ diffộrentes forces de traction.
Au stade 1, la classication de Glass dộcrivait la sộpara-
tion de la rộtine et de lộpithộlium pigmentaire rộtinien
(EPR) provoquộe par la traction. Cependant, des donnộes
rộcentes obtenues grõce des ộtudes dimagerie par
tomographie en cohộrence optique (TCO), permettent de
penser que la localisation de cette sộparation subit une
modication. On observe, en effet, au niveau des trous
maculaires en cours de formation, la prộsence dun
dộcollement de la zone corticale pộrifovộale du vitrộ, avec
attachement du vitrộ au niveau de lombilic. Cette trac-
tion du vitrộ pộrifovộal au niveau de la fovộa peut
entraợner la sộparation des cellules de Muller des photo-
rộcepteurs, ce niveau, crộant, au dộbut, un clivage au
niveau des couches intra-rộtiniennes et, par la suite, une
cavitộ kystique
14
.
Au stade 1A, on observe une perte de lombilic avec le
clivage intra-rộtinien et la traction exercộe, ce qui crộe la
tache jaune ponctuelle reprộsentant probablement le pig-
ment xanthophylle
Au stade 1B, comme la rộtine fovộale se soulốve de la
cavitộ vers la rộgion rộtinienne pộrifovộale on constate
une perte totale de lombilic et les points jaunes fusion-
nent pour former un anneau jaune.
Au stade 2, on observe une dộhiscence de la paroi
supộrieure de la cavitộ kystique, conduisant un trou
maculaire de stade 2, avec un dộfaut rộtinien <400 àm.
Au stade 3 : la traction tangentielle entraợne la poursuite
de la dộhiscence au niveau de la couche photorộceptrice,
et conduit la formation dun trou maculaire situộ dans
lộpaisseur du tissu rộtinien. Cette traction tangentielle
peut ộgalement former lopercule, dans la mesure oự elle
libốre la paroi supộrieure du kyste. Cela permet la face
postộrieure de la membrane hyaloùde de se sộparer de la
rộtine, tout en restant attachộe au nerf optique, crộant
ainsi un trou maculaire de stade 3 (Figure 1).
Une nouvelle traction va agrandir le trou, tangen-
tiellement.
Un trou de stade 4 apparaợt lorsque la membrane
hyaloùde postộrieure sest sộparộe du nerf optique.
Diagnostic
Les patients prộsentant des trous maculaires de stade
1 se plaignent rarement de troubles de la vision, alors que
ceux qui en sont aux stades ultộrieurs se plaignent
frộquemment de troubles de leur acuitộ visuelle centrale
ou mộtamorphopsie. Au fur et mesure que les trous
sagrandissent, la perte de vision augmente. Le Tableau 1
montre en dộtail lacuitộ visuelle chacun des stades. La
distorsion du coussinet axial est courante : elle est due au
dộplacement des photorộcepteurs
15
.
Lexamen clinique demeure la mộthode la plus
couramment utilisộe pour dộtecter la prộsence de trous
maculaires. Lutilisation de verres de contact en biomicro-
scopie oculaire lampe fente est bien supộrieure, pour
dộtecter les trous maculaires et pour dộterminer leur
stade davancement, lutilisation de verres tels que les
verres 78D ou 90D, qui nentrent pas en contact avec la
cornộe. Si lon consacre sufsamment de temps lexa-
men clinique, on peut dộceler les trous maculaires tous
les stades de leur ộvolution. Au stade 1, les trous mon-
trent des dộpụts jaunes indiquant, un possible dộplace-
ment des pigments xanthophylles. Au stade 2, on peut
voir de petites dộchirures, au niveau de la couche interne,
avec traction vitrộo-rộtinienne adjacente. Au stade 3, on
constate une perte arrondie de tissu rộtinien
> 400 àm,
ainsi que la prộsence dun opercule superposộ. Une pig-
mentation jaune peut ộgalement ờtre observộe, au niveau
de lEPR, au sein du trou: un manchon subrộtinien
liquide, environnant, peut ộgalement ờtre observộe. Un
anneau de Weiss rộvốle, habituellement, la sộparation de
la membrane hyaloùde postộrieure, au stade 4.
Plusieurs tests, rộalisables en cabinet, peuvent aider
diagnostiquer un trou maculaire. Le test Watzke - Allen,
qui se pratique en biomicroscopie lampe fente, est
Figure 1 : Photo de la rộtine montrant un trou maculaire
de stade 3, aprốs ộlimination du rouge
Tableau 1 : Caractộristiques des diffộrents stades
des trous maculaires
Stade 1 Stade 2 Stade 3 Stade 4
Bio- 1a-point jaune Diamốtre Diamốtre Diamốtre
microscopie 1b-anneau du trou du trou du trou
lampe fente jaune <400 àm >400 àm >400 àm
Vitrộ Attachộ Attachộ Attachộ Sộparộ
postộrieur
Accuitộ 20/20 20/40 20/60 20/60 CF
visuelle 20/60 20/100 20/200
Fermeture
60 % 4 %-33 % 5 %-12 % 5 %-12 %
spontanộe
Candidat
Non Excellent Bon Assez bon
la chirurgie
l’intérieur du trou et la présence d’une vision relative-
ment bonne, font la différence entre les pseudo trous et
les trous maculaires
18
. De plus, le test de Watzke – Allen,
tout comme le test au faisceau de pointage laser sont
négatifs dans le cas des pseudo trous. Une TCO différen-
cie facilement un pseudo trou d’un trou maculaire situé
dans l’épaisseur du tissu rétinien.
Il n’est pas rare que les patients présentent une mem-
brane épirétinienne (MER) associée à un trou maculaire.
L’examen clinique révèle la présence d’une MER dans un
trou maculaire dans 25 à 65 % des cas : toutefois, ce pour-
centage peut atteindre 73 % des cas, avec un examen
histopathologique. Les études préliminaires n’ont pas
permis de déterminer si les MER sont à l’origine ou
contribuent à la formation des trous maculaires, ou si
elles proviennent des déchirures ouvertes. Toutefois,
une étude du Groupe « Vitrectomy for Macular Hole
Study (VMHS) » a montré que la prévalence des MER est
plus élevée dans les trous les plus grands, de même que la
taille des MER est corrélée avec la durée du trou
19
. Ceci
couramment utilisé. Cette technique consiste à diriger, à
travers la fente, un faisceau étroit sur la fovea. Ce test est
positif quand le patient perçoit une interruption ou un
rétrécissement du faisceau. La sensibilité du test de
Watzke - Allen est de 95 % par rapport à l’examen clini-
que; toutefois, si on la compare à la TCO, cette sensibilité
réelle chute à 60 %.
16
Une variante du test de Watzke –
Allen consiste à diriger le faisceau laser de pointage sur
une tache de 50 µm de diamètre située au centre du trou
maculaire. L’incapacité du patient à détecter le faisceau de
pointage révèle la présence d’un trou maculaire situé
dans l’épaisseur du tissu rétinien. Il s’agit là d’un test
extrêmement sensible. Un autre test réalisable en cabinet,
hautement sensible mais non spécifique: le test de la
grille de Amsler
17
.
L’angiographie à la fluorescéine n’est ni sensible, ni
spécifique, pour la détection des trous maculaires. En
effet, au stade 2, 3 ou 4, il existe un défaut d’ouverture
avec une hyperfluorescence précoce dans le trou due
au manque de pigment xanthophylle et de tissu. Si la
choroïde est fortement pigmentée, l’hyperfluorescence
dans le trou maculaire peut être très faible, voire inexis-
tante. Parfois, on observe une hypofluorescence à l’inté-
rieur du trou, due aux dépôts jaunes
L’échographie aux ultrasons mode B est utile pour
déterminer si une séparation de la membrane hyaloïde
postérieure est intervenue et peut être utile pour préciser
l’état d’avancement de la maladie aux cours des derniers
stades. Elle se limite, toutefois, à la détermination de la
présence et du stade d’évolution des trous maculaires pré-
coces. La présence d’une membrane hyaloïde postérieure
attachée permet de prévoir, avec une certitude renforcée,
la formation de trous maculaires dans le futur.
La TCO est devenue la méthode de référence pour
détecter des trous maculaires : elle a supplanté presque
tous les autres tests, du fait de sa nature non invasive. Elle
fournit une excellente définition de la pathologie et per-
met de déterminer le stade et la taille des trous macu-
laires. La TCO est supérieure au test de Watzke – Allen en
termes de sensibilité. Compte tenu de sa capacité à
détecter la membrane hyaloïde postérieure, la TCO a été
particulièrement précieuse pour comprendre la patholo-
gie des trous maculaires (Figure 2). La détection précoce
d’une traction périfovéale du vitré permet d’identifier les
patients qui présentent un risque de formation de trous
maculaires, avant que ne surviennent les modifications
kystiques. D’un point de vue pratique, la représentation
graphique d’un trou par l’imagerie TCO constitue un
excellent moyen pour éduquer les patients en leur per-
mettant de mieux comprendre leur pathologie. La mise en
œuvre de la TCO a permis d’observer l’étiologie de la
maladie ainsi que le résultat des traitements.
D’autres tests, tels que la micropérimétrie, l’ophtalmo-
scopie à balayage laser, peuvent détecter des scotomes et
mieux délimiter l’étendue des photorécepteurs atteints.
Toutefois, l’impact de ces nouvelles techniques reste
encore à démontrer.
Diagnostic différentiel
De nombreuses affections de la macula peuvent faire
penser à des trous maculaires. Les membranes épiréti-
niennes (MERs) peuvent avoir un faux aspect de trous (on
les appelle « pseudo trous »). L’absence d’un manchon
liquide subrétinien, de taches pigmentaires jaunes à
Figure 2 : TCO de trous maculaires de stades 1 à 4
EPR = epithélium pigmentaire rétinien
Stade 1 – traction du vitré au niveau de la bordure périfovéale, avec
formation d’une cavité intra rétinienne.
Stade 2 – lambeau rétinien interne relié à la face postérieure de la membrane
hyaloïde avec un trou dans l’épaisseur du tissu rétinien.
A noter la formation de kystes.
Stade 3 – trou avec opercule superposé.
Stade 4 – séparation de la membrane hyaloïde postérieure et trou maculaire.
1
2
3
4
EPR
Membrane
hyaloïde
postérieure
constitue un argument supplémentaire en faveur de
la thèse selon laquelle les MERs se développent après
la formation du trou maculaire.
Les trous lamellaires, qui résultent d’une perte
partielle de tissu rétinien peuvent également faire
penser à un trou maculaire. L’étiologie précise des
trous lamellaires n’est pas claire, mais on pense qu’ils
sont créés par la séparation soudaine du vitré et de la
surface rétinienne, dans un trou en cours de forma-
tion. Un pseudo opercule peut également être
observé, rendant le diagnostic plus difficile. On pense
que le pseudo opercule représente le vitré condensé.
La TCO fera la différence entre un trou lamellaire et
un trou maculaire. (Figure 3)
Il existe d’autres entités pathologiques que l’on
peut confondre avec les trous maculaires, en parti-
culier avec les trous maculaires de stade 1, comme
l’œdème maculaire cystoïde (OMC), la rétinopathie
séreuse centrale (RSC), la dégénérescence maculaire
liée à l’âge (DMLA) avec de larges druses centrales,
le syndrome de traction vitro-maculaire et la
rétinopathie solaire.
L’histoire naturelle
On a identifié la traction oblique du vitré comme
étant un précurseur de la formation des trous macu-
laires. En général, les trous maculaires progressent
du stade 1A au stade 1B en quelques semaines à
quelques mois. En moyenne, la durée de la conver-
sion en trou dans l’épaisseur du tissu rétinien est de
4,1 mois, mais elle peut n’être que d’un mois. Les
patients dont la vision est de 20/50 à 20/80 ont 66 %
de chance d’évoluer, par rapport à ceux dont la
vision est supérieure à 20/50, qui n’évolueront que
dans 30 % des cas. Sur une période de 2 ans, 40 %
des trous de stade 1 se convertiront en trous de stade
3
19
. Par conséquent, 60 % des patients atteints de
trous maculaires de stade 1 ne subiront pas de con-
version. Des modifications résiduelles, cohérentes
avec un trou lamellaire, sont observées dans certains
cas où la conversion ne s’est pas produite.
Les patients porteurs de trous de stade 2
risquent, dans 67 à 94 % des cas, de voir ces trous
évoluer vers les stades 3 et 4. Ces trous peuvent,
dans 3 à 33% des cas, connaître une résolution spon-
tanée qui peut prendre de 2 à 8 ans
20,21
. Les trous s’a-
grandissent jusqu’à plus de 400 µm dans 85% des
cas, avec un risque supérieur à 70% de perdre plus
de 2 dixièmes d’acuité visuelle. Dans les trous de
Ophtalmologie
Conférences scientifiques
stades 3 et 4, on constate une nouvelle perte d’acuité
visuelle accompagnée d’une extension du manchon
liquide subrétinien, de modifications kystiques au
sein de la rétine et d’une dégénérescence des
photorécepteurs. Si le manchon liquide subrétinien
s’étend, le reste de la macula de même que, proba-
blement, la rétine périphérique peuvent se décoller.
Toutefois, cela ne se produit habituellement que
dans les cas de myopie supérieure à 6 dioptries
22
.
Bien que rare, la fermeture spontanée du trou peut
se produire dans 5 % à 12 % des cas
23
.
Le risque qu’un trou maculaire se développe
dans le deuxième œil (l’œil sain) est de 3 à 22 %.
Chew et col. ont rapporté que le risque de
développement d’un trou maculaire était de 4,3 %
dans les 3 ans, de 6,5 % dans les 4 à 5 ans et de 7,1 %
après 6 ans
24
. L’usage de la TCO, dans le deuxième
œil, a facilité l’identification des patients à risque
élevé. S’il existe une insertion oblique du vitré au
niveau de la fovea, le risque qu’un patient développe
un trou maculaire est multipliée par 6
25
. Bien que le
risque d’un développement bilatéral soit faible, un
suivi étroit et l’éducation des patients sur leurs
symptômes permettront un diagnostic et un traite-
ment précoces.
Traitement
Avant 1991, il n’existait aucun traitement contre
les trous maculaires situés dans l’épaisseur du tissu
rétinien. Toutefois, à cette époque, Kelly et Wendel
décrivaient la vitrectomie, le peeling de la mem-
brane et le tamponnement gazeux comme des mé-
thodes efficaces pour traiter les trous maculaires.
Depuis cette première description, les techniques se
sont perfectionnées et ont permis la mise en œuvre
de stratégies extrêmement efficaces dans le traite-
ment des trous maculaires.
En ce qui concerne les trous maculaires de stade
1, un essai multi-centrique, randomisé, conduit par
le VMHS, a montré que les interventions chirurgi-
cales n’apportaient aucun bénéfice. De plus, étant
donné l’évolution naturelle des trous de stade 1, –
avec au moins 60 % de cas de résolution spontanée,
et une conversion en trous dans l’épaisseur du tissu
rétinien se produisant en 4 mois en moyenne, –
la conduite habituelle consiste à observer et à
surveiller pendant 3 à 4 mois. La grille d’Amsler,
permettant un auto-contrôle par le patient, permet
d’apprécier l’évolution entre les visites de suivi.
En ce qui concerne les trous de stades 2, 3 et 4,
la vitrectomie de la zone postérieure, la séparation
de la membrane hyaloïde postérieure et le tampon-
nement ont constitué des traitements très efficaces.
Au départ, Kelly et Wendel ont montré que la ferme-
ture du trou était efficace, au plan anatomique, dans
58 % des cas, avec, dans 42 % des cas, des patients
qui gagnaient au moins 2 dixièmes d’acuité visuelle,
après vitrectomie chirurgicale. Le pourcentage de
succès de la fermeture du trou passe à 73 % et le
nombre de cas où les patients gagnent au moins 2
dixièmes de vision passe à 55 %, quand les patients
se font opérer dans les 6 mois qui suivent le
développement du trou maculaire.
Figure 3 : Trou lamellaire. Il y a encore du tissu
au dessus de l’EPR
EPR
Le recours à une chirurgie d’appoint et au peel-
ing de la membrane limitante interne (MLI) sont
intéressants et peuvent permettre d’améliorer les
pourcentages de succès. Auparavant, le facteur de
croissance TGF-ß
2
26
, les plaquettes, le sérum auto-
logue, la thrombine et le sang total
27
, étaient utilisés
pour augmenter la fermeture anatomique. Con-
ceptuellement, une fois que la traction à l’interface
du vitré est réduite, ces appoints favorisent la ferme-
ture du trou en créant une membrane permettant
d’obturer le trou. On pensait que le succès connu par
la fermeture des trous allait s’amplifier. Pourtant, les
échecs et la réouverture ultérieure des trous ont
stimulé de nouvelles recherches sur de nouvelles
façons de fermer les trous.
En revenant au concept de Gass de traction tan-
gentielle, l’attention s’est portée sur la MLI considérée
comme pouvant être à l’origine de cette traction. Cer-
taines études ont montré que le peeling de cette mem-
brane n’apportait aucun bénéfice alors que d’autres
ont démontré le contraire. Bien que le but initial du
peeling de la MLI ait été de réduire la traction qui
s’exerçait sur la bordure du trou maculaire, il semble
que la stimulation de la gliose constitue un facteur
plus important dans le processus de réparation
28
.
La MLI est fine et translucide, ce qui la rend diffi-
cile à enlever et peut expliquer pourquoi son ablation
a donné des résultats inconstants. En utilisant le vert
d’indocyanine (ICG)pour colorer la MLI, on a rendu le
peeling de la MLI plus facile et plus sûr (Figure 4)
29
.
Les pourcentages de succès, au plan anatomique, ont
augmenté de l’ordre de 90 %, avec une intervention
chirurgicale
30
. Toutefois, on a commencé à avoir des
doutes sur l’innocuité de cette méthode
31
. En effet, les
patients ayant subi un peeling de la MLI utilisant de
l’ICG semblaient avoir une capacité de récupération
de leur acuité visuelle amoindrie par rapport à ceux
qui n’avaient pas utilisé d’ICG. On a, également, pu
observer des modifications de la pigmentation au
niveau de l’EPR environnant, après un peeling de la
MLI utilisant d’ ICG. Le mécanisme exact de la sur-
venue de cette toxicité reste peu clair. Des lésions
au niveau des mitochondries et l’osmolalité sont des
facteurs qui peuvent contribuer à cette toxicité.
On a réalisé des études pour déterminer si, en
utilisant des doses réduites d’ICG, pendant l’inter-
vention, on pouvait améliorer la tolérance au niveau
de l’œil. On a montré que des concentrations d’ICG
inférieures à 0,5 mg/mL n’étaient pas toxiques sur
des cultures de cellules d’ERP
32
, mais que les faibles
concentrations diminuaient la coloration de la MLI
par rapport aux concentrations plus élevées. Il
faudra faire de nouvelles études in vivo pour déter-
miner les concentrations d’ICG qui ne provoquent
pas de lésions.
La toxicité possible de l’ICG a suscité un intérêt
pour d’autres méthodes permettant d’améliorer la
visualisation de la MLI. Le Kenalog peut être utilisé
pour mieux visualiser la MLI. Bien qu’il ne colore
pas la MLI, le kenalog adhère à la membrane
hyaloïde postérieure qu’il rend plus facile à
détecter. De plus, s’il se crée une bordure au niveau
de la MLI, les précipités de kenalog permettront de
la visualiser. Toutefois, l’innocuité du kenalog est
toujours questionnée. Les effets à long terme, tels
que la formation d’une cataracte, le glaucome, la
toxicité vis à vis de l’EPR, n’ont pas été bien étudiés
avec ce produit que l’on utilise comme adjuvant de
visualisation.
L’utilisation du bleu trypan pour améliorer la
visualisation de la MLI est prometteuse. Bien qu’il ne
colore pas la MLI, la contre–coloration est semblable
à celle du kenalog et renforce la visualisation des
bordures de la membrane : ce qui est utile pour le
peeling de la MLI. A ce jour, les études n’ont montré
aucune toxicité. Bien que ce produit ne soit pas
encore autorisé au Canada, de récents travaux con-
duits en Europe se sont révélés prometteurs
33
.
Pour faciliter la fermeture des trous maculaires,
on a souvent recours à un tamponnement au gaz
pour réduire le manchon liquide subrétinien et pour
permettre la réobturation. La durée de la position
« face vers le bas » varie de 24 heures à 3 semaines,
la plupart des chirurgiens optant pour 7 à 10 jours
environ et utilisant le perfluoropropane (C3F8) de
préférence à l’hexafluorure de soufre (SF6). Un autre
gaz, le C2F6, est idéal pour la chirurgie du trou
maculaire car sa durée se situe entre celle du SF6 et
celle du C3F8. Il n’est toutefois pas autorisé au
Canada. L’huile de silicone, un tamponnement à
long terme, peut-être utilisée pour les patients qui
ne peuvent pas supporter la position « face vers le
bas » ou qui ont connu des échecs. Mais pour des
complications telles que le glaucome, la décompen-
sation cornéenne, la nécessité de pratiquer une nou-
velle ablation chirurgicale, un décalage significatif
de la réfraction, montrent que ce n’est pas le
tamponnement idéal pour une réparation primaire.
Une vitrectomie auto-obturante chirurgicale,
utilisant une technique à jauge de 23 à 25 est idéale
pour la chirurgie du trou maculaire. L’inconfort du
patient et la réponse inflammatoire sont minimisés et
le patient récupère plus vite sans sutures. Les taux de
complications à long terme ne sont, à ce jour, pas
différents de ceux que l’on observe avec les systèmes
à jauge de 20
34
.
Ophtalmologie
Conférences scientifiques
Figure 4 : Peeling de la membrane limitante interne
(MLI), utilisant l’ICG (vert d’indocyanine).
24. Chew EY, Sperducto RD, Hiller R, et al. Clinical course of macular holes: the Eye
Disease Case-Control Study.
Arch Ophthalmol 1999;117(2):242-246.
25. Chan A, Duker JS, Schman JS, Fujumoto JG. Stage 0 macular holes: Observations
by optical coherence tomography.
Ophthalmology 2004; 111(11):2027-2032.
26. Glaser BM, Michels RG, Kuppermann BD, et al. Transforming growth factor-beta 2
for the treatment of full thickness macular holes. A prospective randomized study.
Ophthalmology 1992;99(7):1162-1172.
27. Ryan EA, Lee S, Chern S. Use of intravitreal autologous blood to identify posterior
cortical vitreous in macular hole surgery.
Arch Ophthalmol 1995;113(6): 822-823.
28. Uemoto R, Yamaoto S, Takeuchi S. Epimacular proliferative response following
internal limiting membrane peeling for idiopathic macular holes.
Graefes Arch Clin
Exp Ophthalmol
2004;242(2):177-80.
29. Kandonosono K, Itoh N, Uchio E, et al. Staining of internal limiting membrane in
macular hole surgery.
Arch Ophthalmol 2000;118(8):1116-1118.
30. DaMata AP, Burk SE, Foster RE, et al. Long term follow-up of indocyanine green-
assisted peeling of the retinal internal limiting membrane during vitrectomy
surgery for idiopathic macular hole repair.
Ophthalmology 2004; 111:2246-2253.
31. Ikagawa H, Yoneda M, Iwaki M, et al. Chemical toxicity of indocyanine green dam-
ages retinal pigment epithelium.
Invert Ophthalmol Vis Sci 2005;46:2531-2539.
32. Gale JS, Proulx AA, Gondar JR, et al. Comparison of the in vitro toxicity of indocya-
nine green to that of trypan blue in human retinal pigment epithelium cell
cultures.
Am J Ophthalmol 2004;138:64-69.
33. Lee KL, Dean S, Guest S. A comparison of outcome after indocyanine green and
trypan blue assisted interal limiting membrane peeling using macular hole
surgery.
Br J Ophthalmol 2005;89:420-424.
34. Lakhanpal RR, Humayun MS, de Juan E, et al. Outcomes of 140 consecutive
cases of 25-gauge transconjunctival surgery for posterior segment disease.
Ophthalmology 2005;112(5):817-24.
Le D
r
Wong déclare qu'il est Directeur médical et consultant pour
Labtician Ophthalmics, Inc. et a reçu des fonds de recherche et des
honoraires à titre de conférencier et de consultant d’Alcon Canada.
Réunions scientifiques à venir
30 avril – 4 mai 2006
Réunion annuelle de l’Association for Research in
Vision and Ophthalmology (ARVO)
Fort Lauderdale, Floride
Renseignements : Tél. : 240-221-2900
Fax : 240-221-0370
Site web : www.arvo.org
21 au 24 juin 2006
Réunion annuelle de la Société canadienne d’ophtalmologie
(SCO)
Westin Harbour Castle
Toronto, Ontario
Renseignements : Ms Kim Ross
Courriel :
Site web : www.eyesite.ca/annualmeet-
ing/2006/
Conclusion
Il y a 15 ans environ, un trou maculaire était une
maladie incurable. De nos jours, des traitements chirurgi-
caux bien établis ont changé le pronostic global pour ces
patients. On enregistre d’excellents taux de fermeture
dans plus de 90 % des interventions et les techniques de
visualisation renforcée de la MLI permettent de fixer de
nouvelles normes pour la récupération visuelle. De nou-
veaux progrès, grâce aux nouvelles techniques chirurgi-
cales, continueront d’apporter aux patients des bénéfices
toujours plus grands. En très peu de temps, nous avons
parcouru un très long chemin.
Le D
r
Wong est professeur adjoint au sein du Département
d’ophtalmologie et des sciences de la vision (DOSV) à l’Université
de Toronto. Il est directeur d’un programme de bourses de
recherche au sein du DOSV et chirurgien spécialisé en chirurgie
de la rétine à l’Hôpital St. Michael.
Références
1. Knapp H. Uber isolorite zerreissungen der aderhaut in folge von traumen auf dem
augopfel.
Arch Augenheilkd 1869;1:6-12.
2. Gass JDM. Idiopathic senile macular hole: its early stages and development.
Arch
Ophthalmol
1988;106:629-639.
3. Kelly NE, Wendel RT. Vitreous surgery for idiopathic macular holes: results of a
pilot study.
Arch Ophthalmol 1991;109:654-659.
4. Klein R, Klein BE, Wang Q, Moss SE. The epidemiology of epiretinal membranes.
Trans Am Ophthalmol Soc 1994;92:403-425.
5. Rahmani B, Tielsch JM, Katz J, Gottsch J, Quigley H, Javitt J, Sommer A. The cause-
specific prevalence of visual impairment in an urban population. Baltimore Eye
Survey.
Ophthalmol 1996;103:1721-1726.
6. Mitchell P, Smith W, Chey T, Wang JJ, Chang A. Prevalence and associations of
epiretinal membranes. Blue Mountains Eye Study, Australia.
Ophthalmology
1997;104(6):1033-1040.
7. Lewis ML, Cohen SM, Smiddy WE, Gass JD. Bilaterality of idiopathic macular holes.
Graefes Arch Clin Exp Ophthalmol 1996;234:241-245.
8. McDonnell PJ, Fine SL, Hillis AI. Clinical features of idiopathic macular cysts and
holes.
Am J Ophthalmol 1982;93:777-786.
9. Noyes HD. Detachment of the retina, with laceration at the macula lutea.
Trans
Am Ophthalmol Soc
1871;1:128-129.
10. Morgan CM, Schatz H. involutional macular thinning. A pre-macular hole
condition.
Ophthalmology 1986;93(2):153-161.
11. Gass JD. Idiopathic senile macular hole. Its early stages of development of a macu-
lar hole.
Arch Ophthalmol 1988;106:629-639.
12. Gass JD. Reappraisal of biomicroscopic classification of stages of development of
macular hole.
Am J Ophthalmol 1995;119:752-759.
13. Ezra E, Fariss RN, Possin DE, et al. Immunocytochemical characterization of macu-
lar hole opercula.
Arch Ophthalmol 2001;119:223-231.
14. Gaudric A, Haouchine B, Massin P, Paques M, Blain P, Erginay A. Macular hole
formation: new data provided by optical coherence tomography.
Arch Ophthalmol
1999;117(6):744-751.
15. Jensen OM, Larsen M. Objective assessment of photoreceptor displacement and
metamorphopsia: a study of macular holes.
Arch Ophthalmol 1998;116(10):1303-
1306.
16. Tanner V, Williamson TH. Watzke-Allen slit beam test in macular holes confirmed
by optical coherence tomography.
Arch Ophthalmol 2000;118(8):1059-1063.
17. Martinez J, Smiddy WE, Kim J, Gass JD. Differentiating macular holes from macular
pseudoholes.
Am J Ophthalmol 1994;117(6):762-7.
18. Cheung L, Freeman WR, Ozerden U, Song M, Azen SP. Prevalence, correlates, and
natural history of epiretinal membranes surrounding idiopathic macular holes.
Ophthalmology 2000;107:853-859.
19. de Bustros S. Vitrectomy for prevention of macular holes. Results of a randomized
multicenter clinical trial. Vitrectomy for Prevention of Macular Hole Study Group.
Ophthalmology 1994;101(6):1055-1059.
20. Guyer DR, de Bustros S, Diener WM, Fine SL. Observations on patients with idio-
pathic macular holes and cysts.
Arch Ophthalmol 1992;110(9): 1264-1268.
21. Hikichi T, Yoshida A, Akiba J, Konno S, Trempe CL. Prognosis of stage 2 macular
holes.
Am J Ophthalmol 1995;119(5):571-575.
22. Aaberg TM. Macular Holes.
Am J Ophthalmol 1970;69:555-562.
23. Yuzawa M, Watanabe A, Takahashi Y, Matsui M. Observation of idiopathic full-
thickness macular holes: follow-up observation.
Arch Ophthalmol 1994;112(8):
1051-1056.
© 2006 Département d’ophtalmologie et des sciences de la vision, Faculté de médecine, Université de Toronto, seul responsable du contenu de cette publication. Édition : SNELL Communication
Médicale Inc
. avec la collaboration du Département d’ophtalmologie et des sciences de la vision, Faculté de médecine, Université de Toronto.
MD
Ophtalmologie – Conférences scientifiques est une marque
de commerce de
SNELL Communication Médicale Inc. Tous droits réservés. L’administration d’un traitement thérapeutique décrit ou mentionné dans Ophtalmologie – Conférences scientifiques doit
toujours être conforme aux renseignements d’ordonnance approuvés au Canada.
SNELL Communication Médicale se consacre à l’avancement de l’éducation médicale continue de niveau supérieur.
L’élaboration de cette publication a bénéficié d’une subvention à l’éducation de
Novartis Ophthalmics
130-20F
Les avis de changement d’adresse et les demandes d’abonne-
ment pour
Ophtalmologie – Conférences Scientifiques doivent
être envoyés par la poste à l’adresse C.P. 310, Succursale H,
Montréal (Québec) H3G 2K8 ou par fax au (514) 932-5114 ou
par courrier électronique à l’adresse
Veuillez vous référer au bulletin
Ophtalmologie – Conférences
Scientifiques
dans votre correspondence. Les envois non
distribuables doivent être envoyés à l’adresse ci-dessus.
Poste-publications #40032303
SNELL
La version française a été révisée par le professeur Pierre Lachapelle,
Montréal.
Ophtalmologie
Conférences scientifiques
M
ARS/AVRIL 2006
Volume 4, numéro 2
COMPTE RENDU DES CONFÉRENCES
SCIENTIFIQUES DU DÉPARTEMENT
D’OPHTALMOLOGIE ET
DES SCIENCES DE LA VISION,
FACULTÉ DE MÉDECINE,
UNIVERSITÉ DE TORONTO
Département d’ophtalmologie
et des sciences de la vision
Faculté de médecine
Université de Toronto
60 Murray St.
Bureau 1-003
T
oronto (Ontario) M5G 1X5
Le contenu rédactionnel d’Ophtalmologie –
Conférences scientifiques
est déterminé
exclusivement par le Département
d’ophtalmologie et des sciences de la vision,
Faculté de médicine, Université de T
oronto.
Département d’ophtalmologie
et des sciences de la vision
Jeffrey Jay Hur
witz, M.D., Rédacteur
Professeur et président
Martin Steinbach, Ph.D.
Directeur de la recherche
The Hospital for Sick Children
Elise Heon, M.D.
Ophtalmologiste en chef
Mount Sinai Hospital
Jeffrey J. Hurwitz, M.D.
Ophtalmologiste en chef
Princess Margaret Hospital
(Clinique des tumeurs oculaires)
E. Rand Simpson, M.D.
Directeur
, Ser
vice d’oncologie oculaire
St. Michael’
s Hospital
Alan Berger, M.D.
Ophtalmologiste en chef
Sunnybrook and Women’s College
Health Sciences Centre
W
illiam S. Dixon, M.D.
Ophtalmologiste en chef
The Toronto Hospital
(Toronto Western Division and
Toronto General Division)
Robert G. Devenyi, M.D.
Ophtalmologiste en chef
Mise à jour sur la chirurgie
non pénétrante du glaucome
PA
R
BA
SEER
U
. K
H
AN
,
M.D.
E
T
IK
E
K
. A
H
MED
,
M.D.
Au cours des 30 dernières années, la trabéculectomie a été le traitement chirurgical de
référence du glaucome. Plusieurs modifications de la technique chirurgicale et des soins post-
opératoires (p. ex. l’utilisation d’antimétabolites, la lyse de suture au laser à l’argon et l’utilisa-
tion de sutures résorbables) ont amélioré le taux de succès de la trabéculectomie, mais un
taux élevé de complications subsiste. À court terme, ces complications incluent l’hypotonie
avec ou sans maculopathie, une chambre antérieure insuffisamment profonde, des épanche-
ments choroïdiens ou des hémorragies, des hyphémas et la formation de cataractes. Les com-
plications à long terme sont souvent associées à la morphologie de la bulle de filtration,
entraînant la fuite tardive de la bulle pouvant favoriser la blébite et l’endophtalmite.
Bien qu’initialement proposée dans les années 1950, la chirurgie non pénétrante du glau-
come (CNPG) n’est apparue comme une alternative chirurgicale à la trabéculectomie classique
que dans les années 1990. L’avantage de la CNPG, selon ses adeptes, réside dans son profil
d’innocuité, tout en offrant une efficacité comparable à celle de la trabéculectomie classique
pour réduire la pression intraoculaire (PIO). En l’absence de sclérotomie pleine épaisseur, la
filtration additionnelle survenant avec la CNPG a lieu à travers des structures oculaires semi-
perméables, maintenant ainsi une certaine résistance à l’écoulement de l’humeur aqueuse et
entraînant une incidence considérablement réduite de filtration excessive et d’hypotonie. Le
fait de maintenir l’écoulement de l’humeur aqueuse et d’éviter une hyptonie précoce augmente
la probabilité à long terme du succès de l’abaissement de la PIO. De plus, la non-perforation de
la chambre antérieure diminue significativement la décompression soudaine et les complica-
tions qui y sont associées, ainsi que l’inflammation intra-oculaire, les hyphémas et l’infection.
Les bulles de filtration résultant d’une approche non pénétrante sont généralement diffuses et
ont une localisation inférieure par opposition aux bulles de fi
ltration associées à la trabéculec
-
tomie qui peuvent être cystiques et avasculaires et sujettes à la fuite et à l’infection.
Actuellement, deux types d’intervention sont considérés comme une CNPG; la sclérec-
tomie profonde (SP) et la viscocanulostomie (VC). Dans ce numéro d’
Ophtalmologie – Conférences
scientifiques,
nous examinons l’histoire, le mécanisme d’action, la technique et la littérature
scientifique à l’appui de l’utilisation de la CNPG comme intervention chirurgicale pour le
traitement du glaucome.
Histoir
e
La CNPG fut décrite initialement par Epstein qui démontra la filtration de liquide à travers le
tissu cornéen intact lors de l’excision profonde des ptérygions dans la région paralimbique
1
. Il pro-
posa une SP paralimbique, dans laquelle une bande étroite de tissu scléral était excisée sur le canal
de Schlemm (CS) à 180
o
. En 1968, Krasnov proposa une méthode semblable. Il incisa le CS, puis
retira une bande de tissu scléral à 120
o2
. Le succès à long terme de ces interventions fut médiocre
en raison de l’apposition directe de la conjonctive contre le trabéculum exposé. Avec l’introduction
simultanée de la trabéculectomie classique par Sugar et Carins vers la fin des années 1960
3,4
, la
tec
hnique fut abandonnée et aucune amélioration ne fut apportée à la CNPG jusqu’aux années
1980, où l’on reconnut que la CNPG pouvait être réalisée sous un volet scléral, empêchant ainsi
la formation de tissu cicatriciel et entraînant une filtration plus durable
5,6
.
Sélection des patients
En général, la CNPG est indiquée chez les patients présentant un glaucome à angle ouvert
pour lequel une trabéculectomie classique est en
visagée. La CNPG est spécifiquement indiquée
dans les cas cliniques où une trabéculectomie entraînerait un risque élevé d’événements indésira-
bles, comme cela est décrit ci-dessous et dans le tableau 1.
MC
Département
d’ophtalmologie et des
sciences de la vision
FACULTY OF MEDICINE
University of Toronto
Disponible sur Internet à :
www.ophtalmologieconferences.ca
En raison des complications associées, la trabéculec-
tomie classique est généralement indiquée uniquement
lorsque le traitement médical maximal qu’un patient pou-
vait tolérer s’est soldé par un échec. Malheureusement,
l’utilisation d’agents topiques multiples est associée à une
inflammation conjonctivale de faible grade et à la formation
de tissu cicatriciel qui réduit l’
effi
cacité à long terme de l’in-
tervention chirurgicale. Le profil d’innocuité supérieur de la
CNPG comparativement à la trabéculectomie classique fait
de cette intervention une option raisonnable avant
d’épuiser toutes les options médicales. On doit apporter une
attention particulière aux affections qui sont associées à
d’importantes variations diurnes de la PIO, comme le syn-
drome de dispersion pigmentaire et le syndrome de
pseudo-exfoliation capsulaire. Dans ces cas, l’intervention
chirurgicale peut être supérieure au traitement médical
pour contrôler les fluctuations de la PIO
8-11
. De plus, la
CNPG, en particulier la VC, dépend dans une moins grande
mesure du bon état relatif de la conjonctive.
La CNPG permet d’éviter la décompression soudaine de
l’œil et est particulièrement indiquée chez les patients
présentant un risque élevé d’épanchement choroïdien ou
d’hémorragie s’ils subissaient une trabéculectomie clas
-
sique, en particulier si le patient a une vision monoculaire.
La CNPG est également la méthode de choix chez les
patients présentant un risque d’h
ypotonie post-opératoire.
La non-pénétration de la chambre antérieure réduit le
degré d’inflammation post-opératoire, diminuant ainsi le
risque post-opératoire de formation de la cataracte. Cela est
particulièrement bénéfique chez les jeunes patients. De
p
lus, la morphologie de la bulle associée à la CNPG
(
absente dans la VC ou localisation inférieure dans le canal
de Schlemm) permet de continuer à porter des lentilles de
contact après l’intervention et réduit théoriquement le
risque à long terme de blébite et les problèmes que la bulle
peut entraîner avec les lentilles de contact.
La CNPG est généralement contre-indiquée lorsque le
trabéculum a été obstrué ou endommagé, ou en présence
d’anomalies structurelles et d’anomalies des régions lim-
bique et paralimbique. On notera que la trabéculoplastie au
laser argon et la trabéculoplastie au laser sélectif ne sont
pas des contre-indications à la CNPG.
Technique
La plupart des instruments requis pour réaliser la
CNPG se trouvent dans le nécessaire pour trabéculectomie
classique. Cependant, l’utilisation d’un couteau de diamant
et d’autres instruments spécialisés facilite la réalisation de
l’intervention.
La CNPG peut être réalisée sous anesthésie locale
(préférence de l’auteur), péribulbaire ou rétrobulbaire.
Après l’application de l’agent anesthésique, un volet à la
base du fornix est créé dans le quadrant supérieur temporal
et nasal. Après le décollement de la conjonctive et l’obten-
tion de l’hémostase, un volet scléral superficiel est créé à
une profondeur de 33 % à 50 % de l’épaisseur sclérale.
Dans la SP, le volet a la forme d’un carré de 5 mm x 5 mm,
alors que dans la VC, c’est un volet parabolique qui
améliore la fermeture hermétique. Dans les deux cas, la dis-
section du volet est prolongée de 1 à 2 mm en cornée claire.
L’étape suivante est la dissection d’un volet scléral plus
profond à 90 % de l’épaisseur de la sclère. C’est l’étape la
plus délicate techniquement dans la CNPG qui doit être
réalisée au fort grossissement du microscope chirurgical.
Avec la SP, le volet a la forme d’un carré de 4 mm x 4 mm
de surface ; avec la VC, il est parabolique. À la profondeur
appropriée, la disposition irrégulière des fibres sclérales et
la teinte mauve foncé des choroïdes sont clairement visi-
bles. À cette profondeur, en poursuivant la dissection du
volet antérieurement, le couteau passe progressivement
d’une sclère postérieure avec des fibres arrangées de façon
anarchique pour arriver sur le ligament de l’éperon scléral
où les fibres sont parallèles au limbe. La dissection est
ensuite poursuivie en avant jusqu’à la membrane de
Descemet (MD), ce qui ouvrira le CS. À ce stade, peu de
force, sinon aucune, est nécessaire pour progresser. La dis-
section doit être prolongée au moins de 1 mm en cornée
claire pour créer une membrane trabéculo-Descemétique
(MTD) adéquate. Des incisions verticales relaxantes sont
nécessaires sur les bords latéraux du volet pour poursuivre
la dissection en cornée. La figure 1 illustre l’anatomie de la
dissection. Cette partie de l’opération est très délicate, car
un geste malvenu peut provoquer une perforation de la
MD. Lorsque le volet est retiré, on peut observer un écoule-
ment d’humeur aqueuse à travers la MTD. À ce stade, les
deux types de C
NPG divergent.
• Dans la VC, une paracentèse est réalisée pour créer un
faible degré d’hypotonie de façon à ce que le sang reflue du
C
S, permettant ainsi de localiser chaque extrémité coupée.
Le CS est ensuite intubé avec une canule de Grieshaber et
un produit viscoélastique à haute viscosité est injecté 5 à 6
f
ois à chaque extrémité – élargissant le CS et améliorant
ainsi l’écoulement de l’humeur aqueuse. Le volet scléral
Tableau 1 : Sélection des patients
Indications
T
ous les glaucomes à angle ouvert
(en particulier dans les cas suivants)
• Intervention chirurgicale précoce nécessaire
• Patient ayant une vision monoculaire
• Importantes fluctuations diurnes
– Syndrome de dispersion pigmentaire
– Syndrome de pseudo-exfoliation capsulaire
•
Risque élevé d’épanchements choroïdiens ou
d’hémorragies
– Myopie axiale
– Hypertension
– Athérosclérose
–
Antécédents d’épanchements choroïdiens ou
d’hémorragie
– Pression veineuse épisclérale accrue
– Risque élevé d’hypotonie postopératoire
– Jeunes patients
–
Myopies importantes
– Sexe masculin
• Glaucome uvéitique sans SAP importante
• Jeunes patients
Contre-indications
• Obstruction du trabéculum
– Fermeture importante de l’angle due à des synéchies
– Glaucome néovasculaire
– Angles pouvant être occlus
1
• Modification anatomique
– Sclèr
e mince
– Tissu cicatriciel limbique important
◆
Tunnel scléral antérieur
◆
Extraction de la cataracte extracapsulaire antérieure
1
La CNPG peut être combinée à la chirurgie de la cataracte ou à l’iridotomie périphérique
SAP = synechiae antérieur périphérale
par le tissu conjonctival. Par opposition, la question de
savoir comment la PIO est réduite dans la CNPG fait l’objet
de débats : tout d’abord, où la filtration a-t-elle lieu et
ensuite, où le drainage de l’humeur aqueuse a-t-il lieu ?
En ce qui concerne la filtration, Grant a démontré qu’il
existe une résistance à l’écoulement dans une proportion de
75 % au niveau du trabéculum juxtacaniculaire (TJC), qui
est également le site où il existe une résistance modifiée
dans le glaucome à angle ouvert primitif
12,13
. Au cours de la
CNPG, de nombreux chirurgiens retirent la paroi interne du
CS et on considère que cela élimine également le tissu con-
jonctif juxtacaniculaire dans cette région. Certains avancent
que dans la CNPG, c’est le mécanisme principal de filtration
qui est cliniquement corrélé à la filtration accrue de
l’humeur aqueuse notée après le pelage de la paroi interne
du C
S pendant la période peropératoire. D’
autres ont avancé
que des microperforations qui permettent à l’humeur aque-
use de passer sont créées dans la MTD au cours de la dissec-
tion chirurgicale du volet sclérocornéen profond et du
pelage de la paroi interne du CS
14-16
. On considère que la
réparation physiologique des microperforations augmente la
résistance à l’écoulement et est responsable de la PIO accrue
observée ultérieurement après l’intervention
17,18
. Enfin, on a
émis l’hypothèse que la filtration a lieu à travers la MTD, un
phénomène analogue au passage d’un liquide à travers une
membrane semi-perméable. Des études expérimentales chez
des lapins ont démontré que la MTD a une capacité limitée à
fonctionner ainsi. Cependant, l’effet est probablement plus
important chez les êtres humains, chez qui la membrane de
Descemet est plus fine
19,2
0
.
On a suggéré que le drainage de l’humeur aqueuse a
lieu par divers mécanismes dans la C
NPG. Dans la SP, le
volet scléral superficiel est fixé lâchement à la sclère adja-
cente pour permettre l’écoulement de l’humeur aqueuse du
lac scléral vers l’
espace sous-conjonctival, permettant la for-
mation d’une bulle de filtration. De plus, des études sur la
biomicroscopie à ultrasons ont démontré des zones hypoé-
c
hogènes dans la région supraciliaire en profondeur
jusqu’au lac scléral, ainsi que dans la sclère adjacente
21,22
.
superficiel est ensuite remis en place et refermé par des
points de suture serrés. Enfin, le produit viscoélastique à
haute viscosité est injecté sous le volet scléral pour main-
tenir le « lac » scléral. Les produits viscoélastiques à haute
viscosité préviennent la migration du fibrinogène,
réduisant ainsi au maximum la formation de tissu cicatriciel
qui pourrait obstruer ultérieurement le lac scléral. La con-
jonctive est ensuite refermée selon la méthode habituelle.
• Dans la SP, après l’ablation du volet conjonctival profond,
on effectue le pelage de la paroi interne du CS (figure 1) et
l’on note une augmentation immédiate de la filtration de
l’humeur aqueuse à travers la MTD. Afin de pouvoir main-
tenir l’espace scléral ouvert, on utilise généralement un
implant de collagène (préférence de l’
auteur) que l’
on place
centripètement dans la chambre formée lors de l’excision
du volet scléral profond afin de maintenir le lac scléral.
L’implant est suturé à l’aide d’un monofilament de nylon
10-0 (figure 2). Le volet scléral superficiel est ensuite refermé
lâchement à l’aide d’un bifilament de nylon 10-0, afin de
favoriser la formation d’une bulle de filtration. La conjonc-
tive est ensuite refermée selon la méthode habituelle.
Outre l’utilisation d’un implant de remplissage pour
maintenir l’espace ouvert, on utilise la mitomycine C
(MMC) comme traitement d’appoint pendant les périodes
peropératoire et postopératoire. D’autres traitements
d’appoint incluent le 5-fluorouracile et la goniopuncture au
laser Nd-YAG. La goniopuncture consiste en des microper-
forations de la MTD à l’aide d’un laser Nd-YAG pour aug-
menter la filtration. Le rôle de ces traitements d’appoint
ainsi que de celui de la C
NPG en tant qu’entité chirurgicale
viable est examiné ci-dessous.
Mécanisme d’action
Le mécanisme d’action à la base de la réduction de la
PIO est évident dans la trabéculectomie classique – la filtra-
tion a lieu par le volet scléral sous-
conjonctival réalisé per-
mettant l’écoulement de l’humeur aqueuse et son drainage
Figure 1: À la profondeur appropriée, en poursuivant
l
a dissection du volet antérieurement, le couteau passe
progressivement d’une sclère postérieure avec des fibres
arrangées de façon anarchique pour arriver sur le ligament
de l’éperon scléral où les fibres sont blanches et parallèles
au limbe. La dissection est ensuite poursuivie en avant
jusqu’à la membrane de Descemet (MD), ce qui ouvrira
le canal de Schlemm (CS). À ce stade, peu de force, sinon
aucune, est nécessaire pour progresser. Notez le pelage de
la paroi interne du CS dans la figure.
Figure 2: Afin de fixer l’implant de collagène pour
m
aintenir le lac scléral, un point de suture à l’aide d’un
monofilament de nylon 10-0 est placé dans le lit scléral.
Cet point est effectué en pleine épaisseur à travers la sclère
restante, mais demeure dans l’espace suprachoroïdien.
On a également démontré que les implants de collagène
réduisent l’inflammation dans la zone adjacente au volet
scléral et à la bulle de filtration en activant la collégénase.
Membrane
de Descemet
Implant
de collagène
Paroi interne
du CS
Éperon scléral
Marge du
volet pr
ofond
Marge du
volet superficiel
C
ela semble indiquer que le drainage de l’humeur
a
queuse est également assuré par les voies uvéosclérale
et transclérale, respectivement
21
. Le drainage addition-
nel qui a lieu par ces voies secondaires explique proba-
blement pourquoi la SP produit des bulles filtrantes
dont la localisation est inférieure à celles produites au
cours de la trabéculectomie classique, malgré une
réduction de la PIO comparable
23
.
Par opposition à la SP, dans la VC, le volet scléral
superficiel est solidement suturé à la sclère qui l’en-
toure, produisant une fermeture imperméable. En plus
des voies uvéosclérale et transsclérale, le drainage se
fait par le CS modifié mécaniquement
24
. L’injection
d’un produit viscoélastique à haute viscosité par les
extrémités ouvertes du CS entraîne la dilatation du
canal et la création de microperforations dans les
parois endothéliales interne et externe
16
. Il en résulte
une capacité de filtration accrue du CS et une réduc-
tion de la PIO associée.
Revue de la littérature scientifique
L’évaluation d’une nouvelle technique chirurgicale
nécessite d’examiner son efficacité et son innocuité.
Une revue de 35 études importantes examinant ces
deux paramètres dans la CNPG est présentée dans les
paragraphes suivants
17,23-25-58
.
La première étude de référence sur la CNPG a été
menée par Stegmann en 1999
5
7
. L’auteur a évalué une
série consécutive de 214 patients subissant une VC; la
PIO moyenne a été réduite de 47,4 à 16,9 mm Hg et les
taux de succès étaient de 82,7 % et 89 % (pour un suc-
cès « complet » et un succès « mitigé », respectivement).
Cependant, d’autres études antérieures sur la CNPG
qui évaluaient principalement la VC ou la SP sans
implant, n’ont pas démontré une réduction similaire de
la PIO et des études comparant la CNPG et la tra-
béculectomie ont indiqué une efficacité moindre pour
réduire la PIO. Dans une étude prospective ran-
domisée et contrôlée sur la trabéculectomie
vs la VC,
Jonsecu-
Cuypers et ses collaborateurs ont rapporté un
taux de succès de 0 % avec la VC comparativement à
un taux de succès de 50 % avec la trabéculectomie à 6
mois
54
. Dans une autre étude randomisée et contrôlée
comparant la VC et la trabéculectomie avec MMC,
O’Brart et ses collaborateurs ont rapporté un taux de
succès complet de 24 %
vs 68 % pour la VC et la tra-
béculectomie avec MMC, respectivement
50
. Cepen-
dant, dans ces deux études, ainsi que dans de
nombreuses autres études antérieures, la goniopunc-
ture au laser Nd-YAG n’était pas autorisée ou si elle
était nécessaire, on considérait qu’elle indiquait un
échec de la chirurgie, car elle convertit la CNPG en
une intervention pénétrante.
Les adeptes de la CNPG ont répliqué que la néces-
sité de moduler l’écoulement de l’humeur aqueuse
Ophtalmologie
Conférences scientifiques
a
vec la goniopuncture un certain temps après l’inter-
v
ention ne diffère pas de la nécessité d’effectuer la lyse
de suture avec un laser à l’argon, bien que la gonio-
puncture qui modifie la CNPG – une intervention non
pénétrante – en une intervention pénétrante, ne soit
pas associée aux mêmes risques qu’une intervention
pénétrante. Lorsqu’on a utilisé le 5-fluorouracile et la
goniopuncture selon les indications, Shaarawy a rap-
porté un taux de succès complet et mitigé de 60 % et
90 %, respectivement à 34 mois de suivi
45
. Choisissant
une PIO moyenne finale arbitraire < 15 mm Hg, 15 des
19 études qui ont exclu la goniopuncture comme un
traitement d’appoint post-opératoire acceptable n’ont
pas atteint cet objectif, alors que 3 des 4 études qui ont
inclus la goniopuncture, ont rapporté une PIO
moyenne finale < 16 mm Hg.
La première étude sur la SP, menée par Mermoud
et al, était une étude prospective comparant un implant
de collagène à la trabéculectomie
17
. Chaque groupe
comprenait 44 yeux. À 24 mois, les taux de succès com-
plet (< 21 mm Hg) étaient de 69 % et de 57 % pour la
SP et la trabéculectomie, respectivement, une dif-
férence qui était à peine significative (
p=0,047). Dans
une étude similaire, Cillino et ses collaborateurs ont
rapporté un taux de succès de 53 % et de 57 % (< 21
mm Hg) pour la SP et la trabéculectomie, respective-
ment, à 24 mois. On notera que Cillino et ses collabora-
teurs n’ont pas utilisé les techniques d’appoint (implant
de collagène et goniopuncture) avec la SP que l’on avait
utilisées dans l’étude antérieure
32
.
La SP s’est généralement avérée plus efficace que
la VC pour réduire la PIO. Comme nous l’avons men-
tionné antérieurement, parmi les 19 études de VC éval-
uées, seules 3 (16 %) ont obtenu une PIO moyenne
finale < 16 mm Hg, alors que 9 des 26 (35 %) études
évaluant la SP ont pu atteindre cet objectif. Cependant,
l’utilisation de modalités d’appoint avec la SP est essen-
tielle pour réduire la PIO. Cela est également le cas
pour la trabéculectomie, comme l’illustrent les
2
études présentées ci-
dessus. L’usage d’antimétabo-
lites pendant la période peropératoire ou postopéra-
toire réduit la PIO dans la SP. Dans une étude
randomisée et contrôlée évaluant la SP
vs la SP avec
MMC (40 patients dans chaque groupe), Kozobolis et
ses collaborateurs ont signalé un taux de succès com-
plet (mitigé) chez 43 (50 %) et 73 (90 %) patients pour
la SP et la SP avec MMC, respectivement
48
. Dans
l’ensemble, parmi les 7 études évaluant la SP sans
antimétabolites, aucune n’a atteint une PIO moyenne
finale < 16 mm Hg, contrairement aux 9 des 19 études
qui ont utilisé des antimétabolites.
Le rôle de l’implant pour maintenir l’espace entre
le volet superficiel et la sclère profonde est tout aussi
important. Shaarawy et Mermoud ont rapporté une
étude randomisée et contrôlée comparant la SP et la SP
T
ableau 2 :
Méta-analyse de la fréquence (en %) des événements indésirables dans 38 études
Chor
oïdien
Cataracte induite Progression de
Hyphémas
Hypotonie Plat/creux (épanchement/hémorragie) chirurgicalement cataracte tardive
Trabéculectomie 17,21 14,15 16,67 13,89 8,00 12,89
Viscocanulostomie
13,16
5,86
4,63
3,47
1,00
4,50
Sclérectomie pr
ofonde 8,77 2,84 0,86 3,73 0,00 9,63
a
vec implant de collagène
34
.
À 48 mois, le taux de suc-
c
ès complet (mitigé) était de 38 (69 %) et de 69 (100 %)
pour la SP et la SP avec implant de collagène, respec-
tivement. La compilation des résultats des 26 études
indique que seulement 2 des 13 études qui n’ont pas
utilisé d’implant de remplissage ont obtenu une PIO
moyenne finale < 16 mm Hg, alors que 7 des 13 études
qui ont utilisé un implant ont atteint cet objectif.
Bien qu’aucune étude n’ait été conçue pour déter-
miner spécifiquement l’efficacité de la goniopuncture,
il est évident – comme on l’a démontré avec la VC –
que la goniopuncture est une modalité d’appoint
importante à utiliser dans la SP. L’examen des 26
études révèle qu’aucune des 7 études qui n’autori-
saient pas la goniopuncture n’a atteint une PIO
moyenne finale < 16, alors que 9 des 19 études qui ont
eu recours à la goniopuncture, lorsqu’elle était
indiquée, ont atteint cet objectif.
Bien qu’il n’y ait pas de consensus universel sur
l’efficacité de la CNPG, son profil d’innocuité supérieur
à celui de la trabéculectomie est évident. Le tableau 2
présente les taux moyens de complications pour la tra-
béculectomie, la VC et la SP dans les 35 études exam-
inées. Les auteurs ont récemment terminé une étude
prospective randomisée comparant la trabéculectomie
et la SP avec un traitement d’appoint (à savoir les
antimétabolites, la goniopuncture, les ponctions avec
des aiguilles et la lyse de suture au laser) utilisées
selon les indications. Dans cette étude, la réduction de
la PIO dans chaque groupe était équivoque, le profil
d’innocuité ayant été significativement supérieur dans
le groupe ayant fait l’objet d’une SP.
Conclusion
Des études initiales sur la CNPG évaluant princi-
palement la VC ou la SP sans implant, indiquent que
ces interventions ont une efficacité moindre pour
réduire la PIO comparativement à la trabéculectomie
avec MMC. Cependant, les améliorations de la tech-
nique (p. ex. implants pour maintenir l’
espace, utilisa
-
tion d’antimétabolites et modulation postopératoire
avec la goniopuncture au laser Nd-YAG) ont entraîné
une réduction de la PIO comparable, sinon supérieure,
tout en offrant un excellent profil d’innocuité, en parti-
culier dans la SP avec implant de collagène. La capacité
de la VC à réduire la PIO n’est probablement pas aussi
élevée que celle de la SP avec implant. Actuellement,
les données à long terme sur la CNPG se multiplient.
Elles indiquent que la modification de la morphologie
de la bulle de filtration obtenue avec la CNPG (plate et
diffuse dans la SP et non existante dans la VC) réduit le
risque de fuite tardive, de blébite et d’endophtalmite.
Les connaissances acquises grâce à l’étude de la
CNPG ont contribué largement à mieux connaître
l’anatomie de l’angle ainsi que l’importance des
c
horoïdes comme site de drainage de l’humeur aque-
use. La question de savoir si la chirurgie du glaucome
reposera à l’avenir sur la CNPG reste à déterminer,
étant donné que de nombreuses nouvelles interven
-
tions et implants pour le traitement du glaucome ont
été récemment mis au point. Ces recherches ont été
motivées manif
estement par le taux d’événements
défavorables associés à la trabéculectomie et aux
a
ntimétabolites. La trabéculectomie est utilisée pour
t
raiter chirurgicalement le glaucome depuis près de
40 ans. Cependant, il est maintenant tout à fait plausi-
ble et probable que la trabéculectomie avec MMC soit
classée au rang de relique au cours de la prochaine
décennie.
References:
1. Epstein E. Fibrosing response to aqueous. Its relation to glaucoma. Br
J Ophthalmol
1959;43:641-7.
2. Krasnov MM. Externalization of Schlemm’s canal (sinusotomy) in
glaucoma. Br J Ophthalmol 1968;52(2):157-61.
3. Sugar HS. Experimental trabeculectomy in glaucoma.
Am J Ophthal-
m
ol 1
961;51:623-7.
4. Cairns JE. Trabeculectomy. Preliminary report of a new method.
Am J
Ophthalmol
1968;66(4):673–9.
5. Fyodorov SN, Ioffe DI, Ronkina TI. Deep sclerectomy: technique and
mechanism of a new glaucomatous procedure.
Glaucoma
1984;6:281-3.
6. Koslov VI, Bagrov SN, Anisimova SY, et al. Non-penetrating deep scle-
rectomy with collagen. Ophthalmic Surg 1990;3:44-6.
7. Dahan E, Drusedau MU. Non-penetrating filtration surgery for glau-
coma: control by surgery only. J Cataract Refract Surg 2000;26(5):
6
95-701.
8.
Tanihara H, Negi A, Akimoto M, Terauchi H, Okudaira A, Kozaki J,
Takeuchi A, Nagata M. Surgical effects of trabeculotomy ab externo
on adult eyes with primary open angle glaucoma and pseudoexfolia-
tion syndrome.
Arch Ophthalmol 1993;111(12):1653-61.
9
. Konstas AG, Mantziris DA, Stewart WC. Diurnal intraocular pressure
in untreated exfoliation and primary open-angle glaucoma.
Arch
Ophthalmol
1997;115(2):182-5.
10. Linblom B, Thorburn W. Prevalence of visual field defects due to cap-
sular and simple glaucoma in Halsingland, Sweden.
Acta Ophthalmol
(Copenh)
1982;60(3):353-361.
11. Teus MA, Castejon MA, Calvo MA, Perez-Salaices P, Marcos A.
Intraocular pressure as a risk factor for visual field loss in pseudoex-
foliative and in primary open-angle glaucoma.
Ophthalmology
1998;105(12):2225-9; discussion 2229-30.
1
2. Grant WM. Experimental aqueous perfusion in enucleated human
eyes.
Arch Ophthalmol 1963;69:783-801.
13. Ethier CR, Kamm RD, Palaszewski BA, Johnson MC, Richardson TM.
Calculations of flow resistance in the juxtacanalicular meshwork.
Invest Ophthalmol Vis Sci 1986;27(12):1741-50.
14. Johnson DH, Johnson M. How does nonpenetrating glaucoma
surgery work? Aqueous outflow resistance and glaucoma surgery.
J Glaucoma 2001;10(1):55-67.
15. Johnstone MA, Grant WM. Microsurgery of Sc
hlemm's canal and the
human aqueous outflow system.
Am J Ophthalmol 1973;76(6):906-17.
16. Smit BA, Johnstone MA. Effects of viscoelastic injection into
Schlemm's canal in primate and human eyes: potential relevance to
viscocanalostomy.
Ophthalmology 2002;109(4):786-92.
17. Mermoud A, Schnyder CC, Sickenberg M, Chiou AG, Hediguer SE,
F
aggioni R
. Comparison of deep sclerectom
y with collagen implant
and trabeculectomy in open-angle glaucoma.
J Cataract Refract Surg
1999;25(3):323-31.
18. Karlen ME, Sanchez E, Schnyder CC, Sickenberg M, Mermoud A.
Deep sclerectom
y with collagen implant: medium term results.
Br J
Ophthalmol
1999;83(1):6-11.
19. Spiegel D, Schefthaler M, Kobuch K. Outflow facilities through
Descemet's membrane in rabbits.
G
r
aef
es A
rch Clin Exp Ophthalmol
2002;240(2):111-3.
20. Fatt I. Permeability of Descemet's membrane to water.
Exp Eye Res
1969;8(3):340-54.
21. Marchini G, Marraffa M, Brunelli C, Morbio R, Bonomi L. Ultrasound
biomicroscopy and intraocular-pressure-lowering mechanisms of
deep sclerectomy with reticulated hyaluronic acid implant.
J Cataract
Refract Surg
2001;27(4):507-17.
22.
Chiou A
G
, Mermoud A, Underdahl J
P
, Sc
hn
yder CC. An ultrasound
biomicroscopic study of eyes after deep sclerectomy with collagen
implant.
Ophthalmolog
y
19
9
8;105(4):746-50.
23. Ravinet E, Bovey E, Mermoud A. T-Flux implant versus Healon GV in
deep sclerectomy. J Glaucoma 2004;13(1):46-50.
24. Johnstone MA, Grant WG. Pressure-dependent changes in structures
of the aqueous outflow system of human and monkey eyes. Am J Oph-
thalmol
1973;75(3):365-83.
25. Yarangumeli A, Gureser S, Koz OG, Elhan AH, Kural G. Visco-
canalostom
y versus trabeculectomy in patients with bilateral high-ten-
sion glaucoma.
Int Ophthalmol 2004;25(4):207-13. Epub 2005 Sep 29.
26. Cillino S, Di Pace F, Casuccio A, Lodato G. Deep sclerectomy versus
punc
h trabeculectom
y: effect of low-dosage mitomycin C.
Ophthal
-
mologica
2005;219(5):281-6.
Ophtalmologie
Conférences scientifiques
50. O’Brart DP, Rowlands E, Islam N, Noury AM. A randomised, prospective
study comparing trabeculectomy augmented with antimetabolites with a
viscocanalostomy technique for the management of open angle glaucoma
uncontrolled by medical therapy. Br J Ophthalmol 2002;86(7):748-54.
51. Wishart MS, Shergill T, Porooshani H. Viscocanalostomy and phacovisco-
canalostomy: long-term results. J Cataract Refract Surg 2002;28(5):745-51.
52. Hamel M, Shaarawy T, Mermoud A. Deep sclerectomy with collagen
implant in patients with glaucoma and high myopia. J Cataract Refract Surg
2001;27(9):1410-7.
53. Sunaric-Megevand G, Leuenberger PM. Results of viscocanalostomy for pri-
mary open-angle glaucoma.
Am J Ophthalmol 2001;132(2): 221-8.
5
4. Jonescu-Cuypers C, Jacobi P, Konen W, Krieglstein G. Primary visco-
canalostomy versus trabeculectomy in white patients with open-angle
glaucoma: A randomized clinical trial.
Ophthalmology 2001; 108(2):254-8.
55. El Sayyad F, Helal M, El-Kholify H, Khalil M, El-Maghraby A. Nonpenetrat-
ing deep sclerectomy versus trabeculectomy in bilateral primary open-
angle glaucoma.
Ophthalmology 2000;107(9):1671-4.
56. Gimbel HV, Penno EE, Ferensowicz M. Combined cataract surgery, intraoc-
ular lens implantation, and viscocanalostomy. J Cataract Refract Surg
1999;25(10):1370-5.
57. Stegmann R, Pienaar A, Miller D. Viscocanalostomy for open-angle glau-
coma in black African patients
. J Cataract Refract Surg 1999; 25(3):316-22.
58. Drusedau MU, von Wolff K, Bull H, von Barsewisch B. Viscocanalostomy for
primary open-angle glaucoma: the Gross Pankow experience. J Cataract
Refract Surg
2000;26(9):1367-73.
Le D
r
Khan et le D
r
Ahmed déclarent qu’ils n’ont aucune
divulgation à faire en association avec le contenu de cette
publication.
Réunions scientifiques à venir
25 au 28 mai 2006
Third International Congress of Glaucoma Surgery
Toronto, Ontario
Renseignements : www.icgs2006.com
21 au 24 juin 2006
Réunion annuelle de la Société canadienne d’ophtalmologie
(SCO)
Westin Harbour Castle
Toronto, Ontario
Renseignements : Ms Kim Ross
Courriel :
Site web : www.eyesite.ca/annualmeet-
ing/2006/
27. Devloo S, Deghislage C, Van Malderen L, Goethals M, Zeyen T. Non-pene-
trating deep sclerectomy without or with autologous scleral implant in
open-angle glaucoma: medium-term results.
Graefes Arch Clin Exp Oph-
thalmol
2005;243(12):1206-1212.
28. Funnell CL, Clowes M, Anand N. Combined cataract and glaucoma surgery
with mitomycin C:phacoemulsification-trabeculectomy compared to pha-
coemulsification-deep sclerectomy.
Br J Ophthalmol 2005;89(6):694-8.
29. Khairy HA, Green FD, Nassar MK, Azuara-Blanco A. Control of intraocular
pressure after deep sclerectomy.
Eye 2006;20(3): 336-340.
30. Anand N, Atherley C. Deep sclerectomy augmented with mitomycin C.
Eye
2005r;19(4):442-50.
3
1. Wevill MT, Meyer D, Van Aswegen E. A pilot study of deep sclerectomy with
implantation of chromic suture material as a collagen implant: medium-
term results.
Eye 2005;19(5):549-54.
32. Cillino S, Pace FD, Casuccio A, et al. Deep sclerectomy versus punch tra-
beculectomy with or without phacoemulsification: a randomized clinical
trial.
J Glaucoma 2004;13(6):500-6.
33. Yalvac IS, Sahin M, Eksioglu U, Midillioglu IK, Aslan BS, Duman S. Primary
viscocanalostomy versus trabeculectomy for primary open-angle glau-
coma:three-year prospective randomized clinical trial.
J Cataract Refract
Surg
2004;30(10):2050-7.
34. Shaarawy T, Mermoud A. Deep sclerectomy in one eye vs deep sclerectomy
with collagen implant in the contralateral eye of the same patient: long-
term f
ollow-up.
E
ye
2
005;19(3):298-302.
35. Shaarawy T, Mansouri K, Schnyder C, Ravinet E, Achache F, Mermoud A.
Long-term results of deep sclerectomy with collagen implant.
J Cataract
Refract Surg
2004;30(6):1225-31.
36. Lachkar Y, Neverauskiene J, Jeanteur-Lunel MN, et al. Nonpenetrating deep
sclerectomy: a 6-year retrospective study. Eur J Ophthalmol 2004;14(1):
26-36.
37. Neudorfer M, Sadetzki S, Anisimova S, Geyer O. Nonpenetrating deep scle-
rectomy with the use of adjunctive mitomycin C.
Ophthalmic Surg Lasers
Imaging
2004;35(1):6-12.
38. Park M, Tanito M, Nishikawa M, Hayashi K, Chichara E. Combined visco-
canalostomy and cataract surgery compared with cataract surgery in Japan-
ese patients with glaucoma.
J Glaucoma 2004;13(1):55-61.
39. Shaarawy T, Nguyen C, Schnyder C, Mermoud A.Comparative study
between deep sclerectomy with and without collagen implant, long term
follow up.
Br J Ophthalmol 2004;88(1):95-8.
4
0. Ates H, Uretmen O, Andac K, Azarsiz SS. Deep sclerectomy with a nonab-
sorbable implant (T-Flux): preliminary results.
Can J Ophthalmol.
2003;38(6):482-8.
41. Wishart PK, Wishart MS, Porooshani H. Viscocanalostomy and deep scle-
rectomy for the surgical treatment of glaucoma: a longterm follow-up.
Acta
Ophthalmol Scand
2003;81(4):343-8.
42. Carassa RG, Bettin P, Fiori M, Brancato R. iscocanalostomy versus tra-
beculectomy in white adults affected by open-angle glaucoma: a 2-year
randomized, controlled trial.
Ophthalmology 2003;110(5):882-7.
43. Luke C, Dietlein TS, Jacobi PC, Konen W, Krieglstein GK. A prospective ran-
domised trial of viscocanalostomy with and without implantation of a retic-
ulated hyaluronic acid implant (SKGEL) in open angle glaucoma.
Br J
Ophthalmol
2003;87(5):599-603.
44. Kobayashi H, Kobayashi K, Okinami S. A comparison of the intraocular
pressure-lowering effect and safety of viscocanalostomy and trabeculec-
tomy with mitomycin C in bilateral open-angle glaucoma.
Graefes Arch Clin
E
xp Ophthalmol
2
003;2
41(5):35
9-66. Epub 2
003 Apr 16.
45.
Shaarawy T
, Nguyen C, Sc
hnyder C, Mermoud A. Five year results of visco-
canalostomy.
Br J Ophthalmol. 2003;87(4):441-5.
46. Tanito M, Park M, Nishikawa M, Ohira A, Chihara E. Comparison of surgical
outcomes of combined viscocanalostomy and cataract surgery with com-
bined trabeculotom
y and cataract surgery
.
A
m J Ophthalmol
2
002;13
4(4):
513-2
0.
47. Luke C, Dietlein TS, Jacobi PC, Konen W, Krieglstein GK. A prospective
randomized trial of viscocanalostomy versus trabeculectomy in open-angle
glaucoma: a 1-year follow-up study.
J Glaucoma 2002;11 (4):294-9.
4
8. Kozobolis VP, Christodoulakis EV, Tzanakis N, Zacharopoulos I, Pallikaris
IG. Primary deep sclerectomy versus primary deep sclerectomy with the
use of mitomycin C in primary open-angle glaucoma.
J Glaucoma
2002;11(4):287-93.
49. Ambresin A, Shaarawy T, Mermoud A. Deep sclerectomy with collagen
implant in one eye compared with trabeculectomy in the other eye of the
same patient.
J Glaucoma 2002;11(3):214-20.
© 2006 Département d’ophtalmologie et des sciences de la vision, Faculté de médecine, Université de Toronto, seul responsable du contenu de cette publication. Édition : SNELL Communication
Médicale Inc
. avec la collaboration du Département d’ophtalmologie et des sciences de la vision, Faculté de médecine, Université de Toronto.
MD
Ophtalmologie – Conférences scientifiques est une marque
de commerce de
SNELL Communication Médicale Inc. Tous droits réservés. L’administration d’un traitement thérapeutique décrit ou mentionné dans Ophtalmologie – Conférences scientifiques doit
toujours être conforme aux renseignements d’ordonnance approuvés au Canada.
SNELL Communication Médicale se consacre à l’avancement de l’éducation médicale continue de niveau supérieur.
L’élaboration de cette publication a bénéficié d’une subvention à l’éducation de
Novartis Ophthalmics
130-021F
Les avis de changement d’adresse et les demandes d’abonne-
ment pour
Ophtalmolog
ie – Conférences Scientifiques
doivent
être envoyés par la poste à l’adresse C.P. 310, Succursale H,
Montréal (Québec) H3G 2K8 ou par fax au (514) 932-5114 ou
par courrier électronique à l’adresse
V
euillez vous référer au bulletin
Ophtalmolog
ie – Confér
ences
Scientifiques
dans votre correspondence. Les envois non
distribuables doivent être envoyés à l’adresse ci-dessus.
P
oste-
publications #4
0032303
SNELL
La version française a été révisée par le professeur Pierre Lachapelle,
Montréal.
Ophtalmologie
Conférences scientifiques
S
EPTEMBRE/OCTOBRE 2006
Volume 4, numéro 5
COMPTE RENDU DES CONFÉRENCES
SCIENTIFIQUES DU DÉPARTEMENT
D’OPHTALMOLOGIE ET
DES SCIENCES DE LA VISION,
FACULTÉ DE MÉDECINE,
UNIVERSITÉ DE TORONTO
Département d’ophtalmologie
et des sciences de la vision
Faculté de médecine
Université de Toronto
60 Murray St.
Bureau 1-003
T
oronto (Ontario) M5G 1X5
Le contenu rédactionnel d’Ophtalmologie –
Conférences scientifiques
est déterminé
exclusivement par le Département
d’ophtalmologie et des sciences de la vision,
Faculté de médicine, Université de T
oronto.
Département d’ophtalmologie
et des sciences de la vision
Jeffrey Jay Hur
witz, M.D., Rédacteur
Professeur et président
Martin Steinbach, Ph.D.
Directeur de la recherche
The Hospital for Sick Children
Elise Heon, M.D.
Ophtalmologiste en chef
Mount Sinai Hospital
Jeffrey J. Hurwitz, M.D.
Ophtalmologiste en chef
Princess Margaret Hospital
(Clinique des tumeurs oculaires)
E. Rand Simpson, M.D.
Directeur
, Ser
vice d’oncologie oculaire
St. Michael’
s Hospital
Alan Berger, M.D.
Ophtalmologiste en chef
Sunnybrook and Women’s College
Health Sciences Centre
W
illiam S. Dixon, M.D.
Ophtalmologiste en chef
The Toronto Hospital
(Toronto Western Division and
Toronto General Division)
Robert G. Devenyi, M.D.
Ophtalmologiste en chef
Le traitement de l’ectropion et de l’entropion
pour l’ophtalmologiste polyvalent
PAR JEFFREY J. HURWITZ, M.D., FRCSC
L’ectropion (caractérisé par la rotation externe du rebord palpébral) et l’entropion (carac-
térisé par la rotation interne du rebord palpébral) peuvent toucher les paupières supérieure et
inférieure. Pour la paupière inférieure, l’étiologie peut être cicatricielle mais plus souvent,
cette affection est due à l’âge et à une modification des structures de soutien de la paupière
inférieure qui se relâchent. Cependant, pour la paupière supérieure, l’affection est presque
toujours d’origine cicatricielle et due à des modifications inflammatoires et/ou fibreuses de la
conjonctive ou de la peau. Au fils des ans, des centaines d’interventions ont été décrites dans
les ouvrages scientifiques pour traiter ces affections
1
. Les modifications des structures
palpébrales dues à l’âge sont les principaux facteurs entraînant l’apparition d’un ectropion et
d’un entropion non cicatriciels de la paupière inférieure. Il est important de comprendre ces
modifications et le fonctionnement palpébral pour déterminer si le patient développera un
entropion ou un ectropion. Occasionnellement, les patients présentent un entropion qui, sans
traitement chirurgical, évolue ensuite en un ectropion, ce qui indique qu’il peut exister un
continuum entre des deux entités cliniques. Les modifications cicatricielles et inflammatoires
de la conjonctive peuvent toucher la paupière supérieure et/ou la paupière inférieure dans le
cas d’un entropion cicatriciel. De même, des modifications cutanées peuvent apparaître sur la
paupière supérieure et/ou inférieure chez les patients atteints d’un ectropion cicatriciel.
Lorsqu’un patient consulte pour un ectropion ou un entropion, l’ophtalmologiste devrait
avoir immédiatement à l’esprit le plan thérapeutique à adopter. L’approche la plus utile
offrant la plus grande chance de succès permanent est facilement établie en examinant toutes
modifications liées à l’âge, modifications pathophysiologiques et anomalies du fonction-
nement palpébral. De nombreuses interventions simples et rapides ont été décrites dans la
littérature scientifique pour le traitement de ces affections, mais nombre d’entre elles n’ont
pas offert un soulagement permanent du problème sous-jacent. Cela ne signifi
e pas que des
interventions plus complexes sont toujours indiquées, mais il serait prudent que le chirurgien
adopte l’approche la moins invasive offrant la meilleure chance de guérison durable. Ce
numéro d’
Ophtalmologie – Conférences scientifiques aidera l’ophtalmologiste polyvalent à
établir le diagnostic et le traitement de ces anomalies des paupières.
Classification
Une classification simplifiée de ces affections est utile pour aider le chirurgien à déterminer
l’intervention de choix.
Entropion (figure 1) : Il est nécessaire d’établir la différence entre un entropion véritable et un
épiblépharon. Un entropion véritable (figure 2) se caractérise par une rotation interne du rebord
palpébral, alors que dans le cas d’un épiblépharon, la lamelle antérieure pousse les cils vers l’in-
térieur (figure 3). Un trichiasis et un distichiasis isolés doivent être différenciés d’un entropion. Un
distichiasis se caractérise par une métaplasie des orifices des glandes meibomius et une deuxième
rangée de cils surnuméraires se forme anormalement postérieurement à la première normalement
implantée (figure 4). Un trichiasis correspond à une déviation vers le globe oculaire des cils qui
sont implantés normalement et suivent le f
ollicule pileux. Dans les deux cas, le rebord palpébral ne
se tourne pas vers l’intérieur et il ne s’agit pas d’un entropion véritable.
Un entropion véritable peut être classé comme « cicatriciel » (figure 5) ou « non cicatriciel »
(figure 2). Un entropion non cicatriciel peut être à son tour subdivisé, selon le degré d’augmenta-
tion de la laxité palpébrale horizontale exagérée, comme étant caractérisé par « une laxité
palpébrale exagérée » ou par « l’absence de laxité palpébrale horizontale exagérée ». Cette classifi-
cation est extrêmement utile pour la paupière inférieure. Cependant, pour la paupière supérieure,
MD
Département
d’ophtalmologie et des
sciences de la vision
FACULTY OF MEDICINE
University of Toronto
Disponible sur Inter
net à :
www
.ophtalmologieconferences.ca
Des sections de cet article ont été tirées et modifiées d’une publication du docteur J.J. Hurwitz intitulée
“A Simplified Approac
h to E
yelid Malposition”
publiée dans
Clinical Signs in Ophthalmolog
y
2
000;V
o
l
XX(1):4
-15.
pratiquement tous les cas d’entropions véritables sont
d’origine cicatricielle.
Ectropion (figure 6) : En présence d’un ectropion, on doit
établir la différence entre un ectropion véritable (rotation
externe du rebord palpébral) et une rétraction palpébrale
(exposition sclérale) (figure 7), dans laquelle une traction
vers le bas s’exerce sur la paupière inférieure et une traction
vers le haut s’exerce sur la paupière supérieure sans rota-
tion du rebord palpébral. Un ectropion véritable peut égale-
ment être subdivisé en « cicatriciel » et « non cicatriciel »
(figure 8). Les modifications cicatricielles se situent au
niveau de la lamelle antérieure, habituellement la peau.
Dans le cas d’un ectropion non cicatriciel, le traitement dif-
fère, selon la localisation de l’éversion de la paupière. Un
ectropion non cicatriciel peut être divisé en un ectropion
« partiel » (figure 9) et en un ectropion « de la totalité de la
paupière » (figure 8). Étant donné qu’un patient atteint d’un
ectropion non cicatriciel peut présenter une faiblesse du
muscle orbiculaire, une autre subdivision de l’ectropion de
la totalité de la paupière est utile, à savoir « sans paralysie
faciale » et « avec paralysie faciale » (figure 10). Un ectropion
de la paupière supérieure a généralement tendance à être
d’origine cicatricielle (le syndrome des paupières flasques
est une exception), alors qu’un ectropion de la paupière
inférieure a tendance à être non cicatriciel (bien que des
modifications cicatricielles secondaires puissent apparaître).
Cette classification n’est pas exhaustive, mais inclut la
plupart des cas cliniques et permet au chirurgien d’élaborer
un plan de traitement.
Modifications palpébrales liées à l’âge
Les modifications palpébrales liées à l’âge peuvent être
divisées en 4 régions :
•
La paupière proprement dit
•
Les structures de soutien
•
Les structures orbitales (permettant l’apposition des
paupières sur le globe)
•
Les considérations lacrymales
Modifications palpébrales : Les modifications palpébrales
peuvent être divisées en celles qui incluent la peau, le mus-
cle orbiculaire, le tarse ou la conjonctive. Avec l’âge, la peau
de la paupière subit des modifications atrophiques qui
peuvent entraîner la formation accrue de rides et la perte
du soutien des tissus sous-jacents. Avec l’âge, la synthèse
du collagène diminue au niveau de la peau palpébrale
2
. De
plus, l’exposition au soleil joue un très grand rôle dans les
modifications observées au niveau de la peau vieillissante,
qui sont habituellement liées à une élastose solaire du tissu
subépithélial
3
. Avec l’âge, le muscle orbiculaire a tendance à
s’étirer et ce phénomène est accentué lorsque le sujet se
frotte les paupières dans un mouvement vers le bas et vers
l’extérieur, affaiblissant ainsi davantage ce muscle
4
. On a
également émis l’hypothèse que le muscle orbiculaire
préseptal peut migrer antérieurement et supérieurement et
chevaucher le muscle orbiculaire prétarsal fixé plus ferme-
ment en arrière. Cependant, ce concept est controversé,
étant donné que l’on n’a pas déterminé clairement si le
muscle orbiculaire se déplace réellement ou si sa position
antéro-supérieure (par rapport au muscle orbiculaire pré-
tarsal) est due à la rotation vers l’avant du bord inférieur du
tarse dans le cas d’un entropion secondaire à la désinsertion
de l’aponévrose des muscles rétracteurs de la paupière
inférieure
5
. Le tarse a également tendance à perdre une
partie de son collagène et peut s’allonger avec l’âge
6
. La
conjonctive a tendance à devenir atrophique avec l’âge, sa
population de cellules caliciformes diminuant et pouvant
s’appauvrir en raison d’une inflammation catarrhale de
longue durée et chronique
7
.
Str
uctur
es de soutien:
A
vec l’âge, le tendon canthal
médial et le tendon canthal latéral s’étirent, ce phénomène
pouvant s’aggraver quand le sujet s’essuie ou se frotte les
paupières
6
. De plus, les structures de soutien de la paupière
inférieure (l’aponévrose capsulopalpébrale et le tarse de la
paupière inférieure) peuvent s’étirer ou se détacher du bord
inférieur du tarse, éliminant ainsi la rétraction normale de
la paupière sur le globe oculaire
8
. Avec la désinsertion des
muscles rétracteurs de la paupière supérieure (muscle
releveur de la paupière supérieure et tarse de la paupière
supérieure), un mécanisme semblable peut survenir au
niveau de la paupière supérieure pouvant entraîner un pto-
sis. Cependant, cela produit rarement un ectropion de la
Figure 1 : Classification de l’entropion
Pseudo-entropion Entropion véritable
Malposition des cils Cicatriciel Non cicatriciel
– Trichiasis Laxité Laxité
– Distichiasis palpébrale palpébrale
exagérée normale
Épiblépharon
Figure 3 : Épiblépharon congénital
Figure 2 : Entropion non cicatriciel dû à un relâchement
du bor
d palpébral
Figur
e 4:
Distichiasis acquis dû à un pemphigus
est réduit, non seulement par le point lacrymal inférieur,
mais également par le point lacrymal supérieur (en raison
de la perte de contact du point lacrymal et de la paupière
avec l’oeil)
14
. Une réduction du flux lacrymal par le point
lacrymal entraîne généralement une sténose secondaire du
point lacrymal. Les lysozymes des larmes causent souvent
une dermatite eczématoïde de la peau située au-dessous
du point lacrymal et produisent un ectropion cicatriciel
secondaire
15
, souvent exacerbé par l’irritation causée par le
fait que le sujet essuie constamment ses larmes. Une laxité
de la paupière, même si elle n’est pas due à un ectropion,
peut causer des larmoiements dus à un dysfonctionnement
de la pompe lacrymale.
Facteurs pathophysiologiques intervenant
dans le développement d’un entropion
et d’un ectropion
Modifications atrophiques
La désinsertion des muscles rétracteurs de la paupière
inférieure peut contribuer à l’instabilité du bord inférieur
du tarse. Par conséquent, la contraction du muscle orbicu-
laire – selon la longueur verticale de la conjonctive par rap-
port à la peau – entraîne la rotation du rebord palpébral
d’un côté ou de l’autre. Ce phénomène est exacerbé par
la laxité du tendon canthal latéral et dans une certaine
mesure, par la laxité du tendon canthal médial. Si les deux
tendons se relâc
hent signifi
cativement, le soutien horizon-
tal de la paupière est affaibli. Il se produit une éversion du
rebord palpébral et un ectropion (plutôt qu’un entropion) se
développe généralement. Selon notre expérience, dans le
cas d’un entropion non cicatriciel, la laxité du tendon can-
thal latéral est généralement modérée et celle du tendon
canthal médial est généralement légère.
La spasticité associée à un entropion est due au frotte-
ment des cils sur la cornée et/ou la conjonctive, qui cause
une action excessive du muscle orbiculaire
17
. Dans les cas
où un entropion évolue ultérieurement en un ectropion, le
frottement mécanique de la paupière peut allonger le ten-
don canthal médial, causant ainsi la perte totale de soutien
paupière supérieure sauf en présence de modifications cica-
tricielles cutanées importantes. En cas d’élongation extrême
du tarse de la paupière supérieure et d’étirement marqué
du tandon canthal médial et du tendon canthal latéral, la
paupière supérieure peut se relâcher et un « syndrome des
paupières flasques » peut se développer, dans lequel il peut
y avoir une éversion du rebord palpébral supérieur
9
. Un
syndrome des paupières flasques plus marqué peut appa-
raître lorsque la paupière supérieure est flasque et recouvre
la paupière inférieure, ce qui entraîne le frottement des cils
de la paupière inférieure sur la surface oculaire et produit
une irritation de la conjonctive (syndrome de chevauche-
ment des paupières)
10
.
Structures orbitaires : L’apposition des paupières sur le
globe est importante pour déterminer si elle deviendra
ectropique (rétractée) ou entropique. L’enseignement clas-
sique suggère qu’avec l’âge, il se produit une atrophie de la
graisse orbitaire
7
, de sorte qu’en présence de contracture du
muscle orbiculaire, la paupière inférieure n’a aucun support
du fait de la rétraction du globe oculaire, ce qui entraîne
une inversion du rebord palpébral. Les études qui ont
examiné les valeurs d’exophtalmométrie et si elles diminu-
aient ou non avec l’âge n’ont pas été concluantes
11,12
. Une
étude évaluant l’énophtalmie dans des cas d’entropion a
révélé qu’il n’était pas plus probable que les patients qui
souffrent d’entropion soient atteints d’enophtalmie que les
populations normales
13
. Cependant, nous avons observé
que les patients atteints d’
entropion présentent souvent
une récession de la fente orbitaire supérieure, ce qui peut
expliquer l’atrophie de la graisse orbitaire observée dans la
cavité orbitaire anophtalmique. L’amincissement de la sep-
tum orbitaire avec l’âge entraîne la protrusion de poches de
graisse intraorbitaire, qui peut affecter l’apposition de la
paupière sur le globe oculaire. Si l’on utilise une technique
de resserrement du bord de la paupière, en particulier chez
un patient atteint d’exophtalmie, le degré d’exophtalmie
peut être exacerbé, ce qui aggrave les problèmes d’apposi-
tion de la paupière sur le globe.
Considérations lacrimales : Le développement d’un ectro-
pion léger, en particulier médialement, entraîne une ten-
dance à l’éversion des points lacrymaux et le flux lacrymal
Figure 5 : Entropion cicatriciel (Note : Symblépharon) Figure 7 : Exposition sclérale et paupières inférieures
b
asses après une blépharoplastie esthétique
Figur
e 6
:
Classifi
cation d’un ectr
opion
Pseudo-ectropion Ectropion véritable
Exposition sclérale Cicatriciel Non cicatriciel
Point Totalité de
lacrymal la paupière
Muscle
Paralysie
orbiculair
e normale faciale
Figure 8 : Entropion non cicatriciel avec kératinisation
de la conjonctive