bài giảng Ankin
Bạn đang xem bản rút gọn của tài liệu. Xem và tải ngay bản đầy đủ của tài liệu tại đây (345.54 KB, 16 trang )
Chương II: HYDROCACBON
A. Hydrocacbon no (ankan)
B. Hydrocacbon chưa no có một nối đôi (anken)
C. Hydrocacbon chưa no có một nối ba (ankin)
I. Đồng đẳng, đồng phân, danh pháp
CH ≡ CH
CH ≡ C − CH
3
CH ≡ C − CH
2
− CH
3
axetilen
metyl axetilen
etyl axetilen
(C
2
H
2
)
(C
3
H
4
)
(C
4
H
6
)
-
Ankin là những hidro cacbon mạch hở có 1 liên kết
ba trong phân tử.
VD: Một số ankin
-
Dãy Ankin công thức chung là: C
n
H
2n-2
(n ≥ 2).
1. Đồng đẳng
HC ≡ C − CH
2
− CH
2
− CH
3
CH
3
− C ≡ C − CH
2
− CH
3
HC ≡ C − CH − CH
3
CH
3
-
Ankin từ C
4
trở đi có đồng phân vị trí liên kết ba, từ C
5
trở đi có thêm đồng phân mạch cacbon.
2.Đồng phân
VD: C
5
H
8
Tªn th«ng th êng:
S ch v trÝ lk ba inố ỉ ị –
Tªn m¹ch nh¸nh
Danh pháp
Tên gốc ankyl + axetilen
Tªn IUPAC:
S ch v trÝ Tªn nh¸nhố ỉ ị –
HC ≡ CH
HC ≡ C − CH
3
HC ≡ C − CH
2
− CH
3
Etin
CH ≡ CH
CH ≡ C − CH
3
CH ≡ C − CH
2
− CH
3
axetilen
metyl axetilen
etyl axetilen
(C
2
H
2
)
(C
3
H
4
)
(C
4
H
6
)
Propin
But 1 in– –
HC ≡ C − CH − CH3
CH3
3 metyl but 1 in– – –
II. Tính chất vật lý:
Nhiệt độ sôi, nhiệt độ nóng chảy, khối lượn g riêng một số ankin
Cấu tạo
t
s
0
,
0
C t
nc
0
,
0
C
D, g/cm
3
Etin HC ≡ CH
− 75 − 82
0,62
(− 80°C)
Propin
HC ≡ C − CH
3
− 23 − 104
0,68
(− 27°C)
But − 1 − in
HC ≡ CCH
2
CH
3
8
− 130
0,67 (0°C)
But − 2 − in
CH
3
C ≡ CCH
3
27
− 28
0,691 (20°C)
Pent − 1 − in
HC ≡ CCH
2
CH
2
CH
3
40
− 106
0,695 (20°C)
Pent − 2 − in
CH
3
C ≡ CCH
2
CH
3
55
− 101
0,714 (20°C)
Ankin là những chất không màu, C
2
H
2
, C
3
H
4
là chất khí, từ C
4
H
6
đến C
16
H
30
là chất lỏng và từ ≥ C
17
là chất rắn.
Ankin ít tan trong nước nhưng có thể tan trong môi hữu cơ
III. Cấu trúc phân tử:
Mô hình rỗng
•
Hai nguyên tử C
Hai nguyên tử C
lai
lai
hóa
hóa
ở trạng thái sp
ở trạng thái sp
•
Liên kết C ≡ C gồm 1liên kết
Liên kết C ≡ C gồm 1liên kết
σ
σ
và 2 liên kết
và 2 liên kết
π
π
Mô hình đặc
II. Tính chất hóa học
1. Phản ứng cộng:
−
Cộng hidro.
−
Cộng brom.
−
Cộng hidro clorua.
−
Cộng nước (hidrat hóa).
−
Phản ứng trùng hợp.
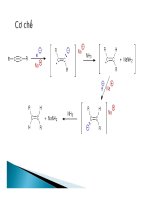
2. Phản ứng thế ion kim loại.
3. Phản ứng oxi hóa.
CH ≡ CH + H
2
2
a. Cộng hidro
-
Muốn dừng lại ở giai đoạn tạo ra anken thì phải
dùng xúc tác là hỗn hợp Pd với PbCO
3
CH
3
− CH
3
Ni, t°
CH ≡ CH + H
2
CH
2
= CH
2
Pd/PbCO
3
1. Phản ứng cộng:
b. Cộng brom
C
2
H
5
− C ≡ C − C
2
H
5
-
Muốn dừng lại ở giai đoạn thứ nhất thì cần thực
hiện phản ứng ở nhiệt độ thấp.
+ Br
2
3,4
−
dibrom
−
3
−
en
− 20°C
C
2
H
5
− C = CH − C
2
H
5
Br Br
C
2
H
5
− C = CH − C
2
H
5
3,3,4,4
−
tetrabromhexan
C
2
H
5
− C − C − C
2
H
5
Br Br
Br Br
+ Br
2
Br Br
c. Cộng tác nhân không đối xứng:
CH ≡ CH + HCl
+ HgCl
2
Vinyl clorua
150° − 200°C
CH
2
= CH −
CH
2
= CH − Cl
1,1
−
dicloetan
CH
3
− CH+ HCl
Cl
Cl
2
•
Phản ứng cộng HX:
phản ứng cộng HX vào Ankin trải qua 2 giai đoạn
-
Phản ứng cộng HX, H
2
O vào các ankin trong dãy đồng đẳng
của axetilen cũng tuân theo quy tắc Mac – cop – nhi – cop
như anken.
•
Cộng nước (hidrat hóa)
CH ≡ CH + H − OH
HgSO
4
, H
2
SO
4
andehit axetic
80°C
CH
3
− CH = O
CH
2
= CH − O − H
(không bền)
-
Hợp chất trung gian không bền chuyển thành andehit
hoặc xeton.
etin
CH
2
= CH − O − H
(không bền)
d. Phản ứng trùng hợp:
nCH ≡ CH (-CH=CH-)
n
200
o
C- 300
o
C
Cu
( cupren )
CH ≡ CH + CH ≡ CH CH
2
= CH - C ≡ CH
Cu
2
Cl
2
H
2
SO
4
3CH ≡ CH
C, 600
o
C
C
6
H
6
2. Phản ứng thế bằng ion kim loại:
-
Nguyên tử H đính vào cacbon mang liên kết ba linh
động hơn rất nhiều so với H đính với cacbon mang liên
kết đôi và liên kết đơn, do đó nó có thể bị thay thế bằng
nguyên tử kim loại.
R − C ≡ C − H +
[Ag(NH
3
)
2
]OH
-
Phản ứng trên không những dùng để nhận biết axetilen
mà cả các ankin có nhóm
H − C ≡ C − R (các ankin mà liên kết ba ở đầu mạch).
R − C ≡ C − Ag↓ + H
2
O + 2NH
3
kết tủa màu vàng nhạt
C
n
H
2n − 2
+
Giống như anken, ankin làm mất màu dung dịch KMnO
4
, khi
nó bị oxi hóa ở liên kết ba tạo ra hỗn hợp các sản phẩm
phức tạp, còn KMnO
4
thì bị khử thành MnO
2
(↓ màu đen).
nCO
2 + (n − 1)
H
2
O
phản ứng tỏa nhiều nhiệt
3n − 1
2
O
2
(∆H < 0)
3. Phản ứng oxi hóa
•
Phản ứng oxy hoá không hoàn toàn
•
Phản ứng oxy hoá hoàn toàn
3CH≡CH+ 8KMnO
4
+ H2O →3(COOK)
2
+ 2KOH
+ 8MnO
2
+ 2 H
2
O
1.500°C
III. Điều chế và ứng dụng:
1. Điều chế:
−
Trong công nghiệp:
CH
4
CH ≡ CH + H
2
↑
Nhiệt độ sôi của axetilen là − 75°C nên dễ
được tách ra khỏi hỗn hợp với hidro.
−
Trong phòng thí nghiệm:.
CaC
2
+ H
2
O Ca(OH)
2
+ C
2
H
2
đất đèn
2 3
lln
ClH
2
C – CH
2
Cl
HC≡ CH+ HCl
NaOH, C
2
H
5
OH
O
2
C
2
H
2
2. Ứng dụng:
t°
C
2
H
2
+ O
2
2CO
2
+ H
2
O
5
2
∆H − 1300KJ